Метаболический синдром: сложные и нерешенные проблемы


Опубликована Март 1, 2014
Последнее обновление статьи Окт. 13, 2022
Аннотация
В статье обсуждаются спорные вопросы метаболического синдрома (MC), четкости его критериев, реальной прогностической значимости. Описываются разные типы ожирения, которые складываются из разнообразных сочетаний общего и висцерального ожирения. Обосновывается необходимость выделения понятий “MC в узком и широком смысле слова”, которые имеют разные патогенетические механизмы и предполагают дифференцированный подход к их лечению. Приводится патогенетическое обоснование включения в кластер MC в узком смысле слова таких его компонентов как жировой гепатоз, синдром поликистозных яичников и других. Предлагаются в порядке обсуждения более точные формулировки для синдрома кластера множественных факторов риска вместо MC.
Ключевые слова
Метаболический синдром, кластер факторов риска, висцеральное ожирение
Одной из самых обсуждаемых междисциплинарных проблем современной медицины в последние годы стал метаболический синдром (MC), который обсуждают кардиологи, эндокринологи, гастроэнтерологи, гепатологи, гинекологи, ревматологи, сексопатологи, хирурги и другие специалисты. И каждый находит некие клинические проявления MC в области своих профессиональных интересов. Хорошо это или плохо? Трудно сказать, но это настораживает. Создается впечатление, что у этого синдрома критерии слишком мягкие, размытые, неконкретные. И это позволяет относить к нему бесконечное количество заболеваний и синдромов, при которых имеются какие-либо метаболические нарушения [1, 2]. Если так пойдет дальше, то скоро метаболическим синдромом можно будет назвать если не всю клиническую медицину, то уж кардиологию точно. Кроме, возможно, врожденных заболеваний.
Проблема усугубляется высокой распространенностью MC и его сердечно-сосудистыми рисками. В общей популяции она колеблется от 14 до 40%. [3,4]. Анализ крупного исследования показал, что MC встречается у 47 млн. американцев, что составляет 23,7% всей популяции [3]. В исследовании MONICA три и более компонента MC встречались у 10,7% населения. В России, согласно критериям ВОЗ, MC диагностируется у 18,6% мужчин до 40 лет и у 44,4% мужчин от 40 до 55 лет, а у женщин MC встречается у 7,3% до 40 лет и у 20,8% в возрасте от 40 до 55 лет [5]. При проведении мета-анализа И проспективных Европейских исследований, включающих 6156 мужчин и 5356 женщин без диабета в возра
сте с 30 до 89 лет, было выявлено, что MC встречается у 15% европейцев и риск развития смерти от всех причин и сердечно-сосудистых заболеваний (ССЗ) на протяжении 8,8 лет наблюдения был выше у лиц с MC, чем без него [7]. По данным мета-анализа 37 проспективных исследований, MC связан с риском ССЗ и смерти и был в 2 раза выше, чем без него [8].
В данной статье мы попробуем представить современное состояние проблемы MC и попытаемся понять, есть ли у MC шанс стать диагнозом с четкими критериями и классификационными признаками. А если нет — то зачем он нам нужен?
Немного истории
Принято считать, что нынешний MC под именем “Синдром X” описал Gerald Reaven в 1988 году. Важно подчеркнуть, что, пожалуй, его главная заслуга заключается в том, что он назвал общую причту для развития у одного больного артериальной гипертонии (АГ), особой дислипидемии с увеличением уровня триглицеридов (ТГ), снижения липопротеидов высокой плотности (ЛПВП), а также нарушения толерантности к глюкозе (НТГ) — инсулинорезистентность (ИР). Ограниченный формат обзорной статьи не позволяет углубиться в историю MC и отдать должное в изучении этого вопроса еще в 30—40-е годы А. Л. Мясникову, Г. Ф. Лангу, а позже — Р. Avogaro, N. Mehnert, N. Kaplan и многим другим отечественным и зарубежным ученым.
Дальнейшее изучение MC позволило связать его клинические проявления не только с ИР, но и с особым типом ожирения — “андроидным”, “типа яблока”, абдоминальным. При этом имелось в виду накопление не подкожного, а висцерального, “нутряного” жира, особые свойства которого как мощного нейрогуморального органа будут описаны ниже.
Накопление данных о MC потребовало выделить его классифицирующие признаки. В большинстве классификаций в качестве его основного критерия предлагалось абдоминальное ожирение (АО), а в качестве дополнительных — высокий уровень триглицеридов (ТГ), сниженный уровень ЛПВП, АГ, НТГ, причем два из упомянутых критериев должны быть у пациента [8].
Возможно, выбор АО в качестве основного классифицирующего признака MC, привело к его последующему “хождению по мукам”.
“Парадокс ожирения” и что из этого следует
Казалось бы, взаимосвязь ожирения с увеличением сердечно-сосудистого риска уже не вызывала сомнений. [9]. Но в последние годы опубликованы результаты исследований, в которых связь ожирения с увеличением риска подвергнута сомнению. Так, в Хорватии [10] у пациентов в группах с индексом массы тела (ИМТ) >30 кг и >35 кг не было выявлено значимой связи ожирения с распространенностью хронических сопутствующих заболеваний, лабораторных параметров и систолической дисфункции левого желудочка. В исследованиях пациентов с тяжелой хронической сердечной недостаточностью (ХСН) было выявлено, что чем выше ИМТ, тем выше процент выживаемости, а многофакторный анализ показал обратную связь между ИМТ и смертностью больных с ХСН [И]. Подобные закономерности выявлены и у пациентов с ишемической болезнью сердца (ИБС) [12, 13].
Анализ регистра New York State Angioplasty Registry, включающий 95435 пациентов после ЧКВ, выявил более низкий процент major adverse cardiac events (MACE) в течение 1 года наблюдения у пациентов с ИМТ 30—34,9 кг/м2 и ИМТ 35—39,9 кг/м2, нежели у пациентов с нормальным весом. С другой стороны, в этом же исследовании в экстремальных группах с ИМТ <18,5 кг/м2 и ИМТ >40кг/м2 были самые высокие показатели смертности от ССЗ [14].
Обзор 40 исследований, включивший 250 тысяч пациентов с ИБС в течение 3,8 лет наблюдения показал, что у пациентов с ожирением и повышенным весом более низкий риск общей сердечно-сосудистой смертности, чем у пациентов с низким и нормальным весом. В то же время у пациентов с ИМТ >35 кг/м был отмечен самый высокий риск смерти от ССЗ (ОР - 1,88 (ДИ 1,05-3,34) [15].
Подобные эффекты были показаны при многих хронических заболеваниях, в том числе хронической обструктивной болезни легких (ХОБЛ) [16], сахарном диабете типа 2 (СД2) [17], остром коронарном синдроме (ОКС) [18], мерцательной аритмии [19] и даже при некоторых онкологических заболеваниях [20].
Некоторые исследователи стали описывать данное явление как “парадокс ожирения”, другие — как “обратная эпидемиология” (“reverse epidemiology”).
В поисковой системе PubMed в 2012г идентифицировано более 200 публикаций, в названии которых звучала фраза “парадокс ожирения”. Несмотря на это, механизмы описанного парадоксадо конца не изучены. Некоторые авторы считают, что сам факт ожирения не является фактором риска (ФР), а значение имеет отсутствие достаточной физической активности у большинства пациентов с повышенным весом [21], другие — что в проведенных исследованиях не учитывался статус курения и наличие ХОБЛ у худых пациентов, которые могли бы бытъ мощными факторами неблагоприятного прогноза [22]. Кроме того, сам факт снижения веса абсолютно при любых заболеваниях организма изначально является мощным фактором неблагоприятного прогноза [23]. Возможно, одним из защитных свойств организма от эндотоксинов, про- воспалительных цитокинов у пациентов с ХСН на фоне ожирения являются высокие запасы метаболических и энергетических резервов жировой ткани.
Также в жировой ткани имеются плотно расположенные рецепторы к цитокинам, которые отчасти нейтрализуют интерлейкины и фактор некроза опухоли (ФНО), значительно повышенные при ХСН [22].
Но, пожалуй, наиболее логичное объяснение “парадокса ожирения”, заключается в том, что во всех проведенных исследованиях для диагностики ожирения использовался ИМТ, который выявляет общее ожирение, но не является маркером висцерального ожирения [22]. Весьма вероятно, что у многих пациентов, включенных в исследования, описавших “парадокс ожирения”, преобладало не висцеральное нейрогуморально активное, а инертное подкожное ожирение. Поэтому поиск параметров ожирения, наиболее точно отражающих сердечно-сосудистый риск, стал чрезвычайно актуальным [24].
В последние годы все больше научных исследований подтверждают, что одним из основных механизмов, ведущих к развитию сердечно-сосудистых осложнений (ССО) у пациентов с ожирением, является специфическая гормональная активность висцеральной жировой ткани, адипоциты которой в норме располагаются не только в абдоминальной области, но и вокруг сердца, почек, печени, сосудов [25, 26]. Насколько же точно мы в критериях MC выявляем именно висцеральное ожирение?
Абдоминальное ожирение как основной критерий MC
Основным компонентом MC принято считать АО как отражение висцерального ожирения [27], степень которого во всех классификациях предлагается оценивать по косвенному показателю — величине окружности талии (ОТ).
ОТ в клинической практике используется как маркер висцерального ожирения, так как она коррелирует с объемом висцерального жира, диагностированного с помощью КТ [28]. Важность определения ОТ как предиктора кардиометаболических факторов риска (повышенное кровяное давление, дислипидемии и гипергликемии) и неблагоприятные исходы (сахарный диабет, ИБС и смертность) была изучена во многих крупных эпидемиологических исследованиях [29—32], в которых было показано, что ОТ является более мощным предиктором кардиометаболических нарушений и их неблагоприятных исходов, чем ИМТ. На основании этих исследований в 1998 году ВОЗ было предложено использовать ОТ у мужчин свыше 102 см, у женщин — свыше 88 см в качестве критерия АО. В 2005 году Международная Федерация Диабета (IDF) предложила ужесточить критерии АО о величине ОТ для мужчин от 94 см, для женщин — от 80 см. Такие же критерии приняты ВНОК в 2007 году. Но в 2013 году в рекомендациях Европейского общества кардиологов по АГ вновь вернулись к критериям АО, ранее предложенным ВОЗ [33].
Тем не менее, до сих пор нет убедительных доказательств того, что определение ОТ предоставляет дополнительную клинически значимую информацию, не зависящую от известных кардиометаболических факторов риска в отношении ССЗ [34]. Это связано с разными причинами, одна из которых — отсутствие до настоящего времени стандартизованного подхода к измерению ОТ. В различных исследованиях были использованы различные анатомические ориентиры для измерения ОТ. Кроме того, место измерения, которое обеспечивает наибольшую корреляцию с сердечно-сосудистым риском не было установлено [34]. В исследованиях, показавших связь между значениями ОТ и прогнозом, в качестве анатомического ориентира наиболее часто применялась середина расстояния между нижним ребром и подвздошным бугром [35]. Кроме того, величина ОТ значимо зависит от положения пациента при измерении, приема пищи, акта дыхания и конституциональных особенностей. Но, пожалуй, главной проблемой данной методики является то, что ОТ отражает не только количество висцерального жира, но и толщину инертной подкожной жировой ткани (ЖТ) поясничной области, передней брюшной стенки, жира забрюшинного пространства, что приводит к гипердиагностике висцерального ожирения и MC в клинической практике.
Тем не менее, выявление для диагностики MC именно оценка наличия висцерального ожирения чрезвычайно важна.
Висцеральный жир, в отличие от подкожного, представляет собой гормонально-активную белую ЖТ, продуцирующую большое количество биологически активных веществ (БАВ) — адипокинов, хемокинов, цитокинов, гормонально-активных протеинов, активно участвующих в формировании инсулинорезистентности, метаболических нарушений, процессов воспаления, тромбообразования и атеро- генеза. Интраабдоминальные адипоциты имеют большую плотность ^-адренорецепторов, кортикостероидных и андрогенных рецепторов и относительно меньшую плотность-адренорецепторов и рецепторов к инсулину [36]. Это определяет высокую чувствительность висцеральной жировой ткани к липолитическому действию катехоламинов и низкую — к антилиполитическому действию инсулина [37]. Висцеральная жировая ткань хорошо крово- снабжается и иннервируется, поэтому БАВ, продуцируемые адипоцитами висцерального жира, легко проникают в органный и системный кровоток [38].
Итак, пришло понимание, что ожирение — понятие разноплановое. Общее ожирение не всегда связано с увеличением сердечно-сосудистого риска, а вот другой тип ожирения — висцеральный, увеличивает этот риск всегда.
Разнообразие видов ожирения
Многочисленные исследования позволяют выделить различные подтипы ожирения с разной выраженностью метаболических нарушений и, соответственно, различным риском ССО [39].
Sucurro Е. et al. [40] в 2008 году предложил выделять две группы с различными типами ожирения:
— пациенты с общим ожирением по ИМТ, но метаболически здоровые, т.е. с метаболически здоровым с ожирением (МетЗО). У таких тучных пациентов сохранена нормальная чувствительность к инсулину и благоприятный профиль риска ССЗ [41—43]. Этот тип ожирения встречается от 2% до 28% у женщин и менее 3% у мужчин [44].
— пациенты с нормальной массой тела по ИМТ, но “метаболически тучные” (МетТНМ), так как имеют висцеральное ожирение и явные признаки метаболической дисфункции в виде нарушения чувствительности к инсулину, ЛПВП, f глюкозы натощак, f ТГ, АГ.
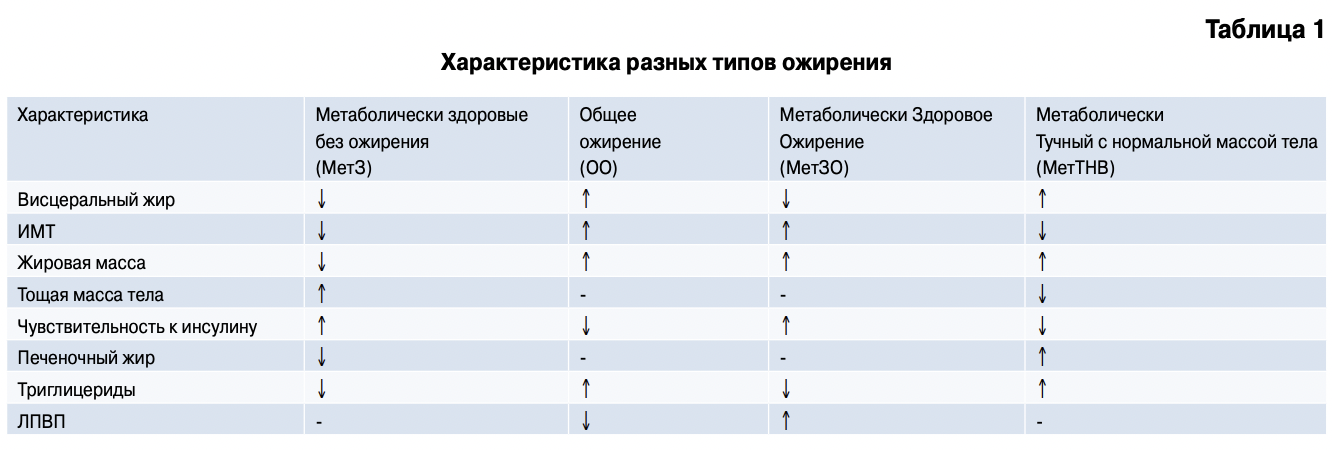
Karelis А. D. et al. [45] рассмотрели различия между лицами МетЗО, МетТНМ, с равномерно общим ожирение (ОО) и метаболически здоровыми людьми (МетЗ) без общего и висцерального ожирения (табл. 1). МетЗО по сравнению с пациентами ОО имеют нормальный метаболический профиль риска и высокий индекс чувствительности к инсулину.
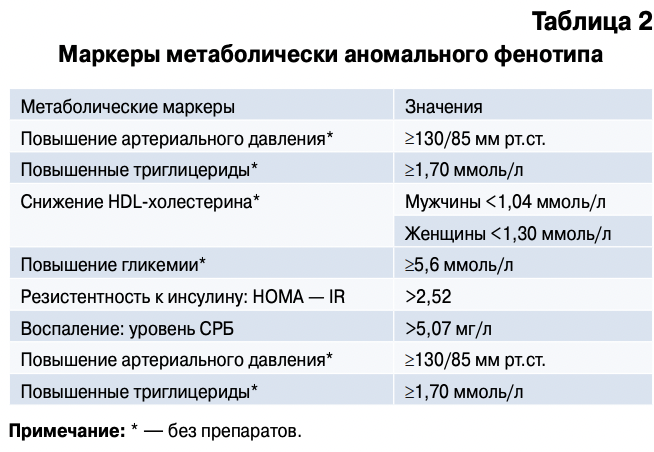
Термин метаболически аномальный фенотип при висцеральном ожирении означает наличие хотя бы 2 аномальных маркеров из представленных в таблице 2 [45].
Romero-Corral А.И. et al. [46] показали, что среди лиц, отнесенных к МетТНМ, распространенность MC была в 4 раза, а у женщин в 8 раз выше, чем среди лиц МетЗ без любых вариантов ожирения, а также была высокая распространенность дислипидемии, СД2, гипергликемии без СД, центрального ожирения и АГ. Исследование в Бразилии 1222 субъектов 23—25 лет показало, что МетТНМ был связан с высоким риском развития MC (OR=6,83, 95% ДИ 2,84— 16,47), низкой чувствительностью к инсулину (OR=3,89, 95% ДИ 2,39—6,33) и высокой секрецией инсулина (OR=2,17, 95% ДИ 1,24—3,80) [47], низким уровенем холестерина ЛПВП. Причем, у женщин с МетТНМ было в 2,2 раза больше шансов умереть от ССЗ, а повышенный риск смертности был независим от наличия АГ, СД и дислипидемии.
Синдром висцерального ожирения
Итак, как показано выше, ОТ не является точным медицинским маркером, таким как артериальное давление или уровень ТГ, а только суррогатным маркером разного вида ожирения. Хотя ОТ коррелирует с висцеральным ожирением сильнее, чем ИМТ, он оценивает общее количество жира в абдоминальной области, в том числе подкожного и висцерального, поэтому окружность талии часто не коррелирует с другими рисками, такими как глюкоза в крови натощак, ТГ, ЛПНП, АГ.
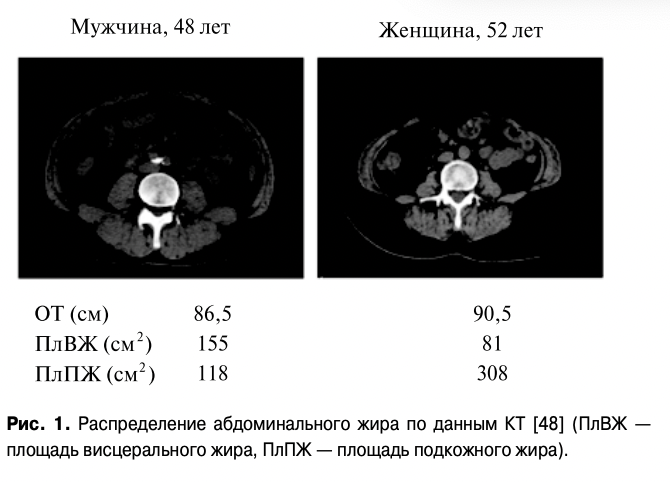
Точным методом оценки висцерального жира является компьютерная томография (КТ). The Japanese Committee for the Definition and Diagnosis of Metabolic Syndrome принял пороговое значение площади висцерального жира, рассчитанной при КТ, как 100 см как для мужчин, так и женщин, по результатам исследований, доказавших, что сердечно-сосуди
стые риски увеличиваются, начиная с этой точки у мужчин и женщин в равной степени. ОТ, соответствующий площади висцерального жира 100 см по КТ составляет 85 см у мужчин и 90 см у женщин [48]. Пример такого распределения абдоминального жира представлен на рисунке 1.
При этом в соответствие критериям ATP III и заявлению от Joint Scientific Statement on metabolic syndrome [49], американские коллеги продолжают настаивать, что абдоминальное ожирение не является обязательным компонентом, а три аномальных параметра из пяти компонентов должны квалифицироваться в качестве MC. Согласно данной концепции, MC — это кластер нескольких факторов риска, в котором висцеральный жир лишь один из возможных, но не обязательных параметров.
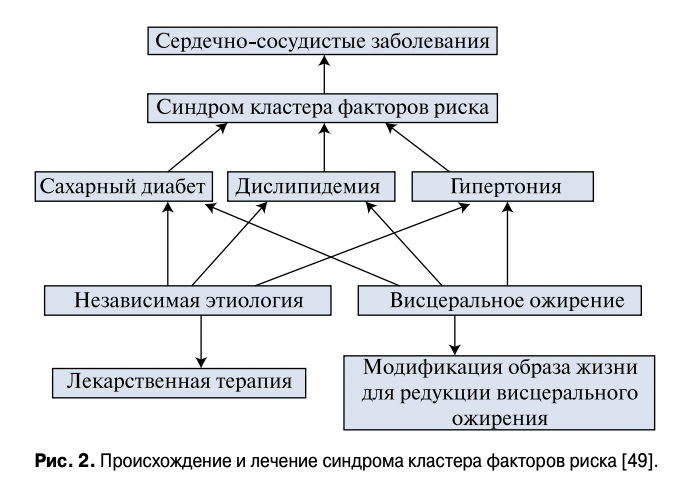
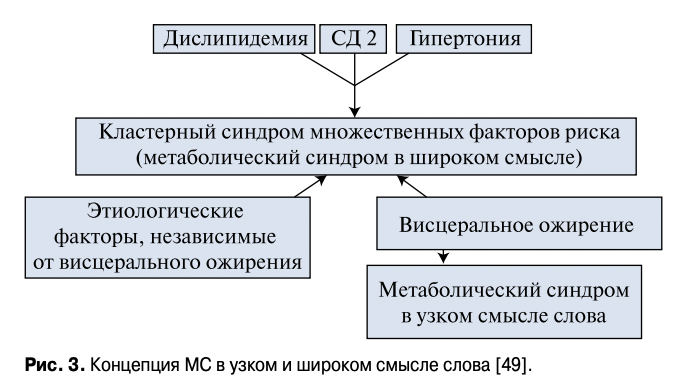
Если считать оба мнения имеющими право на существование, то, возможно, синдром кластера множественных метаболических факторов риска следует разделить на два типа. Первый тип, при котором накопление висцерального жира играет ключевую роль в развитии риска сердечно-сосудистых заболеваний, предложено называть “MC в узком смысле” [50]. Другой тип, при котором несколько метаболических факторов риска могут собраться у конкретного пациента случайно и иметь разные этиопатогенетические механизмы, можно назвать “MC в широком смысле слова”. Соответственно, цели и схемы лечения таких больных могут отличаться. Главная, первичная цель лечения MC, вызванного накоплением висцерального жира, заключается в изменении образа жизни для снижения висцерального ожирения, что должно иметь приоритет над медикаментозным лечением конкретных проявлений MC (рис. 2). Пациентов, у которых АГ, СД и дислипидемия имеют разное происхождение, лечение требует приоритета медикаментозной терапии каждого синдрома и заболевания. По-нашему мнению, этот кластер синдромов не стоит считать и называть MC.
Наше мнение согласуется с позицией The Japanese Committee for the Definition and Diagnosis of Metabolic Syndrome, который утвердил критерии для MC в узком смысле [48], вызванного накоплением висцерального жира. Предполагаемая взаимосвязь этих “типов” MC представлена на рисунке 3.
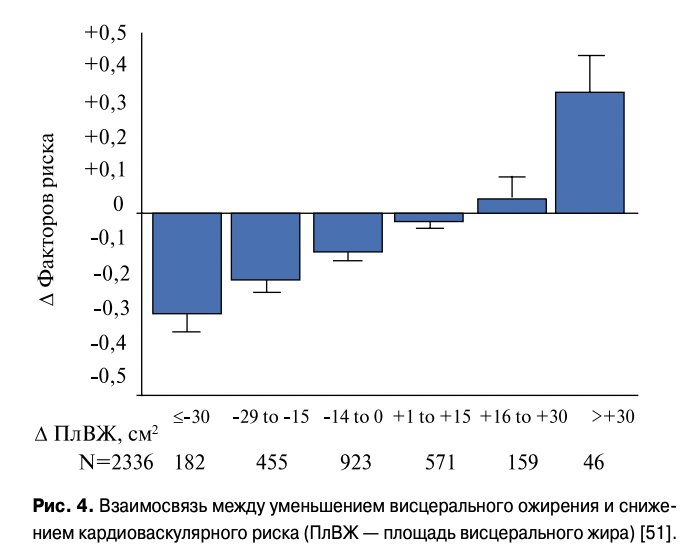
При таком понимании MC открывается резерв профилактики ССЗ. В исследовании Okauchi Y. et al. было показано, что степень снижения висцерального ожирения четко коррелирует со снижением факторов риска (рис. 4) [51].
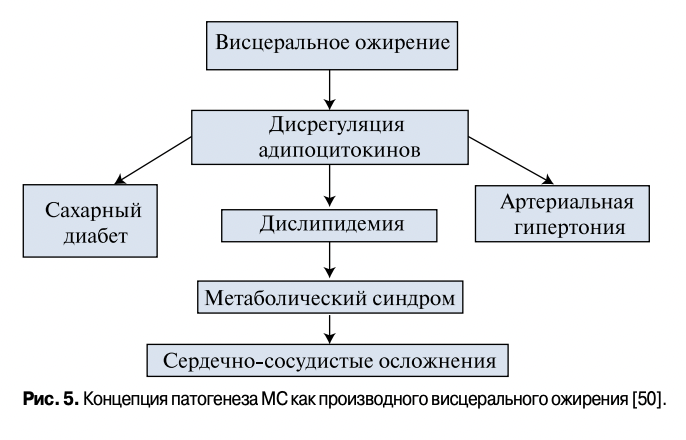
Концепцию MC как производного висцерального ожирения (рис. 5) японские авторы подтверждают многочисленными собственными исследованиями, в которых была выявлена взаимосвязь адипокинов висцеральной жировой ткани с риском развития ССО иСД2 [50].
Поскольку наличие висцерального ожирения является специфическим и верифицирующим признаком MC, нам представляется, что пример диагноза, которым можно было бы заменить MC в узком смысле, мог бы звучать так:
Висиеоальное ожирение: АГ. дислипидемия. НТГ
Возможно, было бы правомочно деление больных на формы, в зависимости от наличия общего ожирения по ИМТ, например:
Висиеоальное ожирение тѵчных (ВОТ)
Висиеоальное ожирение хѵдых (BOX)
При таком понимании MC взаимосвязь его различных проявлений становится достаточно ясной, логичной. Пожалуй, не очень понятным остается место таких проявлений MC как поликистоз яичников, жировой гепатоз, дисфункция почек, сексуальная дисфункция и ряд других. Но этим проявлениям тоже можно найти логичное объяснение в рамках концепции локальных жировых депо.
Локальные висцеральные жировые депо
У людей прогрессирование ожирения приводит к отложению жира не только в типичных местах — подкожно-жировая клетчатка и брюшная полость (абдоминальное жировое депо), но и вокруг таких органов как сердце, кровеносные сосуды, почки. Локальные жировые депо вызывают не только механическое воздействие и давление на рядом расположенные органы, вызывая их дисфункцию, но и влияют на системные реакции организма через адипокины и цитокины.
Абдоминальное жировое депо составляет висцеральная жировая ткань, расположенная вокруг брыжеечных петель, в большом и малом сальниках и в ретроперитонеальном пространстве. Доказана связь абдоминальной жировой ткани с метаболическими нарушениями и кардиоваскулярным риском, развитием дислипидемии, ИР, СД 2 и АГ [52]. Доказана связь АО с ранним развитием атеросклероза сонных артерий [53] и ИБС [54].
Мышечное жировое депо. Выявлено, что липиды у пациентов с ожирением расположены не только в межмышечном пространстве, но и внутриклеточно. Адипоциты мышечной ткани стимулируют увеличение образования цитокинов, которые способствуют развитию ИР мышечных волокон [55].
Почечное жировое депо. При прогрессировании общего ожирения висцеральная белая жировая ткань (БЖТ) начинает накапливаться в почечной пазухе. Это приводит к механическому сдавлению почечных вен и лимфатических сосудов, повышению внутрипочечного давления и увеличению реабсорбции натрия, что является одним из механизмов развития АГ у тучных пациентов [56]. Кроме того, отложение БЖТ в почках приводит к активации ренин-ангиотензин-альдостероновой системы, что оказывает прямое влияние на развитие ИР и СД 2 типа.
Периваскулярное жировое депо. БЖТ располагается практически вокруг всех сосудов в организме, особенно много адипоцитов было обнаружено вокруг коронарных сосудов и аорты, где расстояние от адвен- тиции до жировых клеток менее 0,1 мм. Жировая ткань выполняет не только опорную роль для кровеносных сосудов, но и обладает секреторной активностью и содержит множество цитокинов и хемокинов [57]. Увеличение жесткости сосудистой стенки коррелировало с количеством периваскулярного жира [58]. Скопление жировых отложений вокруг адвентиции сосудов вызывает оксидативный стресс с изменением сосудистого тонуса и развитием системной вазоконстрикции [59].
Эпикардиальное жировое депо (ЭЖТ) располагается между миокардом и висцеральным листком перикарда и занимает % поверхности сердца в атриовентрикулярной и межжелудочковой борозде, вдоль крупных ветвей коронарных артерий (КА), вокруг предсердий, за свободной стенкой правого желудочка и верхушкой левого желудочка [60]. При прогрессировании ожирения ЭЖТ заполняет свободную стенку желудочков, покрывая всю поверхность миокарда. Изучено, что адипоциты ЭЖТ имеют меньший размер, но более высокие концентрации свободных жирных кислот, БАБ и клеток воспаления, чем жировые депо других локализаций [61]. Количество адипоцитов на грамм ЭЖТ является самым высоким в сравнении с жировыми депо других локализаций [62]. Адипоциты ЭЖТ проникают в миокард, располагаясь вдоль адвентиции коронарных артерий. Доказано, что соединительно-тканные перегородки не отделяют жировую ткань от миокарда. ЭЖТ кровоснаб- жается ветвями КА и имеет общую систему микроциркуляции с миокардом, поэтому локально может оказывать влияние как на КА, так и на миокард [63].
В наших исследованиях было доказано, что при толщине ЭЖТ >6 мм значимо увеличивается риск развития коронарного атеросклероза, а также рестенозов коронарных артерий после их стентирования [64, 65]. Кроме того, нам удалось доказать, что толщина ЭЖТ >7 мм [66] является маркером инсулинорезистентности.
Печеночное жировое депо (стеатоз печени). Ожирение печени (Fatty liver) является наиболее распространенным поражением печени, характеризующимся накоплением триглицеридов в гепатоцитах и множественными метаболическими нарушениями в органах и тканях с пониженной чувствительностью к инсулину [67]. У пациентов со стеатозом печени нарушается инсулин-опосредованное ингибирование продукции глюкозы в печени, снижается стимулируемое инсулином усвоение глюкозы в скелетных мышцах и ингибирование липолиза [68]. Накопление жира в печени, возможно, является основной причиной развития печеночной, а впоследствии — периферической (мышечная и жировая ткань) инсулинорезистентности. При изучении взаимоотношений между периферическим метаболизмом глюкозы и стеатозом печени было выявлено, что корреляция между периферической резистентностью к инсулину и содержанием внутрипеченочного жира (ВПЖ) более выражена, чем с подкожным содержанием жира [69]. Stefan N. et al. [70] сообщили, что у метаболически здоровых, но тучных людей, сохраняется чувствительность тканей к инсулину и более низкое содержание ВПЖ. Был сделан вывод о том, что выявлять локальное жировое депо в печени может быть важнее, чем абдоминальное ожирение при определении “метаболически здорового” ожирения. Тем более, что увеличение веса у взрослых часто сопровождается стеатозом печени [71]. В другой работе было замечено, что у тучных подростков со стеатозом печени тяжесть инсулинорезистентности была выше по сравнению с подростками с нормальным содержанием ВПЖ [72]. В то же время при липодистрофии имеет место крайняя степень инсулинорезистентности, на фоне значительного накопления жира в печени [73].
Жировое депо яичников (ожирение яичников). Следует подчеркнуть, что такой термин дословно нам не встретился, но, пожалуй, он имеет право на существование. Ведь примерно у 50—70% всех женщин с Синдромом поликистозных яичников (СПКЯ) встречается та или иная степень инсулинорезистентности [74]. При описании СПКЯ у пациенток с ожирением подчеркивается наличие классических признаков гиперактивности висцеральной жировой ткани: снижение уровня сывороточного адипонектина, увеличение степени резистентности к инсулину и гиперинсулинемия
- , а также увеличение уровня лептина и грелина
- . Можно предположить, что локальное депо висцерального жира вокруг яичников у женщин с ожирением, имеет важное значение в патогенезе СПКЯ.
Заключение
Итак, на сегодняшний день MC по-прежнему далек от того, чтобы стать диагнозом. Мы используем ОТ как основной критерий висцерального ожирения, тогда как он таковым не является, а является интегральным показателем подкожного и висцерального ожирения в этой области.
Очевидно, использование более точного, но доступного в клинической практике маркера висцерального ожирения, например, толщины эпикардиального жира, могло бы выделить больных с метаболическими нарушениями, вызванными едиными патогенетическими механизмами: инсулинорезистентностью, системным воспалением, эндотелиальной дисфункцией , развившимися в условиях гипер активно сти адипокинов, цитокинов и других нейрогуморальных факторов висцеральной жировой ткани.
Поскольку наличие висцерального ожирения является специфическим и верифицирующим признаком MC, нам представляется, что пример диагноза, которым можно было бы заменить MC, мог бы звучать так:
Висиеоальное ожирение: АГ. дислипидемия. НТГ
Возможно, было бы правомочно деление больных на формы, в зависимости от наличия общего ожирения по ИМТ, например:
Висиеоальное ожирение тѵчных (ВОТ)
Висиеоальное ожирение хѵдых (BOX)
Кроме того в разделе “Локальные жировые депо” мы постарались подчеркнуть, что такие проявления MC как жировой гепатоз, СПКЯ и ряд других факторов риска могут быть частным проявлением локального висцерального ожирения, при котором имеют место как системные нарушения, так и нарушения морфологии и функции соответствующих органов. Поэтому можно продолжить наши рассуждения о пересмотре понятия MC и дополнить предложенный диагноз, который звучал бы, например, так:
Висиеоальное ожиоение тѵчных (ВОТ): АГ. дислипидемия. НТГ. Жиоовой гепатоз. СПКЯ.
Таким образом, синдром кластерного скопления метаболических нарушений у одного больного, возможно, следует дифференцировать и более четко определить и выделить “MC в узком смысле”, что практически соответствует висцеральному ожирению. Это может позволить более адекватно выбирать методы профилактики, диагностики и лечения этой категории больных.
Литература
- Katsiki N, AthyrosVG, Karagiannis A, et al. Metabolic Syndrome and Non-Cardiac Vascular Diseases: an Update from Human Studies. Curr Pharm Des. 2013 [Epub ahead of print].
- Traish AM, Guay A, Feeley R, et al. The Dark Side of Testosterone Deficiency: I. Metabolic Syndrome and Erectile Dysfunction. Journal of Andrology. 2009;30 (1): 10-22.
- Alexander CM, Landsman PB, Teutsch SM. NCEF — defined metabolic syndrome, diabetes mellitus, and prevalens of coronary heart disease among NHANES111 participants age 50 years and older. 2003;52:1210-4.
- Meigs JB, Wilson PW, Nathan DM. Prevalence and Characteristics of the Metabolic Syndrome in the San Antonio Heart and Framingham Offspring Studies. 2003; (52):2160—7.
- Nikitin VP, Kazeka GR, Simonova Gl. Prevalence of metabolic syndrome X in unorganized urban population (epidemiological study). 2001; 9:37-40. Russian (Никитин Ю.П., КазекаГ.Р, Симонова Г И. Распространенность компонентов метаболического синдромах в неорганизованной городской популяции (эпидемиологическое исследование). Кардиология. 2001;9:37-40).
- Hu G, Ciao О, Tuomilehto J. Prevalence of the Metabolic Syndrome and Its Relation to All-Cause and Cardiovascular Mortality in Non diabetic European Men and Women. Arch Intern Med. 2004;164:1066-76.
- Garni AS, Witt BJ, Howard OE. Metabolic syndrome and risk of incident cardiovascular events and death. Asystematic review and meta-analysis of longitudinal studies. J Am Coll Cardiol. 2007;49:403-14.
- Moebus S, Stang A. The metabolic syndrome — a controversial diagnostic concept. 2007;32 (7): 529-40.
- Bastien M, Poirier P, Lemieux I, etal. Overview of epidemiology and contribution of obesity to cardiovascular disease. Prog Cardiovasc Dis. 2014;56 (4):369-81.
- Boban M, Persic V, Jovanovic Z, et al. Obesity dilemma in the global burden of cardiovascular diseases. Int J Clin Pract. 2014;68 (2): 173-9.
- Clark AL, Fonarow GO, Horwich ТВ. Obesity and the Obesity Paradox in Heart Failure. Prog Cardiovasc Dis. 2014;56 (4):409-14.
- De Schütter A, Lavie CJ, Milan! RV. The impact of obesity on risk factors and prevalence and prognosis of coronary heart disease-the obesity paradox. Prog Cardiovasc Dis. 2014; 56 (4):401 —8.
- Coutinho T Goel K, Correa De Sä D, et al. Combining body mass index with measures of central obesity in the assessment of mortality in subjects with coronary disease: Role of “normal weight central obesity". J Am Coll Cardiol. 2013;61:553-60.
- Minutello RM, Chou ET Hong MK. Impact of body mass index on in-hospital outcomes following percutaneous coronary intervention (report from the New York State Angioplasty Registry). Am J Cardiol. 2004; 93:1229-32.
- Romero-Corral A, Montori VM, Somers VK. Association of bodyweight with total mortality and with cardiovascular events in coronary artery disease: A systematic review of cohort studies. 2006;368:666-78.
- Schols AMWJ, Broekhuizen R, Weling-Scheepers CA, et al. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clin Nutr. 2005;82 (1):53-9.
- Camethon MR, De Chavez PJD, Biggs ML, etal. Association of weight status with mortality in adults with incident diabetes. 2012;308 (6):581 -90.
- Angeräs O, Albertsson R Karason K, et al. Evidence for obesity paradox in patients with acute coronary syndromes: a report from the Swedish Coronary Angiography and Angioplasty Registry. Eur Heart J. 2013;34 (5): 345-53.
- Lavie CJ, Milan! RV, Ventura HO. Obesity and cardiovascular disease: risk factor, paradox, and impact of weight loss. J Am Coll Cardiol. 2009;53 (21): 1925-32.
- Dalamaga M. Obesity, insulin resistance, adipocytokines and breast cancer: New biomarkers and attractive therapeutic targets. World J Exp Med. 2013;3 (3):34-42.
- McAuley PA, Blair SN. Obesity paradoxes. J Sports Sei. 2011 ;29 (8):773-82.
- Surya M, Artham MD, Lavie CJ. Obesity and Hypertension, Heart Failure, and Coronary Heart Disease-Risk Factor, Paradox, and Recommendations for Weight Loss. Ochsner J. 2009; 9(3): 124-32.
- Lainscak M, Haehling S, Doehner W, et al. The obesity paradox in chronic disease: facts and numbers. Journal of Cachexia, Sarcopeniaand Muscle. 2012;3(1):1-4.
- De Schütter A, Lavie CJ, Patel DA, et al. Obesity paradox and the heart: which indicator of obesity best describes this complex relationship? Curr Opin Clin Nutr Metab Care. 2013; 16 (5):517-24.
- Roytberg GE, Dorosh ZhV, Ku rush kina OV. Metabolic syndrome and fat distribution: common ground and contradictory relationship. Preventive Medicine. 2010, 13 (1):22-25 Russian (Ройтберг ГЕ, Дорош ЖВ, Курушкина OB) Метаболический синдром и распределение жировой ткани: точки соприкосновения и противоречивость взаимоотношений. Профилактическая медицина. 2010; 13 (1 ):22—250.
- Schnabel R, Messow CM, Lubos Е. Association of adiponectin with adverse outcome in coronary artery disease patients: results from the AtheroGene study. 2009;302:345-56.
- Kvitkova LV, Borodkina DA, Gruzdeva OV. Metabolic signs of abdominal obesity in patients with acute myocardial infarction with normal and elevated body mass. Problems of Endocrinology. 2012; 4:27-31 Russian (КвитковаЛ.В., Бородкина Д.A., Груздева О. В. Метаболические признаки абдоминального ожирения у больных острым инфарктом миокарда с нормальной и повышенной массой тела. Проблемы эндокринологии. 2012;4:27-31).
- Pouliot MC, Despers JR Lemieux S. Waist circumference and abdominal sagittal diameter: best simple anthropometric indexes of abdominal visceral adipose tissue accumulation and related cardiovascular risk in men and women. Am J Cardiol. 1994;73 (7): 460-8.
- Wang X Rimm EB, Stampfer MJ, et al. Comparison of abdominal adiposity and overall obesity in predicting risk of type 2 diabetes among men. Am J Clin Nutr. 2005;81 (3): 555-63.
- 4isuf S, Hawken S, Ounpuu S, et al. INTERHEART Study Investigators. Obesity and the risk of myocardial infarction in 27,000 participants from 52 countries: a case-control study. 2005;366:1640-9.
- Hu G, Tuomilehto J, Silventoinen K, etal. Joint effects of physical activity, body mass index, waist circumference and waist-to-hip ratio with the risk of cardiovascular disease among middle-aged Finnish men and women. Eur Heart J. 2004;24:2212-9.
- Lofgren I, Herron K, Zern T, et al. Waist circumference is a better predictor than body mass index of coronary heart disease risk in overweight premenopausal women. J Nutr. 2004;134:1071-6.
- 2013 ESH/ESC guidelines for the management of arterial hypertension the task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) Russ J Cardiol. 2014, 1 (105):5—95
- Klein S, Allison DB, Heymsfield SB, et al. Waist circumference and cardiometabolic risk: a consensus statement from Shaping America’s Health: Association for Weight Management and Obesity Prevention; NAASO, The Obesity Society; the American Society for Nutrition; and the American Diabetes Association. Am J Clin Nutr. 2007;85 (5):1197-202.
- National Institutes of Health (NIH). Clinical Guidelines on the Identification, Evaluation and Treatment of Overweight and Obesity in Adults: The Evidence Report. Washington D.C: Government Printing Office. 1998.
- Boden G, Shulman Gl. Free acids in obesity and type 2 diabetes: defining their role in the development of insulin resistance andb-cell dysfunction. Eur J Clin Invest. 2002;32:14-23.
- Franssen R, Monajemi H, Stroes ES. Obesity and dyslipidemia. Med Clin North Am. 2011 ;95 (5.):893-902.
- Juge-Aubry CE, Henrichot CE, Meier CA. Adipose tissue: a regulator of inflammation. Best Pract Res Clin Endocrinol Metab. 2005; 19 (4):547-66.
- Oliveros E, Somers VK, Sochor O, et al. The Concept of Normal Weight Obesity. Progress in Cardiovascular Diseases. 2014;56 (4):426-33.
- Succurro E, Marini MA, Fronton! S, et al. Insulin secretion in metabolically obese, but normal weight, and in metabolically healthy but obese individuals. Obesity (Silver Spring). 2008;16:1881-6.
- Kramer CK, Zinman B, Retnakaran R. Are metabolically healthy overweight and obesity benign conditions?: A systematic review and meta-analysis. Ann Intern Med. 2013; 159 (11 ):758—69.
- Roberson LL, Aneni EC, MaziakW, et al. Beyond BMI: The “Metabolically healthy obese" phenotype; its association with clinical/subclinical cardiovascular disease and all-cause mortality — a systematic review. BMC Public Health. 2014;8; 14 (1): 14.
- Vliet-Ostaptchouk JV, Nuotio ML, Slagter SN, et al. The prevalence of metabolic syndrome and metabolically healthy obesity in Europe: a collaborative analysis of ten large cohort studies. BMC Endocr Disord. 2014; 14 (1 ):9.
- Marques-Vidal R Pecoud A, Hayoz D, et al. Normal weight obesity: relationship with lipids, glycaemic status, liver enzymes and inflammation. Nutr Metab Cardiovasc Dis. 2010;20:669-675.
- Karel is AD, St-Pierre DH, Conus F, et al. Metabolic and body composition factors in subgroups of obesity: what do we know? J Clin Endocrinol Metab. 2004;89:2569-75.
- Romero-Corral A, Somers VK, Sierra-Johnson J, et al. Normal weight obesity: a risk factor for cardiometabolic dysregulation and cardiovascular mortality. Eur Heart J. 2010;31:737-46.
- Madeira FB, Silva AA, Veloso HF, et al. Normal weight obesity is associated with metabolic syndrome and insulin resistance in young adults from a middle-income country. PLoS One. 2013:8: e60673.
- The Examination Committee of Criteria for ‘Obesity Disease’ in Japan: New criteria for obesity disease’ in Japan. Circulation J. 2002;66:987-92.
- Alberti KG, Eckel RG, Grundy SM, et al. Harmonizing the Metabolic Syndrome- A Joint Interim Statement of the International Diabetes. Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. 2009;120:1640-5.
- MatsuzawaY Funahashi T Nakamura T. The Concept of Metabolic Syndrome: Contribution of Visceral Fat Accumulation and Its Molecular Mechanism. Journal of Atherosclerosis and Thrombosis. 2011 ;18 (8):629-39.
- Okauchi X Nishizawa H, Funahashi T, et al. Reduction of visceral fat is associated with decrease in the number of metabolic risk factors in Japanese men. Diabetes Care. 2007;30:2392-4.
- Despres JR Intra-abdominal obesity: an untreated risk factor for Type 2 diabetes and cardiovascular disease. J Endocrinol Invest. 2006;29 (3)77-82.
- Belyaeva OD, Man dal V, Ananeva N1. The thickness of the intima-media of the carotid arteries as an early marker of atherosclerosis in patients with abdominal obesity. 2008,14 (1)71-6. Russia (Беляева ОД, Мандал В, Ананьева НИ. Толщина комплекса интима-медиа сонных артерий как ранний маркер атеросклероза у пациентов с абдоминальным ожирением. Артериальная гипертензия. 2008; 14 (1)71-6).
- Sokolov El, Pisarevskaya AL. Visceral obesity as a pathogenetic factor in coronary heart disease. 2007; 1:11-5 Russia (Соколов ЕИ, Писаревская АЛ. Висцеральное ожирение как патогенетический фактор ишемической болезни сердца. Кардиология. 2007;1:11-5).
- Hall JE. Mechanisms of abnormal renal sodium handling in obesity hypertension. Am J Hypertens. 1997; 10:49-55.
- Goodpaster BH, Theriault R, Watkins SC. Intramuscular lipid content is increased in obesity and decreased by weight loss. 2000;49:467-72.
- Verlohren S, Dubrovska G, Tsang SY Visceral periadventitial adipose tissue regulates arterial tone of mesenteric arteries. 2004;44:271-6.
- Wildman RP, Earhat GN, Patel AS. Weight change is associated with change in arterial stiffness among healthy young adults. 2005;45:187-92.
- Gao YJ, Takemori K, Su LY Perivascular adipose tissue promotes vasoconstriction: the role of superoxide anion. Cardiovasc Res. 2006;71:363-73.
- Wheeler G.L., Shi R., Beck S.R. Pericardial and visceral adipose tissue measured volumetrically with computed tomography are highly associated in type 2 diabetic families. Invest Radiol. 2005;40:97-101.
- lacobellis G., Barbaro G. The double role of epicardial adipose tissue as pro- and antiinflammatory organ. Horm Metab Res. 2008;40 (7):442-5.
- Mazurek T, Zhang L, Zalewski A. Human epicardial adipose tissue is a source of inflammatory mediators. 2003; 108 (20):2460-6.
- lacobellis G., Bianco A. C. Epicardial adipose tissue: emerging physiological, pathophysiological and clinical features. Trends Endocrinol Metab. 2011;22:450-7.
- Veselovskaya NG, Chumakova GA, Elykomov VA, et al. Risk factors for restenosis after coronary stenting in patients with obesity. Cardiovascular Therapy and Prevention. 2013; 3:4-9. Russia (Веселовская НГ, Чумакова ГА, Елыкомов ВА, и др. Факторы риска рестеноза после коронарного стентирования у пациентов с ожирением. Кардиоваскулярная терапия и профилактика. 2013;3:4-9).
- Chumakova GA, Veselovskaya NG, Gritsenko OV, et al. Epicardial obesity as a risk factor for coronary atherosclerosis. Cardiology. 2013; 1:51-5. Russia (Чумакова Г.A., Веселовская Н.Г., Гриценко О.В., и др. Эпикардиальное ожирение как фактор риска коронарного атеросклероза. Кардиология. 2013;1:51-5).
- Veselovskaya NG, Chumakova GA, Ott AV, et al. Non invasive marker of insulin resistance in obese patients. Russian Journal of Cardiology. 2013; 6:28-32. Russian (Веселовская НГ, Чумакова ГА, Отт АВ. Неинвазивный маркер инсулинорезистентности у пациентов с ожирением. Российский кардиологический журнал. 2013;6:28-32).
- Perseghin G. Viewpoints on the way to a consensus session: where does insulin resistance start? The liver. Diabetes Care. 2009;32 (2): 164-7.
- Marches!ni G., Brizi M., Bianchi G., et al. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. 2001;50:1844-50.
- Sattar N, Scherbakova O, Ford I, et al. Elevated alanine aminotransferase predicts new-onset type 2 diabetes independently of classical risk factors, metabolic syndrome, and C-reactive protein in the West of Scotland Coronary Prevention Study. 2004;53:2855-60.
- Stefan N, KantartzisK, Machann J, etal. Identification and characterization of metabolically benign obesity in humans. Arch Intern Med. 2008;68:1609-16.
- Zhang WJ, Chen LL, Zheng J, et al. Association of adult weight gain and nonalcoholic fatty liver in a cross-sectional study in Wan Song Community, China.Braz J Med Biol Res. 2014;47 (2): 151 —6.
- Perseghin G., BonfantiR., Magni S., et al. Insulin resistance and whole body energy homeostasis in obese adolescents with fatty liver disease. Am J Physiol Endocrinol Metab. 2006;291:697-703.
- Petersen K.F., Arioglu OralE., Dufour S., et al. Leptin reverses insulin resistance and hepatic steatosis in patients with severe lipodystrophy. J Clin Invest. 2002;109:1345-50.
- Guzel E C., CelikC., AbaliR., et al. Omentin and chemerin and their association with obesity in women with polycystic ovary syndrome. Gynecol Endocrinol. 2014 [Epub ahead of print].
- YildizY, Ozaksit G., Serdar Unlu B., et al. Serum adiponectin level and clinical, metabolic, and hormonal markers in patients with polycystic ovary syndrome. Int J Fertil Steril. 2014;7 (4):331-6.
- , Broujeni P.T., Samani E.N. Leptin, ghrelin, adiponectin, homocysteine and insulin resistance related to polycystic ovary syndrome. Int J Fertil Steril. 2008;2 (3): 101 —4.





