Мифы и реальность терапии статинами: ответы на самые актуальные вопросы


Опубликована Март 1, 2022
Последнее обновление статьи Сен. 1, 2022
Аннотация
На сегодняшний день во всем мире сердечно-сосудистые заболевания (ССЗ) занимают лидирующую позицию среди причин смертности и инвалидизации населения. По данным ВОЗ, в 2019 г. смертность от ССЗ достигла 17,9 млн человек, что составляет 32% от всех случаев смерти в мире. Согласно зарубежным и отечественным рекомендациям статины занимают центральное место в медикаментозной терапии пациентов с высоким риском развития, а также уже установленными диагнозами атеросклеротических ССЗ. Статины обладают большим количеством положительных эффектов, однако приверженность пациентов липидснижающей терапии как в России, так в других странах остается низкой. Препараты данной группы подвергаются безосновательной критике не только со стороны средств массовой информации, но даже некоторых врачей. При этом аргументами противников статинотерапии являются вероятные побочные эффекты. Поскольку эффективность и безопасность применения данной группы препаратов не вызывают сомнений, а информация о побочных эффектах в большинстве случаев не соответствует действительности, нами в настоящем обзоре представлен научный анализ эффективности и безопасности гиполипидемической терапии, в частности оригинального представителя данного класса — аторвастатина.
Ключевые слова
Статин-ассоциированные мышечные симптомы, статины, гиперлипидемия, сердечно-сосудистые заболевания, конгнитивные нарушения, безопасность.
Введение
Сердечно-сосудистые заболевания (ССЗ) — ведущая причина заболеваемости и смертности во всем мире. По данным ВОЗ, в 2019 г. смертность от ССЗ достигла 17,9 млн человек, что составляет 32% от всех случаев смерти в мире [1]. Гиперлипидемия является распространенным нарушением обмена веществ и одним из основных факторов риска развития ССЗ. Cтатины — ингибиторы β-гидрокси-β-метилглутарил-коэнзимА-редуктазы (ГМГ-КоА-редуктазы) — относятся к классу гиполипидемических препаратов и являются препаратами первого выбора для снижения уровня холестерина липопротеинов низкой плотности (ХС ЛНП) в плазме и, таким образом, снижения риска ССЗ [2, 3].
Важнейшие клинические исследования [4, 5] продемонстрировали эффективность статинов как для первичной, так и для вторичной профилактики ишемической болезни сердца (ИБС). Безопасность применения статинов, в частности оригинального аторвастатина, неоднократно описывалась в медицинской литературе.
Однако приверженность пациентов систематическому длительному приему данной группы препаратов остается низкой. Причины этого можно разделить на две категории. Первая — сомнения в том, что уровень проатерогенных липидов вообще требуется снижать, хотя прямая взаимосвязь повышения концентрации ХС ЛНП с увеличением заболеваемости и смертности от ССЗ доказана в многочисленных клинических исследованиях и крупнейших метаанализах. Вторая — ложная информация о побочных эффектах, среди которых чаще всего называют повреждение печени, мышечной и нервной систем, поражение органов зрения, эректильную дисфункцию в связи с нарушением функции тестостерона, сахарный диабет (СД) и невозможность «прекратить прием статинов, если он начат». Эти опасения можно разделить на реальные (клинически незначимое повышение уровня трансаминаз, некоторое увеличение риска развития СД у больных с предиабетом, миалгии) и абсолютно неоправданные (нарушение функции печени и ее повреждение, когнитивные нарушения, влияние на синтез тестостерона и эректильную функцию).
Статин-ассоциированные мышечные симптомы
Данная группа препаратов действительно в редких случаях может вызывать побочные эффекты, наиболее вероятными из которых являются статин-ассоциированные мышечные симптомы (САМС). САМС представляют собой мышечную боль и/или слабость, возникающую, как правило, в течение 4–6 нед. после начала приема статинов, увеличения дозы или начала терапии препаратами других групп, имеющих лекарственное взаимодействие через одинаковые цитохромы. Данные симптомы обычно возникают в симметричных проксимальных группах мышц (чаще — крупных (бедра, ягодицы, икроножные мышцы, мышцы спины)). При этом креатинфосфокиназа (КФК) необязательно может быть повышена, она может оставаться в пределах нормальных значений. САМС, как правило, проходят самостоятельно через несколько недель после отмены статинов (или уменьшения дозы) и возникают повторно при возобновлении их приема [6].
Однако частота встречаемости данных симптомов является предметом дискуссий и многочисленных метаанализов [7–9]. Главный вопрос исследователей: не являются ли эти эффекты эффектами ноцебо? Эффект ноцебо — это негативный результат, ассоциированный с ожиданием побочного действия при лечении медикаментами, основанный на сведениях, полученных от врачей или из средств массовой информации. Именно этим эффектом обусловлено большинство жалоб пациентов, принимающих статины и опасающихся развития САМС.
В исследовании ASCOT-LLA (The Anglo-Scandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm) [10] продемонстрирована более высокая частота САМС у пациентов, принимающих статины, в слепой фазе, чем в фазах, когда испытуемым было известно, принимают они статин или плацебо (2,03% против 1,26% соответственно).
Согласно имеющимся данным [9] САМС чаще возникают у пожилых пациентов (старше 80 лет), женщин и лиц с низким индексом массы тела, представителей азиатской расы, пациентов с повышением уровня КФК в анамнезе или необъяснимыми мышечно-суставными симптомами, воспалительными или метаболическими мышечными заболеваниями (в том числе и генетическими), а также из-за примеров развития САМС у других больных. Кроме того, САМС чаще возникают у спортсменов и лиц с чрезмерной физической активностью, избыточно употребляющих грейпфрутовый сок или имеющих алкогольную или наркотическую зависимость. Развитию САМС чаще подвержены пациенты с острыми инфекционными заболеваниями, печеночной или почечной дисфункцией, СД, синдромом приобретенного иммунного дефицита или носительством вируса иммунодефицита человека, с дефицитом витамина D, обструкцией желчевыводящих путей, а также перенесшие трансплантацию органов, тяжелые травмы, операции.
Таким образом, осведомленность больных о побочном действии статинов требует от врача более детального разъяснения при назначении препарата, чтобы исключить эффект ноцебо.
Поражение печени
Еще одно необоснованное опасение пациентов, принимающих статины, относится к их влиянию на функцию печени. Печень как депо синтеза холестерина является местом действия статинов. Умеренное повышение уровня печеночных трансаминаз (следует разделять повышение уровня трансаминаз вследствие попадания их в кровоток из разрушенных клеток скелетной мускулатуры и повышение трансаминаз из-за разрушения клеток печени — печеночных трансаминаз) наблюдается у 0,5–2,0% пациентов обычно в течение 3 мес. после начала терапии статинами. Однако данное повышение, согласно клиническим исследованиям, существенно не отличается от показателя в группе плацебо [11].
Метаанализ [12] 135 клинических исследований, включающий более 246 000 пациентов, показал, что статины увеличивают риск повышения уровня трансаминаз на 50% по сравнению с контролем или плацебо. Четкая зависимость между дозой и повышением наблюдалась при применении всех статинов. Однако повышение было временным и обычно уровень трансаминаз возвращался к норме при продолжении терапии. Клинически значимое повышение печеночных трансаминаз встречалось существенно реже. Так, анализ 49 исследований [13] с участием более 14 000 пациентов показал трехкратное повышение уровня печеночных трансаминаз по сравнению с нормой у 0,1, 0,6 и 0,2% пациентов, получавших аторвастатин в дозе 10 мг, аторвастатин в дозе 80 мг и плацебо соответственно. С учетом соотношения польза/риск при применении статинов преимущества (снижение ХС ЛНП и, соответственно, снижение риска развития сердечно-сосудистых осложнений) являются очевидными.
Таким образом, повреждение печени, связанное с приемом статинов, встречается достаточно редко. Исследования [14–17] побочных эффектов, связанных с лекарственными средствами, показали, что статины могут быть причиной 1–3% всех случаев заболеваний печени. Национальными ассоциациями кардиологов и липидологов России и мира сделан вывод о том, что зарегистрированная гепатотоксичность, обусловленная статинотерапией, остается очень редким явлением.
Поражение глаз
Катаракта — основная причина потери зрения у пожилых людей. Вопрос о том, усугубляет ли применение статинов этот риск, остается острым. Однако получить ответ на данный вопрос мешают методологические проблемы, такие как отсутствие стандартизированного определения катаракты, а также невозможность анализа роли приверженности пациентов статинотерапии и регулярным офтальмологическим осмотрам. Анализ результатов [18] имеющихся исследований демонстрирует возможную слабую связь между катарактой и применением статинов.
По данным анализа исследования HOPE-3 (Heart Outcomes Prevention Evaluation-3) [19], у лиц, принимавших розувастатин в дозе 10 мг/сут, было статистически значимо большее количество операций по удалению катаракты, чем в группе плацебо. Однако метаанализ [20] 313 200 пациентов когортных исследований (n=6, продолжительность наблюдения до 5 лет), исследований случай — контроль (n=6, продолжительность наблюдения до 5 лет) и рандомизированных контролируемых испытаний (n=5, продолжительность наблюдения 0,9–5,4 года) не показал никакой связи между применением статинов и развитием катаракты. Кроме того, в ряде
работ [21, 22] высказывается предположение, что антиоксидантные и противовоспалительные эффекты статинов могут даже замедлять развитие катаракты. Безусловно, необходимы дальнейшие исследования для ответа на данный вопрос.
Развитие СД
Терапия статинами связана с незначительным повышением уровня глюкозы в крови натощак. В метаанализе [23] 13 клинических исследований с участием 91 140 пациентов без диабета показано, что на начальном этапе лечение статинами увеличило частоту развития СД на 9%, что составило 1 дополнительный случай СД (12,23 случая со статинами против 11,25 случая с контролем) на 1000 пациентов в год. Но при этом терапия статинами предотвращала развитие 5 случаев осложнений ССЗ.
Другой метаанализ [24] 5 клинических исследований, включающий 40 000 пациентов со стабильной ИБС или недавним острым коронарным синдромом, показал, что высокоинтенсивная терапия статинами увеличивает риск возникновения СД на 12%, но также снижает риск сердечно-сосудистых событий на 16%, или, в абсолютном выражении, предотвращает 3,5 сердечно-сосудистого события на каждый дополнительный случай диабета. В этом анализе «случай диабета» был определен по уровню гликированного гемоглобина в сыворотке крови (HbA1c) >6,5%, который не оказывает непосредственного влияния на качество жизни, и поэтому его не следует сравнивать с такими исходами, как инсульт или смерть от инфаркта миокарда.
Интересны результаты наблюдательного исследования [25], включавшего 2798 человек, не имеющих СД (подтвержденного тестом толерантности к глюкозе на момент включения). Пациенты были разделены на 2 группы: первой группе пациентов инициирована терапия статинами, вторая — находилась на терапии плацебо. С группой пациентов, находящихся на терапии статинами, дополнительно проводилось консультирование по модификации образа жизни (питание, физическая активность). По данным исследования, у 7,5% пациентов первой группы на терапии статинами во время наблюдения развился СД 2 типа по сравнению с 6,5% пациентов второй группы, не принимавших статины. Уровень глюкозы натощак увеличился на 0,08 ммоль/л у лиц, принимавших статины, но остался неизменным у не принимавших их.
Таким образом, терапия статинами увеличивает уровень глюкозы крови. Однако данное незначительное повышение уровня глюкозы плазмы натощак не означает повышение риска развития СД. Кроме того, изменение образа жизни способно нивелировать это повышение. При этом риск развития СД увеличивается только у пациентов с предиабетом, которые получают высокоинтенсивную статинотерапию. При использовании статинов в первичной профилактике риск развития СД не возрастает [26]. Результаты исследования [27] показывают, что у пациентов с развившимся СД во время приема статинов была более низкая частота не только макрососудистых заболеваний, но и осложнений микрососудистых заболеваний, обычно связанных с СД.
Поражение нервной системы
Ранее высказывалась гипотеза о том, что препараты, снижающие уровень холестерина, могут влиять на нервную систему, в частности приближать начало и вызывать прогрессирование болезни Альцгеймера. Аргумент — возможное повреждение миелиновых нервных оболочек. Развитие данного заболевания оценивалось в исследовании [28], включавшем 399 979 пациентов от 65 лет и старше различных рас и этнической принадлежности, получавших статинотерапию в период с 2006 по 2008 г. Анализировалось применение как гидрофильных, так и липофильных статинов, таких как симвастатин, аторвастатин, правастатин, розувастатин. Отдельно была проанализирована группа пациентов (n=405 490), не принимавших статины. У пациентов, принимавших более высокие дозы статинов, вероятность развития болезни Альцгеймера в последующие 5 лет была на 10% ниже, чем у больных, получавших более низкие дозы статинов. У тех, кто не принимал гиполипидемическую терапию, заболеваемость болезнью Альцгеймера составила 1,99% за тот же период (рис. 1).

Кроме этого, наличие повышенного уровня ХС ЛНП связано с более высокой вероятностью раннего развития болезни Альцгеймера. T.S. Wingo et al. [29] проанализировали 2125 образцов, полученных у 1276 (60,0%) женщин и 654 (30,8%) мужчин с ранним развитием болезни Альцгеймера (средний возраст 55,6 года для раннего развития болезни Альцгеймера и 72,0 года для контроля), прошедших генетическое секвенирование. После поправки на мутации по аполипопротеину Е (ApoE) мутации E4, в группе больных с ранним развитием болезни Альцгеймера наблюдался более высокий уровень общего ХС (средняя разница 0,6 ммоль/л; p = 2,9 × 10–5), ХС ЛНП (средняя разница 0,6 ммоль/л; p = 1,8 × 10–6) и ApoB (средняя разница 12,0 мг/дл; p = 2,0 × 10–6) по сравнению с группой контроля. Эти данные подчеркивают важную роль ХС ЛНП в патогенезе раннего развития болезни Альцгеймера и предполагают прямую связь вариантов AроB с риском развития данного заболевания.
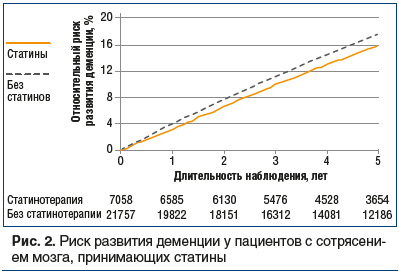
Влияние применения статинов на развитие деменции оценивалось в канадском многоцентровом популяционном двойном когортном исследовании [30] с участием 28 815 больных после сотрясения мозга (средний возраст 76 лет; 61,3% женщин). Из включенных пациентов 7058 (24,5%) получали статины, 21 757 (75,5%) больных не принимали гиполипидемическую терапию. Общий период наблюдения составил 5 лет. В общей сложности у 4727 пациентов впоследствии (период наблюдения 3,9 года) развилась деменция, т. е. отмечен 1 случай заболевания на 6 пациентов (рис. 2). У пациентов, получавших статины, риск развития деменции был на 13% ниже, чем у пациентов, не получавших статины (относительный риск 0,87, 95% доверительный интервал (ДИ) 0,81–0,93; p<0,001).
В исследовании OSLER [30] была проведена оценка риска развития нейрокогнитивных событий (делирий, когнитивные расстройства, нарушение внимания, деменция, нарушения мышления и восприятия, а также психические расстройства) у 4465 пациентов, получавших монотерапию статинами и комбинированную гиполипидемическую терапию статинами и ингибиторами пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9). Частота развития нейрокогнитивных нежелательных явлений была низкой в обеих группах (<1%), однако о таких явлениях чаще сообщалось в группе получающих комбинированную терапию (0,9% против 0,3%). Тем не менее риск нейрокогнитивных событий существенно не различался в зависимости от достигнутого уровня ХС ЛНП. В исследовании EBBINGHAUS [31], оценивавшем развитие когнитивных нарушений на фоне монотерапии статинами и комбинированной гиполипидемической терапии статинами и ингибиторами PCSK9, также не было выявлено существенных различий между группами в когнитивных функциях в среднем на протяжении 19 мес. При предварительном анализе не было обнаружено связи между уровнями ХС ЛНП и когнитивными изменениями.
В многоцентровом проспективном когортном исследовании [32], включавшем 96 043 участника (средний возраст 51,3 года), была изучена связь между уровнем ХС ЛНП и риском внутримозгового кровоизлияния. Диагноз «геморрагический инсульт» был выставлен на основании анализа медицинских карт. На момент включения пациенты не имели в анамнезе инсульта, инфаркта миокарда и злокачественного образования. Уровень ХС ЛНП был измерен 5 раз с интервалом в 3 года. За 9 лет наблюдения было выявлено 753 случая внутримозгового кровоизлияния. Риск развития внутримозгового кровоизлияния был одинаковым среди пациентов с уровнем ХС ЛНП от 1,8 до 2,5 ммоль/л и у больных с ХС ЛНП ≥2,6 ммоль/л. Напротив, пациенты с уровнем ХС ЛНП <1,8 ммоль/л имели более высокий риск развития внутримозгового кровоизлияния, чем больные с концентрациями ХС ЛНП от 1,8 до 2,5 ммоль/л (ОР 1,65, 95% ДИ 1,32–2,05 — для ХС ЛНП от 1,3 до 1,8 ммоль/л и ОР 2,69, 95% ДИ 2,03–3,57 — для ХС ЛНП <1,3 ммоль/л). Таким образом, была продемонстрирована взаимосвязь между врожденно низким уровнем ХС ЛНП и риском развития геморрагического инсульта. Однако при поправке на гиполипидемическую терапию не было продемонстрировано взаимодействия между низким уровнем ХС ЛНП вследствие гиполипидемической терапии и риском развития геморрагических осложнений со стороны центральной нервной системы. Следует учесть тот факт, что геморрагический инсульт составляет 15–20% от всех инсультов, а количество ишемических инсультов при низком ХС ЛНП снижается. Так, в исследовании SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels) [33] агрессивная терапия оригинальным аторвастатином (Липримар®) в дозе 80 мг снижала риск развития инсульта на 16% у пациентов, недавно перенесших инсульт или транзиторную ишемическую атаку, по сравнению с группой плацебо (14,1% против 17,2%, р=0,002).
Эректильная дисфункция
Развитие эректильной дисфункции на фоне приема статинов также является мифом. Статины улучшают функцию эндотелия за счет плейотропных эффектов, повышая доступность оксида азота, снижая окислительный стресс и оказывая антиоксидантное действие. По данным метаанализа [34] 11 рандомизированных исследований, прием статинов ассоциировался с улучшением международного индекса эректильной функции на 3,4 балла (95% ДИ, 1,7–5,0; p=0,0001) по сравнению с группой контроля. По данным исследования HOPE-3 [35], включавшего 2153 пациента (средний возраст 61,5 года), с периодом наблюдения 5,8 года применение розувастатина не влияло на эректильную функцию у мужчин.
Заключение
Таким образом, статины являются безопасными препаратами среди использующихся для лечения ССЗ атеросклеротического генеза. Польза от их применения в отношении снижения риска осложнений, прогрессирования заболевания и сердечно-сосудистой и общей смертности не подлежит сомнению. Немногочисленные побочные эффекты, как правило, не являются клинически значимыми и обратимы при изменении дозы статина или переходе на другой препарат данного класса. В отношении настороженности пациентов к статинотерапии прослеживается определенная хронологическая закономерность. Если ранее мы сталкивались с вопросами об онкогенности статинотерапии и «разрушении» печени, то в последующем появилось обвинение статинов в когнитивных нарушениях, а в настоящее время — в нарушении синтеза тестостерона. Однако статины достоверно улучшают когнитивную функцию и предупреждают раннее развитие болезни Альцгеймера. Кроме того, в плане влияния статинов на неврологические функции необходимо подчеркнуть взаимосвязь учащения случаев геморрагического инсульта с врожденно низким уровнем холестерина и ХС ЛНП, но не с гиполипидемической терапией.
Несомненно, что при назначении гиполипидемической терапии, как и любой другой, необходимо знать о возможных побочных эффектах и контролировать их, однако это не должно оказывать влияние на назначение и интенсивность статинотерапии.
Благодарность
Автор и редакция благодарят компанию «Виатрис» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
Литература
2. Mach F., Baigent C., Catapano A.L. et al. ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;1(41):111–188. DOI: 10.1093/eurheartj/ehz455.
3. Taylor F., Huffman M.D., Macedo A.F. et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2013;2013(1):CD004816. DOI: 10.1002/14651858.CD004816.pub5.
4. Гуревич В.С., Ежов М.В., Cергиенко И.В. и др. Предпосылки и преимущества комбинированной терапии розувастатином и фенофибратом. Атеросклероз и дислипидемии. 2021;3(44):26–37. [Gurevich V.S., Ezhov M.V., Sergienko I.V. Background and benefits of combination therapy with rosuvastatin and fenofibrate. Atherosclerosis and dyslipidemia. 2021;3(44):26–37 (in Russ.)]. DOI: 10.34687/2219-8202.JAD.2021.03.0003.
5. Сергиенко И.В., Прус Ю.А. Статины — длительность приема и снижение сердечно-сосудистого риска. РМЖ. 2021;1:25–28. [Sergienko I.V., Prus Yu.A. Statins — duration of use and reduction in cardiovascular risk. Russian Medical Journal. 2021;1:25–28 (in Russ.)].
6. Stock J. Statin-associated muscle symptoms EAS Consensus Panel paper focuses on this neglected patient group. Atherosclerosis. 2015;242(1):346–350. DOI: 10.1016/j.atherosclerosis.2015.06.049.
7. Stroes E.S., Thompson P.D., Corsini A. et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. European Atherosclerosis Society Consensus Panel. Eur Heart J. 2015;36(17):1012–1022. DOI: 10.1093/eurheartj/suz007.
8. Matthews A., Herrett E., Gasparrini A. et al. Impact of statin related media coverage on use of statins: interrupted time series analysis with UK primary care data. BMJ. 2016;353:i3283. DOI: https://doi.org/10.1136/bmj.i3283.
9. Tobert J.A., Newman C.B. The nocebo effect in the context of statin intolerance. J Clin Lipidol. 2016;10(4):739–747. DOI: 10.1016/j.jacl.2016.05.002.
10. Gupta A., Thompson D., Whitehouse A. et al. Adverse events associated with unblinded, but not with blinded, statin therapy in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm (ASCOT-LLA): a randomised double-blind placebo-controlled trial and its non-randomised non-blind extension phase. Lancet. 2017;389(10088):2473–2481. DOI: 10.1016/S0140-6736(17)31075-9.
11. Tolman K.G. The liver and lovastatin. Am J Cardiol. 2002;89(12):1374–1380. DOI: 10.1016/s0002-9149(02)02355-x.
12. Naci H., Brugts J., Ades T. Comparative tolerability and harms of individual statins: a study-level network meta-analysis of 246 955 participants from 135 randomized, controlled trials. Circ Cardiovasc Qual Outcomes. 2013;6(4):390–399. DOI: 10.1161/CIRCOUTCOMES.111.000071.
13. Newman C., Tsai J., Szarek M. et al. Comparative safety of atorvastatin 80 mg versus 10 mg derived from analysis of 49 completed trials in 14,236 patients. Am J Cardiol. 2006;97(1):61–67. DOI: 10.1016/j.amjcard.2005.07.108.
14. Bjornsson E., Jacobsen E.I., Kalaitzakis E. Hepatotoxicity associated with statins: reports of idiosyncratic liver injury post-marketing. J Hepatol. 2012;56:374–380. DOI: 10.1016/j.jhep.2011.07.023.
15. Clarke A.T., Johnson P.C., Hall G.C. et al. High dose atorvastatin associated with increased risk of significant hepatotoxicity in comparison to simvastatin in UK GPRD Cohort. PLoS One. 2016;11:e0151587. DOI: 10.1371/journal.pone.0151587.
16. Andrade R.J., Robles M., Ulzurrun E., Lucena M.I. Drug-induced liver injury: insights from genetic studies. Pharmacogenomics. 2009;10(9):1467–1487. DOI: 10.2217/pgs.09.111.
17. Chalasani N., Fontana R.J., Bonkovsky H.L. et al. Drug Induced Liver Injury Network (DILIN). Causes, clinical features, and outcomes from a prospective study of drug-induced liver injury in the United States. Gastroenterology. 2008;135(6):1924–1934, 1934.e1–4. DOI: 10.1053/j.gastro.2008.09.011.
18. Desai C.S., Martin S.S., Blumenthal R.S. Non-cardiovascular effects associated with statins. BMJ. 2014;349:g3743. DOI: 10.1136/bmj.g3743.
19. Yusuf S., Bosch J., Dagenais G. et al. Cholesterol Lowering in Intermediate-Risk Persons without Cardiovascular Disease. N Engl J Med. 2016;374(21):2021–2031. DOI: 10.1056/NEJMoa1600176.
20. Yu S., Chu Y., Li G. et al. Statin Use and the Risk of Cataracts: A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2017;6(3):e004180. DOI: 10.1161/JAHA.116.004180.
21. Kostis J.B., Dobrzynski J.M. Prevention of Cataract by Statins. Am J Cardiol. 2016;117(7):1196. DOI: 10.1016/j.amjcard.2016.01.001.
22. Lim S., Barter P. Antioxidant effects of statins in the management of cardiometabolic disorders. J Atheroscler Thromb. 2014;21(10):997–1010. DOI: 10.5551/jat.24398.
23. Sattar N., Preiss D., Murray H.M. et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet. 2010;375(9716):735–742. DOI: 10.1016/S0140-6736(09)61965-6.
24. Preiss D., Seshasai S.R., Welsh P. et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA. 2011;305(24):2556–2564. DOI: 10.1001/jama.2011.860.
25. Rautio N., Jokelainen J., Oksa H. et al. Do statins interfere with lifestyle intervention in the prevention of diabetes in primary healthcare? One-year follow-up of the FIN-D2D project. BMJ Open. 2012;2(5):e001472. DOI: 10.1136/bmjopen-2012-001472.
26. Cai T., Abel L., Langford O. et al. Associations between statins and adverse events in primary prevention of cardiovascular disease: systematic review with pairwise, network, and dose-response meta-analyses. BMJ. 2021;374:n1537. DOI: https://doi.org/10.1136/bmj.n1537.
27. Nielsen S.F., Nordestgaard B.G. Statin use before diabetes diagnosis and risk of microvascular disease: a nationwide nested matched study. Lancet Diabetes Endocrinol. 2014;2(11):894–900. DOI: 10.1016/S2213-8587(14)70173-1.
28. Zissimopoulos J.M., Barthold D., Brinton R.D., Joyce G. Sex and Race Differences in the Association Between Statin Use and the Incidence of Alzheimer Disease. JAMA Neurol. 2017;74(2):225–232. DOI: 10.1001/jamaneurol.2016.3783.
29. Wingo T.S., Cutler D.J., Wingo A.P. et al. Association of Early-Onset Alzheimer Disease With Elevated Low-Density Lipoprotein Cholesterol Levels and Rare Genetic Coding Variants of APOB. JAMA Neurol. 2019;76(7):809–817. DOI: 10.1001/jamaneurol.2019.0648.
30. Sabatine M.S., Giugliano R.P., Wiviott S.D. et al. Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372(16):1500–1509. DOI: 10.1056/NEJMoa1500858.
31. Giugliano R.P., Mach F., Zavitz K. et al. EBBINGHAUS Investigators. Cognitive Function in a Randomized Trial of Evolocumab. N Engl J Med. 2017;377(7):633–643. DOI: 10.1056/NEJMoa1701131.
32. Ma C., Gurol M.E., Huang Z. et al. Low-density lipoprotein cholesterol and risk of intracerebral hemorrhage: A prospective study. Neurology. 2019;93(5):e445–e457. DOI: 10.1212/WNL.0000000000007853.
33. Amarenco P., Bogousslavsky J., Callahan A. et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med. 2006;355(6):549–559. DOI: 10.1056/NEJMoa061894.
34. Kostis J.B., Dobrzynski J.M. Statins and Erectile Dysfunction. World J Mens Health. 2019;37(1):1–3. DOI: 10.5534/wjmh.180015.
35. Joseph P., Lonn E., Bosch J. et al. Long-term Effects of Statins, Blood Pressure-Lowering, and Both on Erectile Function in Persons at Intermediate Risk for Cardiovascular Disease: A Substudy of the Heart Outcomes Prevention Evaluation-3 (HOPE-3) Randomized Controlled Trial. Can J Cardiol. 2018;34(1):38–44. DOI: 10.1016/j.cjca.2017.09.026.





