Современный взгляд на кардиотоксичность химиотерапии онкологических заболеваний, включающей антрациклиновые антибиотики


Опубликована Март 1, 2017
Последнее обновление статьи Окт. 13, 2022
Аннотация
Высокая эффективность современной химиолучевой терапии позволила добиться больших успехов в лечении онкогематологических заболеваний. Основой многих схем полихимиотерапии первой линии лечения остаются антраци клиновые антибиотики. Эффективное лечение основного заболевания в ряде случаев сопровождается развитием различных осложнений со стороны сердечно-сосудистой системы, в том числе очень тяжелых, с развитием летального исхода. Необходимо учитывать возможность развития не только острой кардиотоксичности, но и различных осложнений со стороны сердечнососудистой системы после завершения противоопухолевого лечения. Алгоритм подготовки пациентов к химиолучевой терапии, должен обязательно включатъ обследование сердечно-сосудистой системы до начала лечения, в дальнейшем необходимо регулярное обследование на протяжении терапии. Профилактика и лечение кардиотоксичности являются сложными клиническими задачами в силу необратимости и прогрессирующего характера большинства изменений со стороны сердечно-сосудистой системы. Важным аспектом является тесное взаимодействие кардиолога и онколога при ведении больных. Необходимо длительное динамическое наблюдения за пациентами, получавшими химиолучевую терапию для максимально ранней диагностики сердечно-сосудистых осложнений в отдаленном периоде после окончания противоопухолевого лечения.
Ключевые слова
Кардиотоксичностъ, антрациклиновая кардиомиопатия, осложнения противоопухолевой терапии, профилактика и лечение кардиотоксичности, хроническая сердечная недостаточность, антрациклиновые антибиотики, последствия химиолучевой терапии
В настоящее время все большее внимание уделяется кардиотоксичности, развивающейся на фоне проведения противоопухолевого лечения. Достижения современной онкологии связаны с применением эффективных комбинаций химиотерапевтических препаратов и лучевой терапии, в то же время некоторые из часто используемых лекарственных препаратов, а также лучевая терапия у части больных привод ят к развитию различных осложнений. С увеличением продолжительности жизни пациентов и сроков наблюдения за ними увеличивается и количество поздних осложнений противоопухолевого лечения. Некоторые онкогематологические заболевания в определенной стадии могут быть полностью излечимы (например, лимфома Ходжкина), при многих других онкологических заболеваниях достигаются длительные ремиссии (например, при раке молочной железы). Возникает ситуация, когда при успешном лечении основного заболевания появляется вероятность развития осложнений этого лечения, в том числе с летальным исходом, как во время его проведения, так и в совершенно различные периоды после его окончания.
В то время как основными “классическими” причинами хронической сердечной недостаточности (ХСН) являются ишемическая болезнь сердца (постинфарктный кардиосклероз, хроническая постинфарктная аневризма), артериальная гипертония и их сочетание, кардиомиопатии (КМП, чаще всего дилатационная) и миокардит, все чаще в различных рекомендациях по диагностике и лечению сердечной недостаточности (СН) говорится о токсических и лучевых воздействиях на миокард в качестве ее этиологического фактора [1-3].
В 2016г под эгидой Комитета по разработке практических рекомендаций ESC выпущен документ с изложением позиции о сердечно-сосудистой токсичности вследствие применения химиолучевой терапии, возникающей при лечении онкологических больных [4]. В этом документе представлены все виды тяжелого воздействия на миокард, возникающие в процессе химиолучевой терапии: это миокардиальная дисфункция и ХСН, коронарная болезнь сердца (КБС, ИБС), поражение клапанов сердца, аритмии (особенно опасны, индуцированные удлиняющими интервал QT препаратами), артериальная гипертония, тромбоэмболии, болезни периферических сосудов и инсульты, легочная гипертензия, перикардиты.
Кардиотоксическим эффектом, который может выражаться и бессимптомными изменениями на ЭКГ, и инфарктом миокарда, и развитием токсической КМП с явлениями тяжелой СН, рефрактерной к лечению, обладает довольно большая группа химиотерапевтических препаратов (табл. 1).
В современных руководствах все чаще выделяют два “классических” типа кардиотоксичности:
- типа — необратимая — в основном связана с применением антраци клиновых антибиотиков (чаще всего доксорубицина, поэтому нередко ее называют “доксорубициновой кардиотоксичностью”), и II типа — обратимая, например, при применении трастузумаба (герцептина).
Антрациклиновая кардиотоксичность. К настоящему времени описано большое количество случаев кардиологических осложнений, развивающихся на фоне введения антрациклиновых антибиотиков, что связано с их высокой противоопухолевой активностью, а также с широким их применением в различных схемах химиотерапевтического лечения [5, 6, 9, 10]. Довольно долго существовала гипотеза, что причиной антрациклиновой КМП (АКМП) является образование избытка активных форм кислорода (реактивные оксигенные образования, ROS) из-за обмена электронами между хиноновой частью антра- циклина и молекулами кислорода и другими донаторами электронов, имеющимися в клетках. Антраци- клины также формируют комплексы с железом, которые подвергаются окислительно-восстановительным реакциям, в результате которых появляются кислородные радикалы. И хотя в исследованиях in vitro подтверждалось повышение количества ROS в кардиомиоцитах после применения антрациклиновых антибиотиков, ни применение антиоксидантов, ни хелаторов железа не предотвращало развитие АКМП.
Недавно было показано, что ключевым медиатором индуцированной антраци клинам и кардиотоксичности является топоизомераза 2d. Топоизомераза второго типа осуществляет раскручивание цепочек ДНК в период ее репликации, транскрипции или рекомбинации. У человека имеется 2 вида изомеразы 2 типа: топоизомераза 2а (Тор2а) и топоизомераза 2d (Тор 2d). Считается, что Тор2а находится преимущественно в пролиферирующих клетках, участвует в репликации ДНК и является основной молекулярной целью противоопухолевой активности антрациклина. Напротив, Тор2Ь находится в покоящихся клетках, в том числе в кардиомиоцитах. К сожалению, она также подвергается воздействию антраци - клиновых антибиотиков.
Ингибиция топоизомеразы 2 антрациклинами приводит к разрывам в обеих цепочках ДНК, что и приводит к гибели клеток миокарда. Активация транскрипционного фактора, регулирующего клеточный цикл (р53), и апоптоза также являются факторами возникновения доксорубициновой кардиотоксичности. Тор2Ь также является важным фактором активации р53 в ответ на повреждение антрациклиновым антибиотиком ДНК в кардиомиоците, а индукция им повышенной выработки ROS является следствием Тор2Ь зависимого снижения транскрипции гена антиоксидантного фермента. Доксорубициндиотоксичности. При этом, удаление из сердца мышей Тор2Ь защищает их от развития АКМП. Гемохроматоз, напротив, усиливает действие Тор2Ь, способствуя увеличению продукции ROS [И].
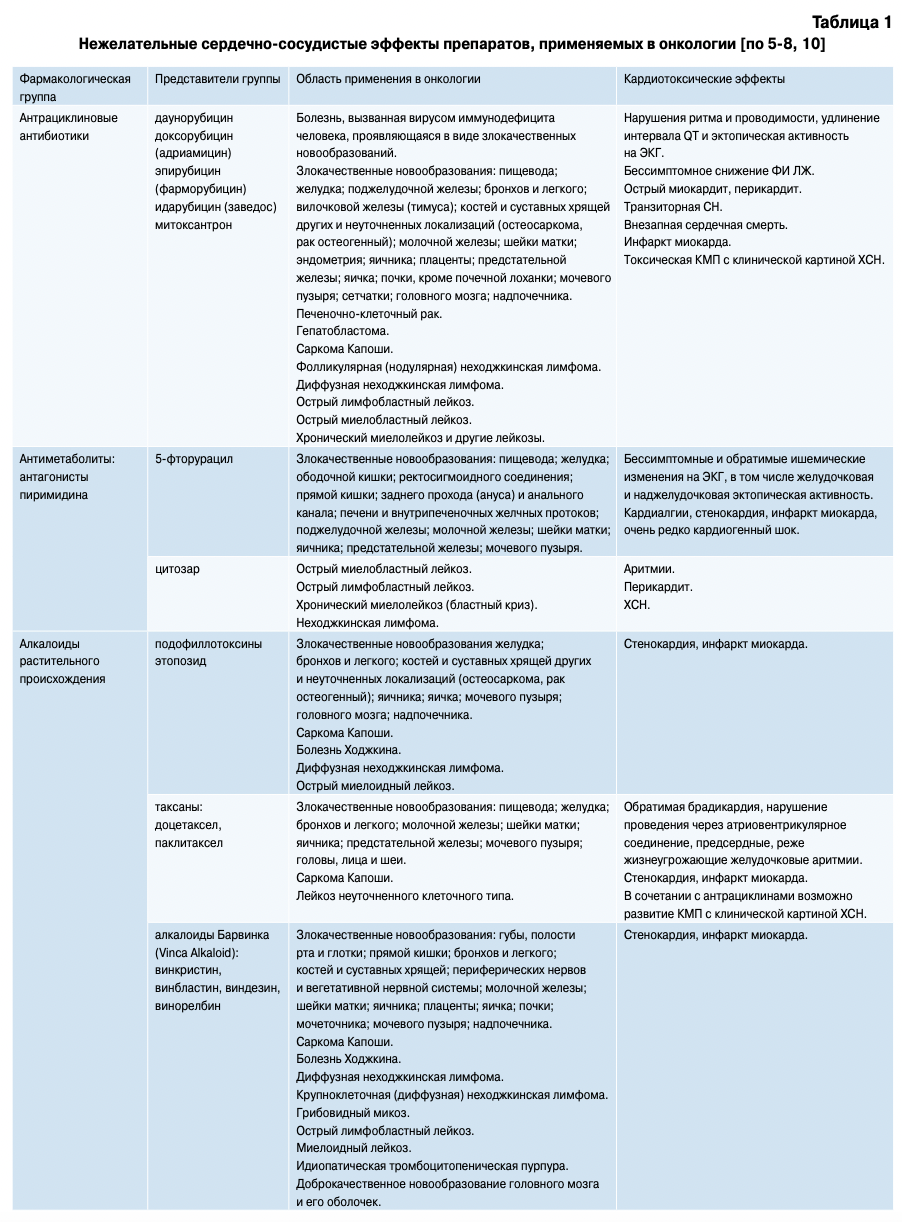
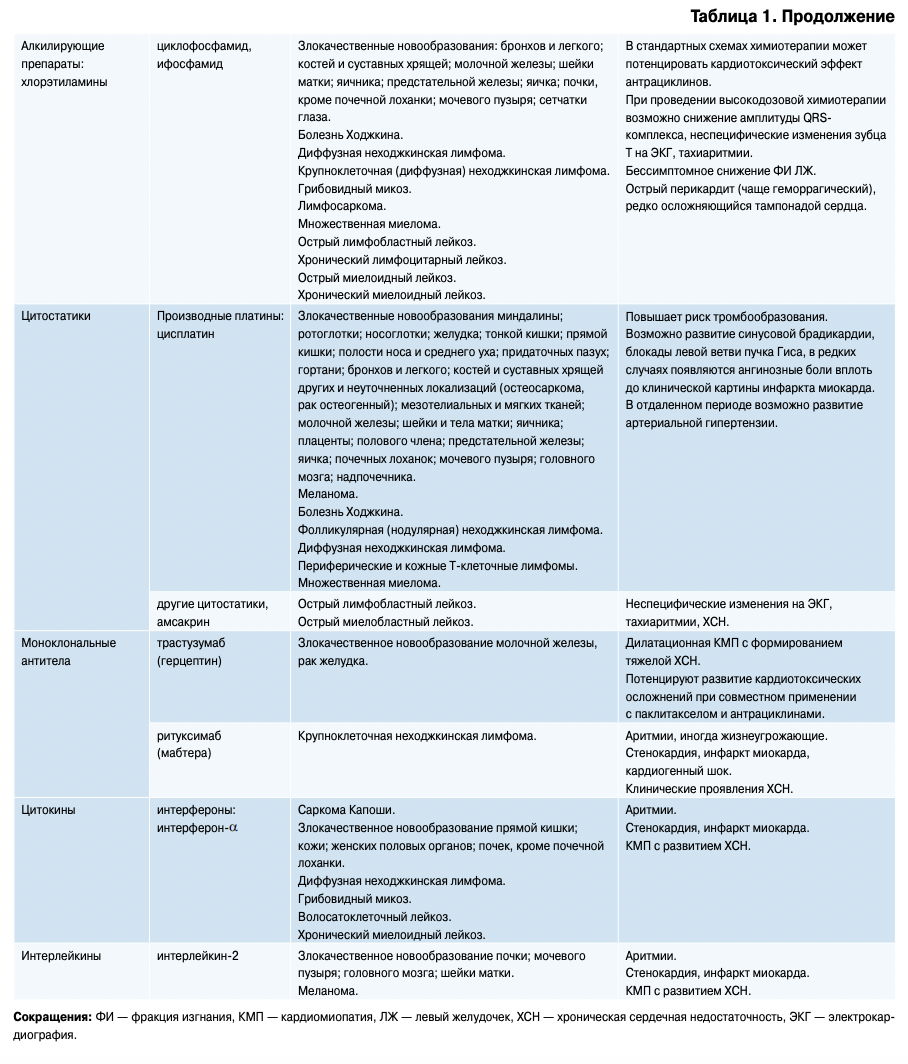

Следует также сказать, что антрациклиновые антибиотики используются преимущественно в составе различных схем химиотерапии, а не как монотерапия. Так, например, для лечения лимфомы Ходжкина применяют циклы полихимиотерапии ABVD (адриамицин, блеомицин, винбластин, дакар- базин) или ВЕАСОРР (циклофосфамид, адрибла- стин, вепезид, прокарбазин, преднизолон, блеомицин и винкристин), в которых антрациклинами являются только адриамицин и адриабластин [12]. Поэтому об “антрациклиновой кардиотоксичности” при появлении кардиологических осложнений можно говорить, но учитывать действие остальных препаратов, входящих в схемы.
На данный момент нет единой классификации кардиотоксичности химиотерапевтических препаратов, которая может развиться в различные сроки от начала лечения. Для антрациклиновой кардиотоксичности принято разделение по срокам ее возникновения на острую, подострую, хроническую и позднюю хроническую.
В рекомендациях ESMO 2012г представлена следующая классификация кардиотоксичности, возникающей при лечении антраци клиновым и антибиотиками:
- Острая — возникает менее чем у 1% больных сразу после введения препарата, обратима.
- Остро начавшаяся хроническая прогрессирующая — возникает в 1,6-2,1% случаев во время химиотерапии или в первый год после нее.
- Поздно начавшаяся хроническая прогрессирующая — возникает — 1,6-5,0% случаев через 1 год после окончания химиотерапии.
- Отдаленная (поздно возникающая) — через 20-30 лет после окончания химиотерапии, и при этом там же отмечается, что для создания классификации пока мало данных, так что она может еще пересматриваться [13].
Кардиотоксичность, связанная с применением доксорубицина и других антрациклинов явно дозозависима. Так, показано, что при применении суммарной дозы доксорубицина равной 300 мг/м2 вероятность развития ХСН равнялась 1^7%, при увеличении кумулятивной дозы до 400 мг/м — 4,7%, при 500 мг/м — 15,7%, при 650 мг/м — 48% [14]. Поэтому факторами риска кардиологических осложнений при применении антраци клинов считаются:
- Суммарная доза препарата; общая доза, введенная за день или за курс химиотерапии;
- Скорость и порядок введения препаратов;
- Облучение средостения в анамнезе;
- Возраст (младше 15 и старше 65 лет);
- Женский пол;
- Одновременное введение других противоопухолевых средств (циклофосфан, блеомицин, этопозид, цисплатин, винкристин, актиномицин, метотрексат);
- Предшествующая терапия антраци клиновым и антибиотиками;
- Сопутствующие заболевания сердечно-сосудистой системы;
- Дисбаланс электролитов (гипокалиемия, гипомагниемия) [5, 6, 9, 10, 15].
При различных онкологических заболеваниях могут применяться неодинаковые дозы и режимы введения антрациклинов (табл. 2). Как видно из приведенной таблицы 2, суммарная доза доксорубицина при лечении саркомы может достигать 720 мг/м , т.е. риск осложнений будет превышать 48%, и кардиотоксичность разовьется в виде остро начавшегося заболевания. В то же время, при лечении рака молочной железы максимальная кумулятивная доза составит 360 мг/м , и токсичность доксорубицина может проявиться поздно, через годы после лечения в виде поздно начавшейся или отдаленной КМП.
В большинстве работ АКМП представлена в виде дилатационной или рестриктивной. При этом, у взрослых пациентов ремоделирование сердца чаще носит дилатационный характер, а у пациентов, которые получали лечение в детском возрасте — рестриктивный и дилатационный [16, 17]. Представлены также данные о 3 типах ремоделирования сердца под действием антрацикл иновых антибиотиков:
- КМП с маленькой полостью и нормальной фракцией изгнания левого желудочка (ЛЖ) сердца, но с одышкой, небольшими отеками (у большинства
таких пациентов в дальнейшем симптомы ХСН исчезают); - Больные с большой полостью ЛЖ и низкой фракцией изгнания, с типичным течением ХСН;
- Самая тяжелая группа пациентов — больные с маленькой полостью и низкой фракцией изгнания, с самым тяжелым течением ХСН, часто приводящим к смерти, если не проводится трансплантация сердца [9,18].
С учетом сказанного выше, все больные онкологическими заболеваниями, получающие химиолуче- вое лечение, могут рассматриваться как пациенты ХСН стадии А по классификации ACCF/AHA [2], часть из которых пройдут и все остальные стадии.
- Т. е., все лица с онкологическими заболеваниями, получающие химиолучевое лечение, представляют собой группу пациентов без структурных изменений сердца и/или без симптомов ХСН с высоким риском развития СН — стадия А.
- У части таких больных умеренно снижается фракция изгнания ЛЖ сердца или появляется диастолическая дисфункция, но симптомы ХСН еще отсутствуют — стадия В.
- Также есть группа пациентов со сниженной или низкой фракцией изгнания ЛЖ вследствие кардиотоксичности с симптоматикой ХСН І-ІѴ функциональных классов — стадия С.
- И, наконец, часть таких больных с ХСН с IV функциональным классом и резистентностью к стандартной лекарственной терапии, которым требуется интервенционное лечение, относится к стадии D.
Профилактика и лечение кардиотоксичности
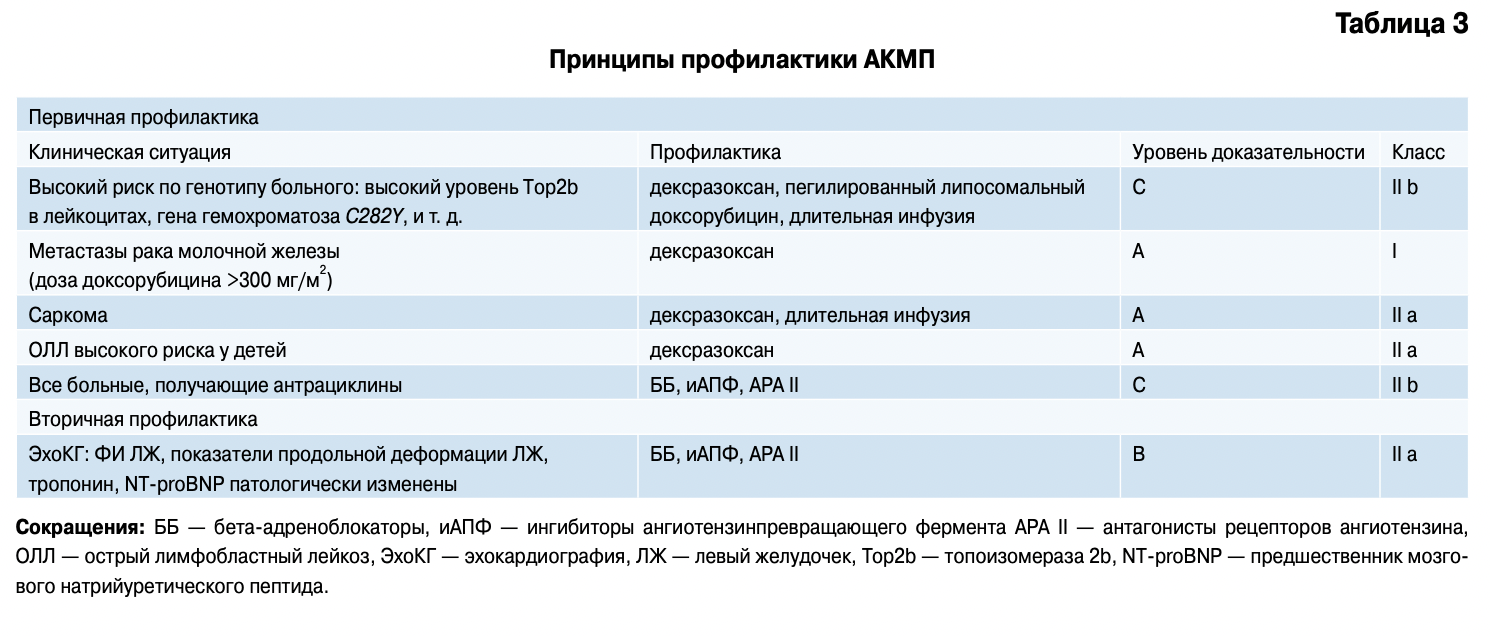
Первичная профилактика антрациклиновой кардиотоксичности основана на двух стратегиях:
- Снижении потенциальной кардиотоксичности: использование длительной инфузии препаратов, применение его липосомальных форм, использование менее токсичных производных (например, эпи- рубицина или идарубицина).
- Использовании кардиопротективных агентов: дексразоксана, бета-блокаторов, ингибиторов АПФ, блокаторов рецепторов ангиотензина II на фоне полихимиотерапии [11].
Предупреждение развития сердечно-сосудистых осложнений на фоне терапии антрациклиновыми антибиотиками, прежде всего, связано с соблюдением рекомендованных доз и длительности инфузии. Как уже сказано выше, кардиотоксичность доксорубицина прямо связана с его суммарной дозой [14], то же можно сказать и об адриамицине: риск развития АКМП при его введении в кумулятивной дозе 550 мг/м равен 7%, при повышении суммарной дозы этот риск возрастает линейно, достигая 50% (!) при ее уровне 1000 мг/м2 [19].
Липосомальная форма доксорубицина с измененной фармакокинетикой, но сохраненной высокой противоопухолевой активностью, также является попыткой снижения кардиотоксичности антраци- клинов. Такая форма легче проникает в ткани опухоли, нежели в здоровые, в том числе и сердце. Однако высокая стоимость липосомальных форм доксорубицина ограничивают его использование. Их применение одобрено FDA при раке яичников, ВИЧ- ассоциированной саркоме Капоши, множественной миеломе при неэффективности предшествующей терапии [11].
В качестве кардиопротективного препарата, предупреждающего воздействие антрациклинов на миокард, в настоящее время утвержден только дексразоксан (ICRF — 187, кардиоксан) [И]. Это препарат является железо-хелатирующим агентом. Продукты его гидролиза способны хелатировать свободное и связанное внутриклеточное железо в миокарде, что ведет к снижению количество ионов железа, которые могут образовывать комплексы с антрациклинами, тем самым уменьшая образование свободных радикалов при окислительно-восстановительных преобразованиях антра- циклинных антибиотиков. Как показано недавно, дек- стразоксан изменяет конфигурацию топоизомеразы 2ß, закрывая связывающиеся с АТФ сайты, предотвращая таким образом прикрепление к ней антрациклина и образование комплекса Тор2|1-антрациклин. Это также снижает токсическое воздействие антрациклинов [20]. Протективное действие дексразоксана было доказано во многих исследованиях.
В одном из исследований была также продемонстрирована возможность снижения противоопухолевой эффективности антрациклинов при сопутствующем приеме дексразоксана, которая затем опровергалась многими другими исследованиями [И]. Другим нежелательным не вполне доказанным эффектом дексразоксана оказался потенциальный риск вторичных злокачественных заболеваний. Так, в одном исследовании было показано, что его добавление к стандартной терапии лимфомы Ходжкина у 8 детей через четыре года привело к возникновению острого миелобластного лейкоза или миелодиспластическому синдрому (у 6 детей), раку щитовидной железы (у одного ребенка), остеосаркоме (1 случай) [21]. Однако два других больших исследования применения дексразоксана у подростков и детей с острым лимфобластным лейкозом, леченых антрациклинами, опровергают эту вероятность [22, 23].
Тем не менее, с 2011г FDA и ЕМА опубликовали дополнение к инструкции по использованию дексразоксана, который в настоящее время рекомендуется использовать только у женщин с прогрессирующим или метастатическим раком молочной железы, при продолжении химиотерапии с включением антрациклиновых антибиотиков, и получавших их ранее в кумулятивной дозе (для доксорубицина — 300 мг/м , эпирубицина — 540 мг/м ) [11].
Что же касается применения для кардиопротекции препаратов, обычно используемых для лечения ХСН, то, как правило, исследований, показавших их положительный эффект немного и проведены они на небольшом количестве пациентов.
Так, в 2006г были опубликованы данные о защитном эффекте карведилола при использовании антрациклин- содержащих схем химиотерапии. В исследовании показано, что при применении 12,5 мг карведилола на протяжении всего курса химиотерапии, ФИ ЛЖ сердца оставалась на прежнем уровне. При этом, в контрольной группе было отмечено статистически значимое снижение ФИ ЛЖ более чем на 10% от исходной, кроме того в этой группе было отмечено достоверное снижение показателей диастолической функции ЛЖ. Механизм кардиопротективного действия карведилола исследователи связали с его антиоксидантной активностью, блокированием апоптозных сигнальных путей, кроме того обсуждалась возможность восстановления работы Са -АТФ-азы и блокирование притока кальция в кардиомиоциты. Однако данное исследование проведено только на 50 пациентах (25 человек получали кар- ведилол, 25 — плацебо) [24].
Правдивцевой Е. В. и др. в работе по изучению профилактики кардиотоксического действия антра- циклиновых антибиотиков был использован перин- доприл у 26 больных с лимфопролиферативными заболеваниями в момент проведения химиотерапии. В группе больных, которые не получали иАПФ после химиотерапии отмечено достоверное снижение ЧСС, МОС и СИ, а также выявлено достоверное снижение диастолической функции. В группе больных, которые получали пер индо пр ил отрицательных эффектов полихимиотерапии было статистически значимо меньше [25].
В 2013г было проведено рандомизированное, плацебо контролируемое исследование эффективности эналаприла в комбинации с карведилолом и без него при лечении антрациклин-индуцированной КМП у больных после химиотерапевтического лечения гематологических онкологических заболеваний (исследование OVERCOME — prevention of left Ventricular dysfunction with Enalapril and caRvedilol in patients submitted to intensive Chemotherapy for the treatment of Malignant hEmopathies). Из 90 пациентов 36 было с недавно диагностированными острыми лейкозами, 54 больных подверглись аутологической трансплантации стволовых клеток по поводу резистентных к лечению лимфомы Ходжкина и неходж- кинских лимфом. Все больные получали интенсивную терапию антрациклинами и другими противоопухолевыми препаратами. Статистически значимые результаты были достигнуты в следующих показателях: преждевременное окончание лечения из-за ХСН — 3 человека в группе эналаприл + карведилол, в группе плацебо — 11 (Р=0,02), смерть или ХСН — 3 и 10 больных, соответственно, (Р=0,036), смерть, ХСН или ФИ <45% — 3 и И пациентов, соответственно, (Р=0,02). Не было получено статистически значимых различий в таких показателях, как общая смертность (Р=0,11), количество больных со снижением ФИ >10% (Р=0,90), ХСН или снижение ФИ >10% (Р=0,22), количество тяжелых нежелательных явлений (Р—0,15). Авторы приходят к выводу, что профилактическое назначение эналаприла вместе с карведилолом перед и во время полихимиотерапии предотвращает левожелудочковую дисфункцию [26].
Вторичная профилактика начинается при появлении признаков дисфункции ЛЖ сердца, т. е при снижении ФИ, снижении показателей его продольной деформации, повышении концентрации тропонина I или Т, NT-proBNP. В таких случаях применяют препараты, используемые для лечения ХСН. Все сказанное выше суммировано в таблице 3.
Лечение возникшей или выявленной антрацикли- новой кардиотоксичности проводится по общим правилам лечения ХСН. Следует сказать, что выживаемость пациентов с тяжелой доксорубициновой КМП чрезвычайно низка. Она ниже, чем продолжительность жизни больных с идиопатической дилатационной КМП и ХСН ишемического генеза [28]. С учетом низкой эффективности лекарственной терапии и высокой смертности больных антрациклин-инду- цированной КМП, на данный момент единственным путем спасения остается трансплантация сердца.
В 2013г были опубликованные данные о выживаемости пациентов с АКМП после ортотопической трансплантации сердца. Lenneman AJ, et al. провели ретроспективный анализ данных, полученных из United Network of Organ Sharing (UNOS). В базе данных UNOS за 1987-201 Irr получены сведения о 51765 пациентах подвергшихся первичной ортотопической трансплантации сердца, среди них 453 пациента с антрациклиновой КМП. У всех пациентов АКМП была дилатационной. Десятилетняя выживаемость всех пациентов после трансплантации сердца не показала статистически значимых различий между выживаемостью пациентов с АКМП и с КМП от другой этиологии. После поправки на возраст, пол и анамнез злокачественных заболеваний, отмечено
статистически значимое увеличение 10-летней выживаемости пациентов с АКМП. Интересным также является то, что причины смерти в обеих группах были одинаковые, хотя в этом исследовании нет данных о развитии онкологических заболеваний на фоне иммуносупрессии после ортотопической трансплантации сердца [28].
Guilherme Н, et al. в похожем ретроспективном исследовании показали близкую выживаемость после ортотопической трансплантации сердца пациентов с КМП после химиотерапевтического лечения с другими вариантами КМП. 1-, 3- и 5-летняя выживаемость после ортотопической трансплантации сердца у пациентов с КМП на фоне химиотерапии составила 86%, 79% и 71%, соответственно. Выживаемость в эти же сроки у пациентов с другими КМП составила 87%, 81% и 74%. После трансплантации сердца у пациентов с постхимиотерапевтическими КМП чаще развивались инфекционные осложнения (22% против 14%) и злокачественные новообразования (5% против 2%). Однако структура смертности в обеих группах была идентичная [28]. В 2014г была показана возможность применения имплантируемого кардиовертера-дефибриллятора, ресинхрони- зационной терапии, аппаратов циркуляторной поддержки, ортотопической трансплантации сердца и их преимуществ перед традиционной терапией у больных с АКМП резистентных к консервативному лечению [29].
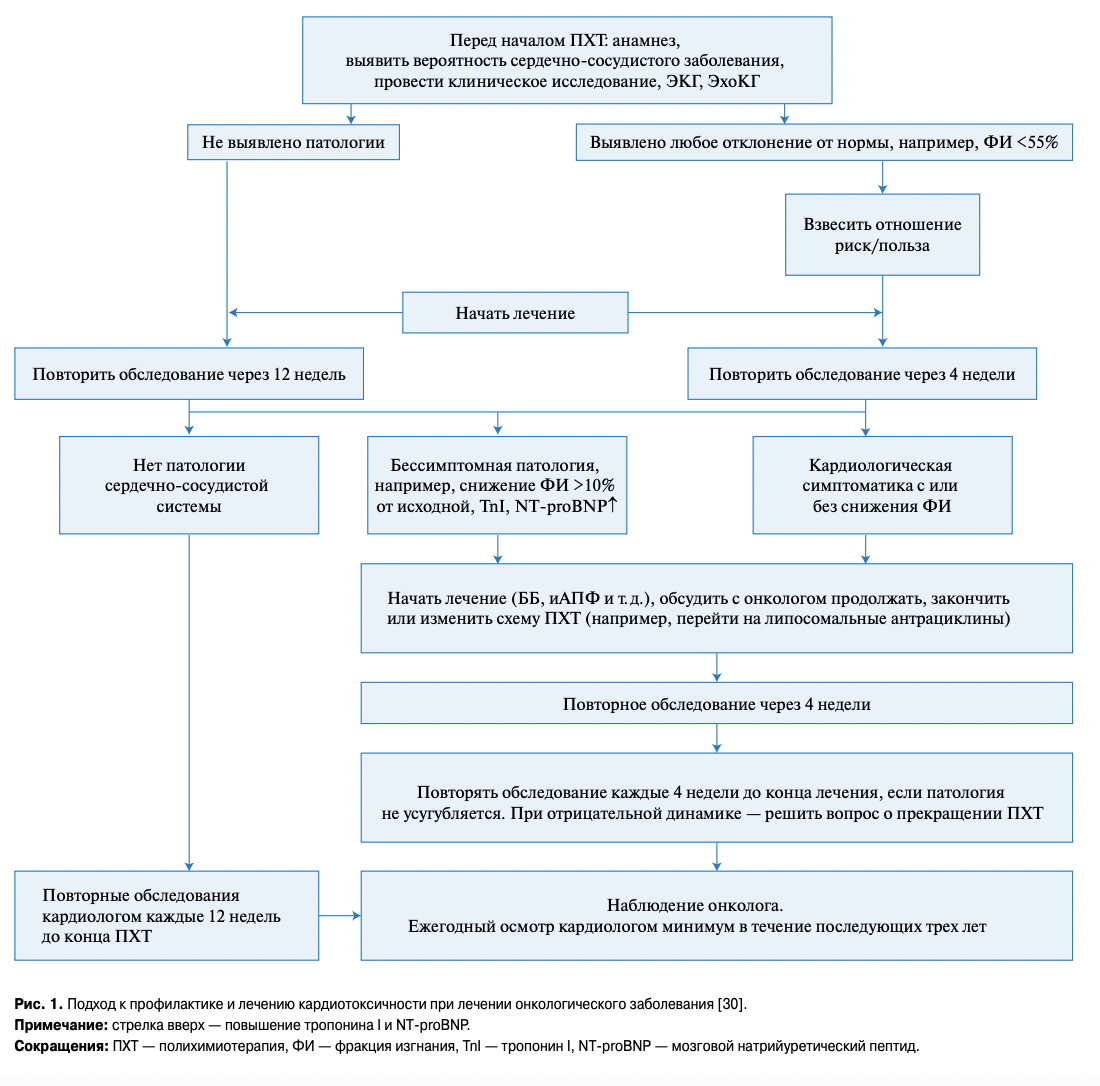
Понимание тяжести и необратимости АКМП привело к разработке комплексного подхода к профилактике и лечения этого состояния при взаимодействии кардиолога и онколога/химиотерапевта (рис. 1). В то же время, подобная схема может и должна применяться при лечении любыми кардио- токсичными препаратами.
Кардиолог перед назначением полихимиотерапии должен изучить анамнез пациента, выявить возможные заболевания или нарушения функции сердца у пациента. Минимальное клиническое обследование до лечения обязательно должно включать ЭКГ и эхокардиографию (ЭхоКГ). В период лечения должны исследоваться биомаркеры поражения миокарда — тропонин I или Т, NT-proBNP. Малейшие отклонения этих показателей в процессе лечения должны тщательно анализироваться. Эти больные после окончания химиотерапии и излечения от онкологического заболевания или благоприятно протекающей ремиссии должны постоянно наблюдаться кардиологом.
Самая трудная задача, возникающая перед кардиологом и онкологом, это решение о возможности или невозможности начала, а также продолжения или прекращения эффективного лечения онкологического заболевания при возникновении признаков дисфункции ЛЖ сердца и/или ХСН (рис. 1).
Кроме того, необходимо помнить о том, что существуют противоопухолевые препараты, побочным действием которых является сосудистая патология, приводящая к ХСН и сосудистым катастрофам. Так, например, побочным действием препаратов-ингибиторов фактора роста сосудистого эндотелия (ингибиторы VEGF) является развитие артериальной гипертонии вследствие повышения при их применении сосудистого тонуса из-за снижения выработки оксида азота и способности гладкой мускулатуры к релаксации. Повышение периферического сосудистого сопротивления при этом способствует дальнейшему поражению эндотелия, его слущиванию и дисфункции, рарификации капилляров. Это большая группа препаратов, применяемая при многих онкологических заболеваниях, состоящая из двух подгрупп, оказывающих близкий эффект: моноклональные антитела к VEGF (бевацизумаб) и низкомолекулярные ингибиторы тирозинкиназ (сорафениб, сунитиниб, пазопаниб. Для лечения артериальной гипертензии, вызванной этими препаратами, применяют обычные гипотензивные средства с учетом межлекарственных взаимодействий. Повышение артериального давления может возникать и при применении других противоопухолевых препаратов: алкилирующих (циклофосфамид, ифофосфамид), иммуносупрессоров (циклоспорин, такролимус) и т.д. [30].
В обследование больных старше 35-40 лет должны быть включены методы выявления ишемической болезни сердца, в т.ч. исследование с физической нагрузкой. Особенно это касается пациентов, которым назначены противоопухолевые препараты, провоцирующие вазоспазм, поражение коронарных артерий с развитием стенокардии и острого коронарного синдрома и связанных с ними тяжелых жизнеугрожающих аритмий. Причем, такие препараты как 5-фторурацил и капецитобин могут привести к этим тяжелым последствиям сразу после начала лечения. К появлению приступов стенокардии и инфаркту миокарда может привести и применение ингибиторов VEGF и некоторых используемых в онкологии лекарств, представленных в таблице 1. В этом случае должны быть применены все возможности для исключения стенозов коронарных артерий: радионуклидные методы, мультиспиральная компьютерная томография и коронароангиография [29, 30].
Для своевременного выявления признаков кардиотоксического повреждения сердечно-сосудистой системы и назначения необходимой терапии больным злокачественными заболеваниями рекомендуется расширенное обследование и совместное наблюдение онкологами и кардиологами. Обследование пациентов в обязательном порядке должно проводиться перед предстоящим лечением, во время его проведения и на протяжении многих лет после его окончания — с учетом осложнений, развивающихся
в отдаленном периоде, динамическое наблюдение за этими пациентами должно быть фактически пожизненным.
Все сказанное выше ставит перед кардиологами и терапевтами новые задачи: знание проявлений кардиотоксичности, проведение мероприятий по их профилактике, своевременное выявление и лечение кардиотоксичности, развивающихся на фоне или после окончания терапии онкологических заболеваний.
Литература
- MareevVY Ageev FT, Arutyunov GP, et al. National guidelines OSSN, the RKO and RNMOT for the diagnosis and treatment of chronic heart failure (fourth revision). Journal of Heart failure, 2013; 14, 7 (81). Russian (Мареев В.Ю., Агеев Ф.Т, Арутюнов Г.П. и др. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). Журнал Сердечная Недостаточность, 2013; 14, 7 (81)).
- Yancy CW, Jessup М, Bozkurt В, et al. 2013 ACCF/AHA Guideline for the Management of Heart Failure. JACC2013; 62,16: e147-239.
- Pinto YM, Elliott PM, Arbustini E, et al. Proposal for a revised definition of dilated cardiomyopathy, hypokinetic non-dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases. Eur Heart J., 2016; 37 (23): 1850-8. doi:10.1093/eurheartj/ehv727.
- Zamorano JL, Lancellotti P, Munoz DR, etai. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. European Heart Journal doi:10.1093/eurheartj/ehw211.
- Bovelli D, Plataniotis G, Roila F. Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol, 2010; 21 (5): 277-82.
- Poddubnaya IV, Oriol NF. Guide for chemotherapy of neoplastic diseases. N1 Perevodchikova. M., 2011: 435-6. Russian (Поддубная И. В., Орел Н.Ф. Руководство по химиотерапии опухолевых заболеваний. Под ред. Н.И. Переводчиковой. М., 2011:435-6).
- Hochhaus A, Kantarjian Н. The development of dasatinib as a treatment for chronic myeloid leukemia (CML): from initial studies to application in newly diagnosed patients. J Cancer Res Clin Oncol (2013) 139:1971 -84 DO110.1007/s00432-013-1488-z.
- Moslehi JJ, Deininger M. Tyrosine Kinase Inhibitor-Associated Cardiovascular Toxicity in Chronic Myeloid Leukemia. Journal of Clinical Oncology.2015Dec 10; 33(35): 4210-8. doi: 10.1200/JC0.2015.62.4718.
- Emelina El, Gendlin GE. Cardiology problems in oncology practice. Oncohematology Journal, 2012; 2: 18-23. Russian (Емелина Е.И., Гендлин Г.Е. Проблемы кардиологии в онкологической практике. Журнал Онкогематология, 2012, 2: 18-23).
- Matyas MG, Kravchuk TL, Vysotskaya W, et al. Anthracycline-induced cardiotoxicity: mechanisms of development and clinical manifestations. Siberian Journal of Oncology 2008; 6 (30): 66-75. Russian (МатяшМ.Г, КравчукТ.Л., Высоцкая В.В. и др. Индуцированная антрациклинами кардиотоксичность: механизмы развития и клинические проявления. Сибирский онкологический журнал, 2008; 6(30): 66-75).
- Vejpongsa Р, Yeh ЕТН. Prevention of Anthracycline-lnduced Cardiotoxicity. Challenges and Opportunities. Journal of the American College of Cardiology, 2014; 64, 9: 938-45.
- The Russian clinical guidelines for the diagnosis and treatment of lymphoproliferative disorders. Edited by prof. Poddubnaya IV, prof. Savchenko VG. M. Buki Vedi, 2016. Russian (Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под редакцией проф. Поддубной И.В., проф. Савченко В. Г. М. Буки Веди, 2016).
- Curigliano G, Cardinale D, Suter T, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines Clinical practice guidelines. Annals of Oncology, 2012; 23(7): 155-66.
- Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. 2003; 97: 2869-79.
- Brana I, Tabernero J. Cardiotoxicity. Ann Oncol., 2010; 21(7): 173-9. do!: 10.1093/ annonc/mdq295.
- Raj S, Franco VI, Lipshultz SE. Anthracycline-lnduced Cardiotoxicity: A Review of Pathophysiology, Diagnosis, and Treatment. Curr Treat Options Cardio Med, 2014; 16: 315.
- Douraid KS, Kaki IIR. Chemotherapy Induced Cardiomyopathy: Pathogenesis, Monitoring and Management. Clin. Med Res., 2009; 1(1): 8-12.
- Shuykova KV, Emelina El, Gendlin GE, et al. Alteration of left ventricular function in patients with lymphoma during administration of anthracycline antibiotics. Russian Journal of Cardiology, 2016; 1 (129): 41-6. Russian (ШуйковаК.В., ЕмелинаЕ.И., Гендлин ГЕ. и др. Изменение функции левого желудочка сердца больных с лимфомами на фоне введения антрациклиновых антибиотиков. Российский кардиологический журнал, 2016; 1 (129): 41-6. doi.org/10.15829/1560-4071 -2016-1 -41-46).
- Міоіо GM, Mura NL, Nigri P, et al. The cardiotoxicity of chemotherapy: New prospects for an old problem. Radiol Oncol, 2006; 40(3): 149-61.
- Lyu Y Kerrigan JE, Lin CP, et al. Topoisomerase »beta mediated DNA double-strand breaks: implications in doxorubicin cardiotoxicity and prevention by dexrazoxane. Cancer Res 2007; 67: 8839-46.
- Tebbi CK, London WB, Friedman D, et al. Dexrazoxane-associated risk for acute myeloid leukemia/myelodysplastic syndrome and other secondary malignancies in pediatric Hodgkin’s disease. J Clin Oncol 2007; 25:493-500.
- Vrooman LM, Neuberg DS, Stevenson KE, et al. The low incidence of secondary acute myelogenous leukaemia in children and adolescents treated with dexrazoxane for acute lymphoblastic leukaemia: a report from the Dana-Farber Cancer Institute ALL Consortium. Eur J Cancer, 2011; 47: 1373-9.
- Salzer WL, Devidas M, Carroll WL, et al. Longterm results of the pediatric oncology group studies for childhood acute lymphoblastic leukemia 1984-2001: a report from the children’s oncology group. Leukemia, 2010; 24: 355-70.
- Kalay N, Basar E, Ozdogru I, et al. Protective effects of carvedilol against anthracycline- induced cardiomyopathy. J Am Coll Cardiol, 2006; 48: 2258-62.
- Pravdivtseva EV, Poteshkina NG, Svanadze AM, et al. Prevention of cardiotoxicity of the anthracycline antibiotic doxorubicin: the role of ACE inhibitor perindopril. Clinician. 2011; 5, 3: 55-60. Russian (ПравдивцеваB., Потешкина Н.Г., СванадзеА.М. и др. Профилактика кардиотоксического действия антрациклинового антибиотика доксорубицина: роль ингибитора ангиотензинпревращающего фермента периндоприла. Клиницист. 2011; 5,3: 55-60).
- Bosch X, Rovira М, Sitges М, et al. Enalapril and Carvedilol for Preventing Chemotherapy- Induced Left Ventricular Systolic Dysfunction in Patients With Malignant Hemopathies. The OVERCOME Trial (prevention of left Ventricular dysfunction with Enalapril and caRvedilol in patients submitted to intensive Chemotherapy for the treatment of Malignant hEmopathies). Journal of the American College of Cardiology 2013; 61,23. ISSN 0735- 1097/^36.00 Published by Elsevier Inc. http://dx.doi.Org/10.1016/j.jacc.2013.02.072.
- Felker GM, Thompson RE, Hare JM, et al. Underlying Causes and Long-term Survival in Patients with Initially Unexplained Cardiomyopathy. The New England Journal of Medicine, 2000; 342, 15: 1077-84.
- Lenneman AJ, Wang L, Wigger M, etal. Heart transplant survival outcomes for adriamycin- dilated cardiomyopathy. Am J Cardiol., 2013; 111: 609-12.
- Oliveira GH, Qattan MY Kindi SAI, et al. Advanced Heart Failure Therapies for Patients With Ch emotherapy-Induced Cardiomyopathy. Circ Heart Fail., 2014; 7: 1050-8.
- Schlitt A, Jordan K, Vordermark D, et al. Cardiotoxicity and oncological treatments. Dtsch Arztebl Int, 2014; 111(10): 161-8. DOI: 10.3238/arztebl.2014.0161.





