COVID-19 и поражение печени


Опубликована Март 1, 2020
Последнее обновление статьи Ноя. 28, 2022
Аннотация
В конце декабря 2019 г. в Китайской народной Республике началась вспышка неизвестной пневмонии, вызванная новым коронавиру-сом SARS-CoV-2 (severeacuterespiratorysyndromecoronavirus — коронавирус тяжелого острого респираторного синдрома). Всемирная организация здравоохранения 11 февраля 2020 г. присвоила официальное название SARS-CoV-2-инфекции, — COVID-19 («CoronaVirus Disease 2019» — заболевание, вызванное новым коронавирусом 2019). Пневмония является ведущей клинической формой COVID-19. Однако по мере распространения пандемии COVID-19 и анализа клинических данных у заболевших стали выделять симптомы, не характерные для «аномальной» пневмонии. Описаны неврологические проявления, изменения кожи, поражения глаз и др. Внелегочное присутствие SARS-CoV-2 обнаружено также в холангиоцитах. Среди возможных факторов повреждения печени рассматривается вирус-индуцированное влияние, системное воспаление («цитокиновый шторм»), гипоксия, гиповолемия, гипотония при шоке, лекарственная гепатотоксичность и др. У 14-53% пациентов с COVID-19 могут регистрироваться изменения биохимических показателей, которые, как правило, не требуют медикаментозной коррекции. Весьма редко развивается острый гепатит. Однако особое внимание следует уделять пациентам с COVID-19, относящимся к группе риска — перенесшим трансплантацию печени, получающим иммуносупрессанты, а также в случаях декомпенсации цирроза, развитии острой печеночной недостаточности на фоне хронической, гепатоцеллюлярной карциномы, при проведении противовирусной терапии. Необходим постоянный обмен и открытый доступ к научным данным, новым технологиям, обновляющимся руководствам.
Ключевые слова
Заболевание, вызывающие респираторный синдром, поражение печени, коронавирусы, вызванное новым коронавирусом
Введение
Коронавирусы широко распространены в природе и являются причинами различных простудных заболеваний (до 25%). Большинство из них вызывают вирусную инфекцию, не наносящую серьезного вреда здоровью, но некоторые, такие как SARS-CoV (severe acute respiratory syndrome coronavirus — коронавирус тяжелого острого респираторного синдрома) и MERS-CoV (Middle East respiratory syndrome coronavirus — коронавирус ближневосточного респираторного синдрома) приводят к развитию тяжелого респираторного синдрома с высокой летальностью [1, 2].
В природе естественным хозяином для коронавирусов служат многие виды летучих мышей. Эволюционируя вследствие мутаций, процессов преадаптации они периодически вызывают в человеческих популяциях эпидемии. Так, начавшаяся вспышка неизвестной пневмонии в конце декабря 2019 г. в Китае, стала причиной развития чрезвычайной ситуации в области общественного здравоохранения, в последующем приведшая к пандемии, вызванной новым коронавирусом SARS-CoV-2 (severe acute respiratory syndrome coronavirus — коронавирус тяжелого острого респираторного синдрома) [2, 3]. Всемирная организация здравоохранения (ВОЗ) 11 февраля 2020 г. присвоила официальное название SARS-C6V-2-инфекции, — COVID-19 («CoronaVirus Disease 2019»- заболевание, вызванное новым короновирусом 2019). Летальность от этой инфекции составляет 0,5-3% [4].
SARS-CoV-2 и возможные механизмы патогенеза COVID-19
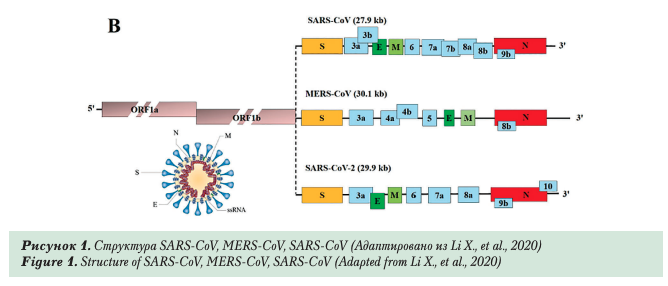
Новый коронавирус — одноцепочечный РНК- содержащий вирус, относится к семейству Сого- naviridae, рода Betacoronavirus. SARS-CoV-2 — зоонозный вирус, что следует из филогенетического анализа, который показал наиболее тесную связь с изолятом SARS-подобного коронавируса летучих мышей BM48-31/BGR/2008 (идентичность — 96%). По-видимому, летучие мыши, являются резервуаром SARS-CoV-2, а другие мелкие млекопитающие (в частности, панголины) — промежуточными хозяевами, возможно заразившими «нулевого пациента» [1]. Кроме того, при филогенетическом анализе SARS-CoV-2 получены данные, свидетельствующие о 88% идентичности последовательностей с SARS- CoV и около 50% — с MERS-CoV [1, 5]. Структура коронавирусов респираторных синдромов весьма похожа (рис. 1).
Среди структурных белков SARS-CoV-2 выделяют S-протеины или «белковые шипы» (от англ. Spike — шип), мембранный белок, белок оболочки и нуклеокапсида. Белок S играет важную роль в прикреплении, слиянии и проникновении вируса в клетки, что позволяет его рассматривать и в качестве возможной мишени для выработки антител и вакцины.
Патогенез новой коронавирусной инфекции изучен недостаточно [6, 7]. Ключевым фактором вирулентности является взаимодействие рецептор- связывающего домена (receptor-binding domain — RBD) белка S, расположенного на внешней мембране SARS-CoV-2, с рецептором ангиотензин-пре- вращающего фермента 2 (angiotensin-converting enzyme 2 receptors — АСЕ2), активируемого трансмембранными сериновыми протеазами (TMPRSS2 -Transmembrane protease, serine 2) человека [8]. АСЕ2 экспрессируется в сурфактанте, секретируемом альвеолоцитами II типа из компонентов плазмы крови. Сурфактант представляет собой поверхностно-активную мономолекулярную пленку, которая расположена на границе раздела фаз воздух — жидкость в альвеолах, альвеолярных ходах и респираторных бронхиолах 1-3-го порядка и препятствует спадению (слипанию) стенок альвеол при дыхании. Экспрессия АСЕ2 защищает от повреждения легкие, однако она снижается вследствие его связывания со спайковым белком SARS- CoV, что увеличивает риск инфицирования. Вместе с этим, в эксперименте было показано, что усиление экспрессии АСЕ2 не исключает вероятности увеличения связывания с SARS-CoV. К одной мишени может прикрепиться до трех вирусов. АСЕ2 и TMPRSS2 неравномерно распределены среди пациентов европейского и азиатского происхождения, что также может влиять на интенсивность заражения.
Высказано предположение, что неструктурные белки SARS-CoV способны видоизменять структуру гемоглобина в эритроците, что приводит к нарушению транспорта кислорода, вызывает диссоциацию железа, образование порфирина, повышение ферритина. Такое воздействие может привести к усилению воспалительных процессов в легких, оксидативному стрессу, гипоксемии, гипоксии, развитию симптомов острого респираторного дистресс-синдрома (ОРДС) и полиорганной кислородной недостаточности [9]. Однако основанием для данной гипотезы явилось создание биотрансформационной модели без проведения экспериментальных и клинических исследований
SARS-CoV-2 тропен к бокаловидным клеткам, содержащимся в слизистой оболочке дыхательных путей, кишки, конъюнктиве глаз, протоках поджелудочной и околоушных слюнных желёз. Активная репликация вируса, значительно снижает защитные функции бокаловидных клеток (слизеобразование), что также способствует проникновение вируса в организм человека.
В ответ на распространение коронавируса наблюдается развитие гипериммунной реакции — так называемый «цитокиновый шторм», характеризующийся синтезом значительного (аномального) количества провоспалительных интерлейкинов (ИЛ-lß, ИЛ-6, фактора некроза опухоли и др.) и хемокинов при одновременном снижении содержания Т-лимфоцитов в крови [10].
Кроме того SARS-CoV-2, инфицируя эндотелий кровеносных сосудов, взаимодействует с расположенными там АСЕ2 и приводит к развитию эндотелиальной дисфункции, гиперпроницаемости, нарушению микроциркуляции, развитию сосудистой тромбофилии и тромбообразованию [11].
Прогрессирование COVID-19 определяется диффузным альвеолярным повреждением с образованием гиалиновых мембран, развитием отека легких. Гистологическая картина легких при аутопсии характеризуется организацией альвеолярных экссудатов и интерстициальным фиброзом, образованием гиалиновых мембран, наличием интерстициальных мононуклеарных воспалительных инфильтратов, многочисленных микротромбов фибрина, выраженным отеком, гиперплазией и очаговой десквамацией
альвеолоцитов II типа, значительным содержанием макрофагов с вирусными включениями в альвеолярном экссудате. В более пораженных областях наблюдается кровоизлияние, некроз, геморрагический инфаркт [12,13].
Клиническая картина и диагностика COVID-19
Инфицирование SARS-CoV-2 человека происходит в последние дни инкубационного периода и максимально в первые три дня от начала болезни. У подавляющего большинства заражение возникает вследствие контакта с пациентом COVID-19 в случаях клинически манифестировавшего заболевания (до 75-85% — при контакте с инфицированными родственниками из семейного окружения). Следует подчеркнуть, что выделение вируса, как правило, продолжается до 12 дней в легких/умеренных случаях и более 14 дней — в тяжелых. Однако у выздоровевших от COVID-19 пациентов РНК нового коронавируса может быть положительной и после исчезновения клинических симптомов. Болеющий COVID-19, может заразить 3-5 окружающих его людей, а болеющий гриппом — лишь 1-2 человек [14-16].
Эпидемиологические данные свидетельствуют о том, что пациенты с сердечно-сосудистыми заболеваниями, артериальной гипертензией, сахарным диабетом, злокачественными опухолями являются наиболее восприимчивыми к SARS-C6V-2.
Инкубационный период составляет 2-14 суток (средний период — 5-6 дней). SARS-C6V-2 передаётся воздушно-капельным (при кашле, чихании, разговоре), воздушно-пылевым (с пылевыми частицами в воздухе), контактным (через рукопожатия, предметы обихода) и фекально-оральным путями [17].
Клинические формы COVID-19 [18]:
- легкая (с поражением только верхних дыхательных путей),
- среднетяжелая (пневмония без дыхательной недостаточности),
- тяжелая (пневмония с развитием дыхательной недостаточности, или появлением инфильтратов в легких в виде «матового стекла», занимающих более 50% легких в течение 24-48 ч);
- очень тяжелая/критическая форма (пневмония, ОРДС, сепсис, септический шок, полиорганная недостаточность).
Доля бессимптомного (латентного) COVID-19 не ясна. Однако и при скрытом течении инфекции в отсутствие жалоб и клинических проявлений при проведении компьютерной томографии легких может наблюдаться синдром «матового стекла», более отчетливо регистрируемый на высоте вдоха, позволяющий диагностировать пневмонию.
В отчете о совместной технической миссии ВОЗ и Китайской Народной Республики по проблеме новой коронавирусной инфекции были выделены типичные признаки и симптомы заболевания (таблица 1).
Однако по мере распространения пандемии COVID-19 и анализа клинических данных у заболевших стали выделять симптомы, не характерных для «аномальной» пневмонии [19]. В отсутствие респираторных нарушений диагноз COVID-19 стал устанавливаться врачами различных специальностей на основании выявления «нетипичных» признаков и последующего применения молекулярно-генетических методов.
Так, были описаны клинические наблюдения пациентов с положительным тестом на РНК SARS-C6V-2 и наличием неврологических проявлений в виде аносмии (потеря обоняния), дисгевзии (отсутствие вкуса), что, по-видимому, связано с интраназальным инфицированием и поражением нейровазальных структур [20,21]. В случаях тяжелого течения инфекция осложнялось развитием преходящей ишемической атаки, эпилепсии, инфаркта головного мозга [22, 23].

В Российской популяции встречались случаи обращения пациентов за медицинской помощью по поводу кровоизлияний и болевых ощущений в глазах, слезотечения, сменяющегося сухостью. В ряде наблюдений положительный тест на SARS-CoV-2 подтверждал вирусную природу заболевания. При отсутствии других клинических проявлений диагностировали скрытую форму COVID-19, проявляющуюся лишь
конъюнктивитом (рис. 2, собственный клинический опыт авторов). Подобные наблюдения описаны зарубежными коллегами [24].
Следует также учитывать другие возможные причины конъюнктивита. В связи с этим представляется важным выявление вирусных и бактериальных антигенов у SARS-CoV-2-положительных пациентов, которые могут влиять на течение инфекции и терапевтическую тактику.
Так, проведенное в 2020 г. в Stanford University (Стэндфордский Университет, США) исследование подтвердило наличие ко-инфицирования при COVID-19. В 20,7% случаев выявляли различные сочетания маркеров вирусов гриппа и парагриппа 1-4, респираторно-синцитиального вируса, аденовируса, риновируса, энтеровируса, Chlamydia pneumoniae и Mycoplasma pneumoniae [25].
Нетипичные проявления COVID-19 регистрировали также в дерматологической практике. S. Recalca- ti, 2000 г. [26] у 18 (20,4%) из 88 больных отметил различные кожные изменения (по типу эритематозной или везикулярной сыпи, распространенной крапивницы), причем в 4 случаях — в дебюте инфекции, сопровождающиеся неинтенсивным зудом [26].
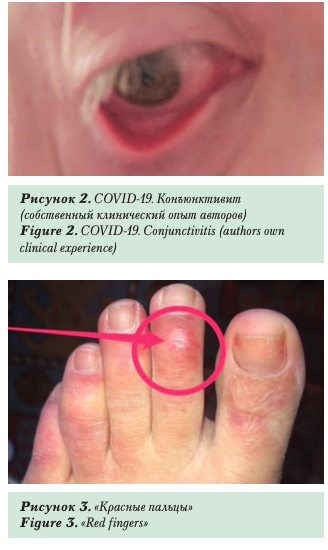
Характер кожных проявлений отличался в разных возрастных группах. В испанском исследовании среди 375 больных COVID-19 у 6% пациентов пожилого возраста наблюдали развитие ливедо и некроза [27]. Кроме того, в сообществе дерматологов обсуждается еще один признак COVID-19, который ранее не был замечен [28]. Он связан с поражением пальцев рук и ног с характерной пурпурной окраской, что послужило основанием для обозначения его как симптом «коронавирусных пальцев» (рис. 3). Жжение и боль в пальцах, по-видимому, обусловлены нарушениями микроциркуляции и/или развитием микротромбозов, что, возможно, является локальным проявлением воздействия SAR S-CoV-2.
В целом, по мнению авторов, анализ нетипичных признаков COVID-19 указывает на наличие эндотелиальной дисфункции и, в определенной степени, на возможность развития локального или системного васкулита.
Диагностика COVID-19
Пневмония является ведущей клинической формой COVID-19. Диагностика пневмонии при COVID-19 основывается на данных эпидемиологического анамнеза и клинического обследования, результатов лабораторных и инструментальных методов. При рентгенологическом исследовании и компьютерной томографии в легких выявляют изменения по типу «матового стекла», инфильтраты в разных долях и интерстициальные изменения [29]. Диагноз COVID-19 подтверждается наличием положительной РНК SAR S-CoV-2 и появлением антител.
Как правило, при данной инфекции регистрируется лейкопения, лимфопения, тромбоцитопения, повышение С-реактивного белка (СРВ), ферритина, активности лактатдегидрогеназы (АДР), D-димера. Нарастание содержания D-димера может свидетельствовать о тромбозе глубоких вен, тромбоэмболии легочной артерии и является неблагоприятным прогностическим фактором [30].
Внелегочное присутствие АСЕ2 и TMPRSS2 обнаружено в железистых клетках эпителия желудка, энтеро- и колоноцитах, подоцитах, клетках проксимальных канальцев почек, холангиоцитах, которые следует рассматривать как вероятные мишени для SARS-CoV-2 [8].
Поражение печени при COVID-19
В ранее проведенных исследованиях было установлено, что SARS-CoV и MERS-CoV вызывают повреждение печени у инфицированных пациентов [31]. При COVID-19 также были обнаружены отклонения в функциональном состоянии печени, которые
ассоциировались с прогрессированием и тяжестью инфекционного процесса [32, 33].
Механизмы повреждения печени при COVID-2019 малоизучены. Среди возможных факторов повреждения рассматривается вирус-индуцированное влияние, системное воспаление («цитокиновый шторм»), гипоксия, гиповолемия, гипотония при шоке, лекарственная гепатотоксичность и др.
Было показано, что экспрессия АСЕ2 в холангиоци- тах намного выше, чем в гепатоцитах и сопоставима с уровнем экспрессии АСЕ2 в альвеолоцитах 2 типа [33]. Не исключается, что при COVID-19 повреждение печени определяется, прежде всего, повреждением холангиоцитов. В связи с этим можно выделить ряд проблем, которые требуют решения.
- Оказывает ли SARS-CoV-2 прямое цитопатическое действие на гепатоциты?
- Влияет ли SARS-CoV-2 на течение и исходы хронических заболеваний печени (ХЗП)?
- Какова роль лекарственной гепатотоксичности и межлекарственных взаимодействий при COVID-19?
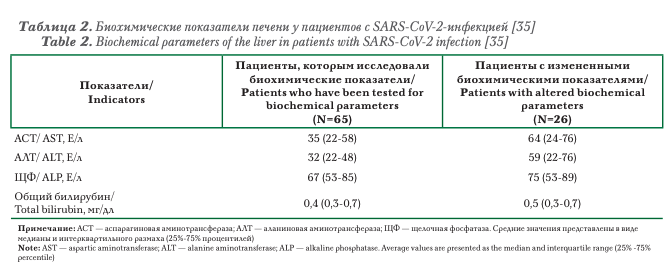
В опубликованных статьях, анализирующих состояние печени у китайских пациентов с COVID-19 из Уханя (Китайская народная республика), было показано, что у 14-53% из них регистрировались изменения биохимических показателей [31, 33, 34], в 2-11% случаев инфекция развивалась на фоне ХЗП [31]. Повышение активности АЛТ/АСТ (аланиновая и аспарагиновая аминотрансферазы), как правило, не превышало 1,5-2 норм от верхней границы нормы и сопровождалось незначительным увеличением содержания общего билирубина.
Сходные данные получены в исследовании Chol- ankeril G. с соавторами (2020), выполненными в Калифорнии. Анализируемую группу составили 116 пациентов с COVID-19; преобладали мужчины (53,4%) среднего возраста (50 лет), половина из которых — европеоиды (50,9%). В 2 случаях ранее диагностированы ХЗП. Наиболее распространенными признаками инфекции были кашель (94,8%), лихорадка (76,7%), одышка (58%), миалгии (52,2%). Средняя продолжительность симптомов составила 5 дней. У 31,9% пациентов в дебюте заболевания наблюдались нетипичные для COVID-19 гастроинтестинальные симптомы: потери аппетита (22,3%), тошнота/рвота (12%) и диарея (12,0%). В 26/65 случаях выявлены изменения биохимических показателей, которые не потребовали лекарственной коррекции (табл. 2).
Доля повреждения печени у пациентов с тяжелой формой COVID-19 была значительно выше, чем у пациентов с легкой степенью тяжести. Однако фатальная печеночная недостаточность не наблюдалась даже при критических состояниях и летальных исходах заболевания [32, 33, 35]. Но в ряде случаев было отмечено нарушение белково-синтетической функции — уровень альбумина снижался до 30,9- 26,3 г/л [36].
При аутопсии пациентов с COVID-19 печень темно-красная, увеличена; желчный пузырь больших размеров. При микроскопическом исследовании выявляются микровезикулярный стеатоз, очаговый некроз гепатоцитов, преобладание нейтрофилов в лобулярных и портальных инфильтратах, микро- тромбы в синусоидах [13]. Между тем описанные гистологические изменения в большей степени могут быть обусловлены лекарственным повреждением печени, а не SARS-CoV-2 [31].
С помощью молекулярно-генетических методов исследования геном SARS-CoV был обнаружен не только в ткани легких, но и в паренхиматозных клетках, эндотелии сосудов других органов, в том числе и в гепатоцитах [33]. РНК SARS-CoV выявляли в фекалиях, что объясняет появление гастроинтестинальных симптомов при передаче вируса фекально-оральным путем [37]. Вместе с тем его длительное обнаружение в фекалиях после клинического выздоровления (до 11 дней) [38] не исключает возможный рецидив заболевания [39, 40]. Остаются неясными причины, а также возможная роль вирулентности и изменчивости вируса в случаях продолжающейся репликации SARS-CoV.
Острый гепатит у пациентов с COVID-19
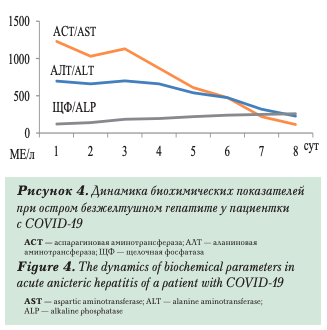
Описаны редкие случаи острого гепатита. Wander Р. et al. (2020) наблюдали 59-летнюю пациентку с ВИЧ-инфекцией и метаболическим синдромом, по поводу которых она получала эти- онатогенетическую терапию с хорошим эффектом. Накануне при исследовании биохимических показателей крови отклонений выявлено не было. Эпидемиологический анамнез без особенностей. Госпитализирована для обследования как ВИЧ- инфицированная пациентка с единственной жалобой на темную мочу. Изменений при физикальном обследовании не выявлено. При лабораторном исследовании установлена значительная гиперферментемия (АЛТ — 697 МЕ/л; АСТ- 1230 МЕ/л) при нормальном уровне билирубина, гиперферритинемия (6606 нг/мл), снижение альбумина (до 31 г/л). Маркеры инфицирования вирусами гепатитов А, В, С, Эпштейна-Барр, цитомегаловируса и респираторных вирусов не обнаружены. На второй день госпитализации у пациентки появилась лихорадка (39° С), снижение сатурации (94%) и по данным рентгенологического исследования диагностирована двухсторонняя интерстициальная пневмония. Начата кислоро- дотерапия и с 4-го дня госпитализации назначен 5-дневный курс гидроксихлорохина в дозе 200 мг без прекращения приема ранее принимаемых препаратов. Мазки из носоглотки выявили РНК SARS-CoV. На 8-е сутки в удовлетворительном состоянии пациентка выписана домой (ACT — 114 МЕ/л, АЛТ — 227 МЕ/л, ЩФ — 259 МЕ/л, альбумин — 28 г/л). Поскольку все другие причины острого безжелтушного гепатита были исключены, представляется весьма вероятным, что он был вызван SARS-CoV (рис. 4).
Хронические заболевания печени и COVID-19
Анализ клинической картины COVID-19 показал отсутствие значимого влияния SARS-CoV на течение ХЗП. Пациенты с вирусной этиологией ХЗП были более склонны к развитию повреждения печени, что, вероятно, связано с усилением репликации вирусов гепатитов В и С во время SARS-CoV-инфекции [42]. Иммуносупрессивные препараты, применяемые при аутоиммунных заболеваниях печени, могут, повидимому, оказывать некоторый защитный эффект от иммунопатологических процессов, которые вызывают повреждение легких в случаях тяжелого течения COVID-19 [43].
Пациенты с неалкогольным стеато гепатитом (ПАСЕ), ассоциированным с сопутствующими заболеваниями (диабетом, артериальной гипертонией, сердечно-сосудистыми нарушениями), подвержены высокому риску заражения SARS-CoV и развитию тяжелой формы COVID-19 [44].
Кроме того, к группе риска относятся больные, перенесшие трансплантацию печени и получающие иммуносупрессанты, пациенты с циррозом печени, наличием острой печеночной недостаточности на фоне хронической, гепатоцеллюлярной карциномой, иммунодефицитным состоянием [42,45,46]. Международные и российские научные сообщества разрабатывают постоянно обновляющиеся руководства по лечению COVID-19 [15,16, 47]. Борьба с глобальной пандемией должна включать обмен и открытый доступ к научным данным и новым технологиям. Недавно Европейское общество по изучению печени активно поддержало проект COVID-Hep, который был запущен Оксфордским университетом и представляет собой создание реестра для сбора данных о пациентах с заболеваниями печени на любой стадии или трансплантации печени с наличием COVID-19 (информацию о регистре можно найти по ссылке: http://covid-hep.net).
Лекарственная гепатотоксичность и межлекарственные взаимодействия при COVID-19
Одна из важных функций печени — детоксикация лекарственных средств. А применяемые методы, включающие гидроксихлорохин, антибиотики и противовирусные препараты, могут усилить повреждение печени вследствие потенциальной гепатотоксичности.
Так, в отчете из Бразилии, подготовленном Falcao М.В. et al., (2020), описана пациентка с пневмонией, вызванной SARS-CoV. После приема двух доз (800 мг) гидроксихлорохина отмечено 10-кратное увеличение активности аминотрансфераз и их снижение до нормального уровня после прекращения приема препарата. Авторы предположили, что применение более высоких доз гидроксихлорохина может приводить к лекарственному повреждению печени при COVTD-19.
Гепатотоксичность, вызванная гидроксихлорохином, наблюдается редко. Описаны случаи повреждения печени при приеме терапевтических доз гидроксихлорохина у пациентов с системной красной волчанкой, поздней кожной порфирией, болезнью Стила [49, 50].
Механизмы повреждения печени, связанные с гидроксихлорохином, изучены недостаточно. Гепатотоксичность может быть обусловлена воздействием метаболитов, окислительным стрессом, токсическими или синергетическими эффектами, связанными с воспалительными процессами [51].
Кроме того, у пациентов с COVID-19 под влиянием гидроксихлорохина может наблюдаться удлинение интервала QT вследствие блокады калиевых каналов, усиливающееся при сочетании с приемом антибиотиков (в частности, азитромицина) [52]. Выявленные неблагоприятные признаки требуют мониторинга функций печени и электрокардиографии, особенно среди групп риска — пациентов с ХЗП и нарушениями реполяризации миокарда.
Масштаб в использовании экспериментальных методов лечения для COVID-19 является беспрецедентным. Однако еще предстоит установить доказательства их эффективности. В связи с этим для клинической практики остается очень важным вопрос по межлекарственному взаимодействию. На сайте Ливерпульского университета (Великобритания) (www.covidl9-druginteractions.org) представлены основные экспериментальные препараты, которые на сегодня используются в терапии COVID-19 с указанием их механизмов действия; дана оценка совместного применения с другими средствами с учетом рисков и преимуществ, длительности применения, состояния пациента, приема лекарств по поводу ранее установленных заболеваний [53].
Заключение
На момент написания этой статьи в мире зарегистрировано свыше 3,5 млн. случаев заболевания COVID-19, в результате которого погибло более 250 000 человек [54].
К сожалению, в настоящее время не существует эффективных специфических методов лечения COVID-19 [55]. Проводятся многочисленные клинические рандомизированные исследования различных препаратов.
Пока отсутствуют доказательства того, что пациенты, выздоровевшие от COVID-19, защищены от повторной инфекции [56]. Необходим мониторинг лиц с антителами против SARS-CoV-2 в сравнении с лицами без них с оценкой частоты инфицирования SARS-CoV-2 и развития COVID-19 в течение длительного периода (не менее одного года).
Однако первый экспериментальный опыт применения плазмы, содержащей антитела иммуноглобулинов класса G больных, перенесших COVID-19, продемонстрировал обнадеживающие результаты [57].
Выздоровевшие пациенты от COVID-19 и лица с бессимптомным течением, выделяющие вирус с фекалиями, могут рассматриваться как возможный источник инфекции. Кроме того, поскольку РНК SARS-CoV-2 была обнаружена в образцах сточных вод, остается нерешенным вопрос о жизнеспособности вируса в условиях окружающей среды, через которую также может быть реализован фекально-оральный путь передачи [58]. Вопрос о возможности развития второй вспышки, реактивации или новой волны SARS-CoV-2-инфекции остается открытым.
Со времени объявления пандемии интенсивно начаты разработки вакцин. Известно о 115 кандидатах в вакцины, 78 из которых находятся на разных стадиях клинических исследований [59].
Для сдерживания распространения SARS-CoV-2 и COVID-19 по-прежнему требуются ограничительные меры. Для всех стран мира пандемия имеет далеко идущие медико-социальные и экономические последствия («коронакризис»). Сегодня профессиональные и личные действия каждого из нас должны быть направлены на борьбу с этой угрозой.
Вклад авторов
Все авторы внесли существенный вклад в подготовку и написание статьи, прочли и одобрили финальную версию перед публикацией Л.Ю. Ильченко (ORCID ID: https://orcid.Org/0000-0001-6029- 1864): написание и редактирование текста
И Г. Никитин (ORCID 1D: https://orcid.oig/0000-0003-1699-0881): утверждение финального варианта статьи;
И.Г. Федоров(ORCID ID: https://ordd.org/0000-0003-1003-539X):
поиск литературных источников и редактирование текста
Список литературы / References:
- Corona Resource Centre. [Electronic resource], URL: https://coronavirus.jhu.edu/map.html (date of the application: 15.04.2020)
- Cuarner J. Three Emerging Coronaviruses in Two Decades The Story of SARS, MERS, and Now COVID-19. Clin. Pathol. 2020; 153:420-1. doi: 10.1093/AJCP/AQAA029
- Lu R., Zhao X., Li J. et aL Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. 2020;395(10224):565-74; doi: 10.1016/50140-6736(20)30251-8
- Chen N., Zhou M., DongX. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. 2020; 395(10224):507-13. doi: 10.1016/50140-6736(20)30211-7.
- Li X., Geng M., Peng Y. et al. Molecular immune pathogenesis and diagnosis of COVID-19. Pharmaceutical. Analysis. 2020;10(2):102-8. doi: 10.1016/j.jpha.2020.03.001.
- Rothan H.A., Byrareddy S.N. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. Autoimmun. 2020; 109:102433. doi: 10.1016/j.jaut.2020.102433.
- Xu Z., Shi L., Wang Y. et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 2020;8(4):420-2. doi: 10.1016/52213- 2600(20)30076-X.
- Tai W, He L., Zhang X. et al. Characterization of the receptorbinding domain (RBD) of 2019 novel coronavirus: implication for development of RBD protein as a viral attachment inhibitor and vaccine. Mol. Immunol. 2020; doi: 10.1038/s41423 020- 0400-4.
- Liu W., Li H. COVID-19: Attacks the 1-Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism. 2020. [Electronic resource], URL: https://pan.baidu.com/s/1v8kP0zAyvnACXm-vJHWJuQ (date of the application: 20.04.2020)
- Mehta P., McAuley D.F., Brown M. et al. COVID-19: consider cytokine storm syndromes and immunosuppression. 2020; 395(10229):1033-1034. doi: 10.1016/50140- 6736(20)30628-0.
- Arachchillage D.R.J., Laffan M. Abnormal Coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia J. Thromb. 2020;18(5):1233-4. doi: 10.1111/jth,14820. doi: 10.1111/jth,14768.
- Xu X., Barth R.F., Buja L.M. A call to action: the need for autopsies to determine the full extent of organ involvement associated with COVID-19 infections. 2020. doi: 10.1016/j.chest.2020.03.060.
- Hanley B., Lucas S.B., Youd E. et al. Autopsy in suspected COVID-19 cases. Clin. Pathol. 2020;73(5):239-42. doi: 10.1136/jclinpath-2020-206522.
- The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19). China CCDC Weekly. 2020; 2:113-22. doi: 10.3760/cma.j.is sn.0254-6450.2020.02.003.
- Sorbello M., El-Boghdadly K., Di Giacinto I. et al. The Italian coronavirus disease 2019 outbreak: recommendations from clinical practice. 2020. doi:10.1111/anae,15049.
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» Версия 6 (28.04.2020). Министерство здравоохранения Российской Федерации. 142 с. Ministry of Health of the Russian Federation. Temporary guidelines «Prevention, diagnosis and treatment of new coronavirus infection (COVID-19)», version 6 (28.04.20).
- Guo Y.R, Cao Q.D., Hong Z.S. et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak —an update on the status. Res. 2020;7(1):11. doi: 10.1186/S40779-020-00240-0.
- Отчет о совместной технической миссии ВОЗ и Китайской Народной Республики (КНР) по проблеме новой коронавирусной инфекции COVID-2019. [Электронный ресурс]. URL: https://www.rosminzdrav.ru/news/2020/03/03/13469-predstavlen-otchet-o-rabote-mezhdunarodnoy-missii-voz-po-probleme-covid-19 (дата обращения: 22.04.2020) Report on the joint technical mission of WHO and the People’s Republic of China (PRC) on the problem of the new coronavirus infection COVID-2019. [Electronic resource], URL: https://www.rosminzdrav.ru/news/2020/03/03/13469-predstavlen-otchet-o-rabote-mezhdunarodnoy-missii-voz-po-probleme-covid-19 (date of the application: 22.04.2020). [in Russian],
- Chow E.J., Schwartz N.G., Tobolowsky F A. Symptom Screening at Illness Onset of Health Care Personnel With SARS-CoV-2 Infection in King County, Washington. JAMA. 2020. doi: 10.1001/jama.2020.6637.
- Eliezer M., Hautefort Ch., Hamel A-L. et al. Sudden and Complete Olfactory Loss Function as a Possible Symptom of COVID-19. Otolaryngol. Head Neck. Surg. 2020. doi:10.1001/jamaoto.2020.0832
- Xydakis M.S., Dehgani-Mobaraki P., Holbrook E.H. et al. Smell and taste dysfunction in patients with COVID-19. Lancet Infect. Dis. 2020; 20(4): eSO. doi: 10.1016/51473-3099(20)30293 0.
- Oxley T.J., Mocco J., Majid! 5. et al. Large-Vessel Stroke as a Presenting Feature of Covid-19 in the Young. 2020. doi: 10.1056/NEJMC2009787.
- Helms J., KremerS., Merdji H. et al. Neurologic Features in Severe SARS-CoV-2 Infection. 2020. doi: 10.1056/NEJMC2008597.
- Cheema M., Aghazadeh H., Nazarali 5. et al. Keratoconjunctivitis as the Initial Medical Presentation of the Novel Coronavirus Disease 2019 (COVID-19). J. Ophthalmol. 2020. pii: 50008-4182(20)30305-7. doi: 10.1016/j. jcjo.2020.03.003.
- Kim D., Quinn J., Pinsky B. et al. Rates of Co-infection Between SARS-CoV-2 and Other Respiratory Pathogens. 2020. doi: https://jamanetwork.com/on04/15/2020.
- Recalcati 5. Cutaneous manifestations in COVID-19: a first perspective. J. Eur. Acad. Dermatol. VenereoL 2020. doi: 10.1111/JDV.16387.
- Casas C.G., Catalä А., Hernändez, G.C. et al. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. J. Dermatol. 2020. doi: 10.1111/BJD.19163
- Cheema M., Aghazadeh H., Solarte C. et al. Keratoconjunctivitis as the initial medical presentation of the novel coronavirus disease 2019 (COVID-19). Canadian Journal of Ophthalmology. DOI: 10.1016/j. jcjo.2020.03.003 Corpus ID: 214758418 [Electronic resource], URL: https://www.canadianjournalofophthalmology.ca/article/S0008-4182(20)30305-7/pdf (date of issue: 29.04.2020)
- Морозов С.П., Проценко Д.Н., Сметанина C.B. и др. Лучевая диагностика коронавирусной болезни (COVID-19): организация, методология, интерпретация результатов: препринт № ЦДТ — 2020 — I. М.: ГБУЗ «НПКЦ ДиТ ДЗМ», 2020; 60 с.
- Morozov S.P., Protsenko D.N., Smetanina S.V. et al. Radiation diagnosis of coronary viral disease (COVID-19): organization, methodology, interpretation of results: preprint № ЦДТ— 2020 — I. M.: ГБУЗ «НПКЦДиТ ДЗМ», 2020; 60 p. [in Russian],
- Lippi C., Favaloro E.J. D-dimer is Associated with Severity of Coronavirus Disease 2019: A Pooled Analysis. J. Thromb. Haemost. 2020. doi: 10.1055/S-0040-1709650.
- Xu L., Liu J., Lu M. et al. Liver injury during highly pathogenic human coronavirus infections. Liver I nt. 2020;40(5):998-1004. doi: 10.1111/ІІѴ.14435.
- Guan W-J., Ni Z-Y., Hu Y. et al. Clinical characteristics of 2019 novel coronavirus infection in China. N Engl J Med. 2020;382:1708-20. doi: 10.1056/NEJMoa2002032.
- Zhang C., Shi L., Wang F.S. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol. Hepatol. 2020. doi: 10.1016/52468-1253(20)30057-1.
- Young B.E., Ong SW. X., Kalimuddin S. et al. Epidemiologic features and clinical course of patients infected with SARS-CoV-2 in Singapore. JAMA. 2020; 323(15): 1488-94. doi: 10.1001/jama.2020.3204pmid:http://www.ncbi.nlm.nih. gov/pubmed/32125362.
- , Podboy A., Aivaliotis V.l. et al. High Prevalence of Concurrent Gastrointestinal Manifestations in Patients with SARS-CoV-2: Early Experience from California. Gastroenterology. 2020,doi: 10.1053/j.gastro.2020.04.008.
- Chen N., Zhou N., Dong X. et al. Epidemiological and Clinical Characteristics of 99 Cases of 2019 Novel Coronavirus Pneumonia in Wuhan, China: A Descriptive Study. 2020;395(10223):507-13. doi: 10.1016/50140-6736(20)30211-7.
- Lin L., Jiang X., Zhang Z. et al. Gastrointestinal symptoms of 95 cases with SARS- CoV-2 infection. 2020; pii: gutjnl-2020-321013. doi:10.1136/gutjnl-2020-321013
- Wu Y, Guo C., Tang L. et al. Prolonged presence of SARS-CoV-2 viral RNA in faecal samples. Gastroenterol. Hepatol. 2020; 5(5): 434-435. doi: 10.1016/52468-1253(20)30083-2
- Gu J., Han B., Wang J. COVID-19: Gastrointestinal manifestations and potential fecal-oral transmission. 2020; 158(6): 1518-9. doi: 10.1053/j.gastro.2020.02.054.
- Xiao F., Tang M., Zheng X. et al. Evidence for gastrointestinal infection of SARS- CoV-2. Gastroenterology. 2020;158(6):1831- 1833. doi: 10.1053/j, gastro.2020.02.055.
- Wander P., Epstein M., Bernstein D. COVID-19 presenting as acute hepatitis. Gastroenterol. 2020. doi:10.14309/ajg,0000000000000660.
- , Newsome P.N., Mondelli M.U. et. al. Care of patients with liver disease during the COVID-19 pandemic: EASL- ESCMID position paper, JHEP Reports. 2020. doi: org/10.1016/j. jhepr.2020.100113.
- Lleo A., Invernizzi P., Lohse A W. et al. Highlights for management of patients with Autoimmune Liver Disease during COVID-19 pandemia. Hepat. 2020. pii: 50168-8278(20)30212- 9. doi: 10.1016/j.jhep.2020.04.< 2.
- Ji D., Enqiang Qin E., Xu J. et al. Non-alcoholic fatty liver diseases in patients with COVID-19: A retrospective study. Journal of Hepatology. 2020. doi: https://doi.Org/10.1016/j.jhep.2020.03.044.
- Tapper E.B., As rani S.K. The COVID-19 pandemic will have a long- lasting impact on the quality of cirrhosis care. Hepatol. 2020; pii: 50168-8278(20)30217-8. doi: 10.1016/j.jhep.2020.04.005.
- Saigal 5., Gupta 5., Sudhindran 5. et al. Guidelines: Liver transplantation and COVID-19 (Coronavirus) infection: guidelines of the liver transplant Society of India (LTSI). I nt. 2020. doi: 10.1007/s12072-020-10041-1.
- Bhimraj A.,Morgan R.L., Shumaker A.H. et al. Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients With COVID-19. Infect. Dis. 2020; pii: 5825667. doi: 10.1093/cid/ciaa478.
- Falcao M B., de Göes Cavalcanti L.P., Filho N.M. F. et al. Case Report: Hepatotoxicity Associated With the Use of Hydroxychloroquine in a Patient With Novel Coronavirus Disease (COVID-19). Trap. Med. Hyg. 2020 doi: 10.4269/ajtmh.20-0276.
- Sunkara B., Roofeh D., Silver S. et al. The devil’s in the dosing: severe drug-induced liver injury in a hydroxychloroquinenaive patient with subacute cutaneous lupus erythematosus and porphyria cutanea tarda. 2018;27(8):1383-6. doi: 10.1177/0961203318768884.
- Makin A.J., Wendon J., Fitt S. et al. Fulminant hepatic failure secondary to hydroxychloroquine. 1994;35(4):569-70. doi: 10.1136/gut.35.4.569.
- Wei C.H., Penunuri A., Karpouzas G. Troxis necrosis, a novel mechanism fordruginduced hepatitis secondary to immunomodulatory therapy. Exp. Mol. Pathol. 2015;99(2):341—3. doi: 10.1016/j.yexmp.2015.08.006.
- van den BroekM.P. H., Möhlmann J.E., Abeln B.G. S. et al. Chloroquine-induced QTc prolongation in COVID-19 patients. Heart. J. 2020. doi: https://doi.org/10.1007/s12471-020- 01429-7.
- Evaluating the drug-drug interaction risk of experimental COVID-19 therapies. [Electronic resource], URL: https://www. covid19-druginteractions.org (date of the application: 30.04.2020)
- Короновирус в России и в мире. [Electronic resource], URL: https://www.5-tv.ru/news/294861/koronavirus-vrossii-imire-aktualnye-dannye-na4maa/?utm_source=yxnews&utm_medium=desktop&utm_referrer=https%3A%2F%2Fyandex.ru%2Fnews (date of the application: 04.05.2020) [In Russian]
- Sanders J.M., Monogue M.L., JodlowskT.Z. et al. Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19) A Review. 2020. doi: https://jamanetwork.com/on05/01/2020.
- Developing antibody tests for SARS-CoV-2. Lancet. 2020;395(10230):1101-2. doi: 10.1016/50140-6736(20)30788-1.
- Roback J.D., Guarner J. Convalescent Plasma to Treat COVID-19 Possibilities and Challenges. 202(i doi: 10.1001/jama.2020.4940
- Lodder W., de Roda Husman A M. SARS-CoV-2 in wastewater: potential health risk, but also data source. Lancet Gastroenterol. Hepatol. 2020. doi: https://doi.org/10.1016/52468- 1253(20)30087-X.
- Разработка вакцин. Медвестник. [Электронный ресурс]. URL: medvestnik.ru>chronicles/Razrabotka-vakcin.html (дата обращения: 01.05.2020) Vaccine development. Medvestnik. [Electronic resource], URL: medvestnik.ru>chronicles/Razrabotka-vakcin.html (date of the application: 01.05.2020)





