Эрадикационная терапия инфекции Helicobacter pylori: обзор мировых тенденций


Опубликована Март 1, 2014
Последнее обновление статьи Ноя. 22, 2022
Аннотация
В обзоре литературе представлены современные взгляды на лечение инфекции Helicobacter pylori. Рост антибиотикорезистентности H. pylori в первое десятилетие XXI века повлек за собой снижение эффективности распространенных схем эрадикационной терапии (ЭТ), определяя повышенный интерес к данной проблеме. В статье суммированы и проанализированы данные об эффективности современных схем ЭТ в различных регионах мира за последние 3 года. Рассматриваются перспективы альтернативных схем ЭТ. Приводятся существующие и перспективные пути оптимизации современных схем ЭТ.
Ключевые слова
Четырехкомпонентная терапия, трехкомпонентная терапия, последовательная терапия, Helicobacter pylori, эраликаиия, антибиотикорезистентность, ингибиторы протонного насоса
ДИ — доверительный интервал
ИПН — ингибитор протонного насоса ТКТ — трехкомпонентная терапия
ЧКТ — четырехкомпонентная терапия ЭТ — эрадикационная терапия
Инфекция Helicobacter pylori (Н. pylori) — одна из наиболее распространенных в настоящее время у человека. Более 3 млрд жителей Земли инфицированы данным микроорганизмом [1,2]. Клиническая значимость Н. pylori определяется ее ведущей ролью в формировании хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, МАТТ-лимфомы, а также аденокарциномы желудка [1, 3]. Кроме того, уже существует достоверные данные относительно ассоциации инфекции Н. pylori с идиопатической железодефицитной анемией и идиопатической тромбоцитопенической пурпурой [4, 5].
С момента открытия этиопатогенетической роли Н. pylori в развитии гастродуоденальной патологии, эрадикационная терапия (ЭТ) при инфекции рассматривается как основной метод лечения и профилактики ассоциированных с Н. pylori заболеваний, что отражено в ряде международных и национальных согласительных документов [6, 7]. При этом, несмотря на существенный пройденный период, аспекты лечения инфекции продолжают активно исследоваться. Во многом это определено отсутствием идеальной схемы ЭТ, позволяющей обеспечить стабильно максимальный успех элиминации микроорганизма у всех больных. В свою очередь широко применяемые схемы ЭТ характеризуются нестабильностью результатов и тенденцией к снижению эффективности, которая коррелирует с ростом антибиотикорезистентности микроорганизма в мире [8].
Антибиотикорезистентность H. pylori.
В настоящее время антибиотикорезистентность H. pylori рассматривается как главный фактор, определяющий эффективность той или иной схемы ЭТ [6, 9, 10]. Таким образом, популяционный уровень резистентности является основополагающим для выбора схемы ЭТ, что находит свое отражение в IV Международном Маастрихтском соглашении (2010), регламентирующем стандарты диагностики и лечения инфекции H. pylori [6].
По данным литературы, распространенность устойчивых штаммов Н. pylori увеличивается во всем мире [9, 11, 12]. Стоит отметить, что в современной Европе за последние десятилетия потоки миграции населения внесли свои изменения в общей карте антибиотикорезистентности как внутри страны, так и внутри отдельных городов [13]. При этом показатели распространенности варьируют в разных географических зонах, коррелируя с общей частотой применения антибиотиков в популяции [11].
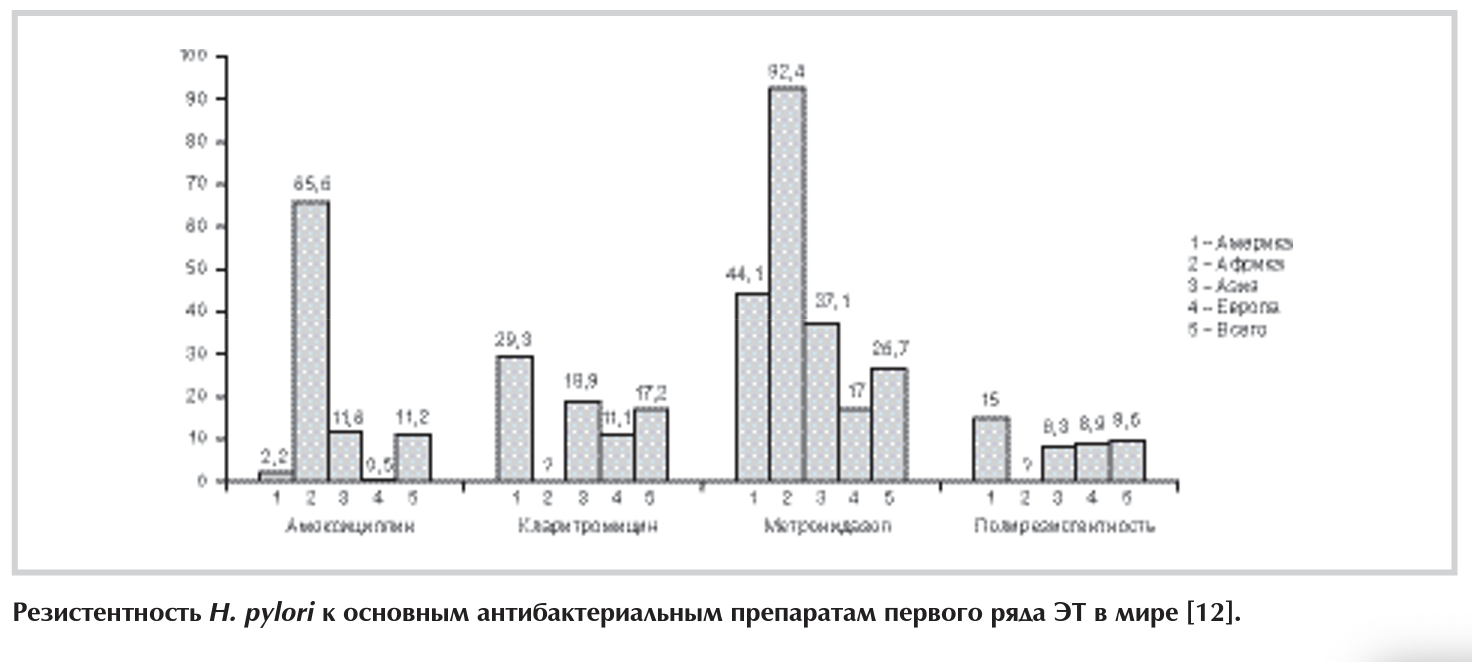
Резистентность Н. pylori к базовым антибиотикам, используемым в схемах первого ряда ЭТ, имеет наиболее высокую клиническую значимость. Согласно данным систематического обзора V. De Francesco и соавт. [12] проблема резистентности наиболее остро стоит по отношению к метронидазолу и кларитромицину, в то время как резистентность к амоксициллину остается на низком уровне в большинстве регионов мира (см. рисунок) [12]. В свою очередь большинством исследователей отмечено, что резистентность к кларитромицину имеет более высокую клиническую значимость по сравнению с резистентностью к метронидазолу [14].
Тенденция к росту резистентности Н. pylori к кларитромицину четко прослеживается в странах Европы. Так, общая резистентность к кларитромицину в этой части света увеличилась с 9% (1998 г.) до 17,6% (2008-2009 гг.) [12, 15, 16]. В Российской Федерации реальный уровень резистентности Н. pylori к кларитромицину неизвестен, 10 лет назад он приближался, но не превышал рубеж 20% [17].
Резистентность Н. pylori к производным нитроимидазола (метронидазол и тинидазол) имеет довольно широкие географические границы. Наиболее высокие показатели резистентности выявлены в странах Африки — 92,4% (при 95% доверительном интервале — ДИ от 88,4 до 96,3%), а низкие в Европе — 17% (при 95% ДИ от 15,5 до 18,5%) [12]. В Российской Федерации показатели резистентности к метронидазолу, по данным Российской группы по изучению Н. pylori, стабилизировались в 2001 г. на высоком уровне 55% [17].
До сих пор в мире не идентифицировано роста резистентности Н. pylori к амоксициллину, что оставляет его наиболее важным элементом в схемах ЭТ [12,14].
Последовательность схем ЭТ в рамках IV Маастрихтского соглашения.
В соответствии с IV Маастрихтским соглашением основное внимание при выборе схемы должно быть обращено на данные о распространенности резистентных штаммов Н. pylori к кларитромицину в регионе, так как рост резистентности микроорганизма к данному антибиотику напрямую связывают со снижением эффективности стандартных схем ЭТ [6, 12, 14, 18]. Базисными начальными схемами ЭТ являются протоколы первого ряда, в случае их неэффективности регламентируется переход на схемы второго ряда без определения антибиотикорезистентности (см. таблицу) [6,18].
ЭТ первого ряда. Трехкомпонентная терапия (ТКТ).
В регионах с низкой резистентностью Н. pylori к кларитромицину (менее 20%) в качестве ЭТ первого ряда регламентируется ТКТ, включающая ИПН, кларитромицин и амоксициллин/метронидазол. При этом замена амоксициллина метронидазолом не дает преимуществ, так как эффективность указанных антибиотиков в схемах ТКТ рассматривается как эквивалентная [6, 7, 18]. Однако высокий уровень устойчивости к метронидазолу делает необоснованным широкое применение данного препарата в схемах ТКТ в России. Тем не менее ТКТ с метронидазолом может использоваться у пациентов с аллергией на производные пенициллина в регионах с низким уровнем резистентности Н. pylori к кларитромицину [6,10].
Схема ТКТ остается одной из самых востребованных во всем мире. Однако за последнее десятилетие эффективность данной схемы резко снизилась, и в регионах с высокой распространенностью резистентных к кларитромицину штаммов в популяции ее эффективность редко превышает 80% [9,19, 20].
Тем не менее в ряде последних исследований отмечается достаточный уровень эрадикации при применении ТКТ. Так, по данным J. Gisbert и соавт. [21], эффективность ТКТ в Испании за 10 лет (1997—2008) не снизилась и составила 80%. В Южной Корее в одноцентровом ретроспективном исследовании J. Yoon и соавт. [22] не выявлено отрицательной динамики эффективности 14-дневной ТКТ на протяжении 10 лет (2000—2010). Эффективность данной схемы варьировала от 83,3 до 90,5%. В многоцентровом исследовании, выполненном в Японии (2012), также получены данные о достаточной эффективности 7-дневного курса ТКТ, которая составила 80,7%, при этом частота побочных явлений оказалась на минимальном уровне (4,4%) [23]. В целом эти данные подтверждают актуальность широкого применения трехкомпонентной схемы ЭТ во многих частях света.
Четырехкомпонентная терапия (ЧКТ) на основе препаратов висмута. ЧКТ на основе препаратов висмута (ИПН + метронидазол + тетрациклин + висмута трикалия дицитрат) рекомендуется в регионах с высокой резистентностью Н. pylori к кларитромицину (более 20%) в качестве ЭТ первого ряда. Данная схема также целесообразна для применения в качестве альтернативы ТКТ в регионах с низкой распространенностью резистентных к кларитромицину штаммов, а также у пациентов с аллергией на производные пенициллина [6,10,18].
В исследовании М. Dore и соавт. [24] ЧКТ на основе препаратов висмута оказалась высокоэффективной: 95 и 94% для 14- и 10-дневного протокола соответственно. В Китае, по данным М. Хи и соавт. [25], 7-дневная ЧКТ с препаратом висмута была на 15% эффективней аналогичной по длительности ТКТ. Тем не менее стоит отметить, что оптимальная длительность этого протокола ЭТ не определена и, скорее всего, индивидуальна для различных регионов мира, хотя наиболее исследованными являются 10- и 14-дневная схема [8].
ЧКТ без препаратов висмута. В ряде стран, например во Франции, препараты висмута запрещены, поэтому как альтернативу ЭТ первого ряда в регионах с высокой резистентностью Н. pylori к кларитромицину стоит рассматривать ЧКТ, не содержащую препаратов висмута (ИПН + кларитромицин + амоксициллин + метронидазол) [6]. По мнению ряда авторов, данный протокол ЭТ является одним из наиболее многообещающих в контексте роста антибиогикорезистентности [8, 26, 27]. Недавно выполненный J.P. Gisbert и соавт. [27] метаанализ, объединяющий данные 19 исследований (2090 пациентов), продемонстрировал высокую эффективность этой схемы на уровне 88%. В исследовании, проведенном в Японии (2012), эффективность 7-дневной ЧКТ без препаратов висмута составила 94,9% по сравнению с 68,3% 7-днев- ной ТКТ. При этом частота возникновения побочных эффектов достоверно не различалась между этими схемами [28].

Последовательная терапия.
В настоящее время последовательная ЭТ (первые 5 дней ИПН + амоксициллин, последующие 5 дней ИПН + кларитромицин + тинидазол/метронидазол) — одна из наиболее изучаемых схем ЭТ во всем мире. Во многом такой интерес мировой медицинской общественности продиктован высокой эффективностью последовательной терапии [8, 10, 18]. В рамках IV Маастрихтского соглашения данный протокол ЭТ регламентируется в качестве альтернативной схемы первого ряда в регионах с высокой резистентностью Н. pylori к кларитромицину [6].
В серии клинических исследований, проведенных в Италии и Испании (2003—2007), в каждое из которых входили не менее 100 пациентов, последовательная ЭТ дала очень многообещающие результаты с уровнем эрадикации от 91 до 95% [29—31]. По результатам более современных исследований, эффективность последовательной терапии доказана во многих регионах мира. Так, в Израиле в исследовании Н. Schmilovit.z-Weiss и соавт. [32] эффективность последовательной терапии составила 95,8%. В Южной Корее в исследовании Y. Kim и соавт. [33] эффективность 10-дневной последовательной терапии составила 92,6% по сравнению с 85% 14-дневной ТКТ без различий по частоте побочных явлений. Сходные данные получены в Тайване в исследовании F. Tsay и соавт. [34], в котором эффективность последовательной терапии была на 13% выше ТКТ с сопоставимой частотой побочных явлений. Эти результаты подтверждаются недавним систематическим обзором V. Kate и соавт. [35], в рамках которого анализировались результаты 17 рандомизированных контролированных исследований по сравнению эффективности последовательной и трехкомпонентной схемы ЭТ. Так, более высокая эффективность последовательной терапии отмечена в 12 исследованиях, в 4 не выявлено достоверных различий между двумя протоколами, и только в 1 исследовании ТКТ была эффективнее последовательной [35].
ЭТ второго ряда. ЧКТна основе препаратов висмута.
Для регионов с низкой распространенностью резистентных к кларитромицину штаммов Н. pylori терапией второго ряда согласно IV Маастрихтскому соглашению при неэффективности ТКТ первого ряда является ЧКТ на основе препаратов висмута [6]. Стоит отметить, что в качестве терапии второго ряда данная схема неэффективна в 5—63% случаев [36, 37]. Низкие результаты могут быть обусловлены высокой распространенностью резистентных штаммов к метронидазолу, а также коротким курсом терапии (7 дней) [38]. В связи с этим рекомендуется учитывать последние факторы при назначении данной схемы в качестве ЭТ второго ряда.
ТКТ с левофлоксацином. В регионах с высокой распространенностью резистентных к кларитромицину штаммов Н. pylori, согласно IV Маастрихтскому соглашению терапией второго ряда при неэффективности ЧКТ первого ряда является ТКТ с левофлоксацином (ИПН + амоксициллин + левофлоксацин) [6,18].
Стоит отметить, что ТКТ с левофлоксацином достаточно эффективна и при использовании в качестве терапии первого ряда [8, 10]. Так, по данным М. Berning и соавт. [39], этот протокол обеспечивает эффективную эрадикацию в 72—96% случаев. Однако экспертный совет IV Маастрихтского соглашения предостерегает использовать ТКТ с левофлоксацином в качестве терапии первого ряда с учетом растущего уровня резистентности к левофлоксацину, который в будущем может поставить под угрозу эффективность данного протокола [6].
Использование ТКТ с левофлоксацином в качестве ЭТ второго ряда демонстрирует обнадеживающие результаты. Так, по данным в метаанализа J. Gisbert и соавт. [40], данный протокол обеспечивает более высокий уровень эрадикации по сравнению с ЧКТ на основе препаратов висмута (81 и 70% соответственно) после неэффективности схемы классической ТКТ. Два рандомизированных контролируемых исследования в Тайване (2006) и Гонконге (2009) показали, что ТКТ с левофлоксацином сопоставима по эффективности с ЧКТ на основе препаратов висмута при применении в качестве ЭТ второго ряда [41,42].
Вместо левофлоксацина в схеме трехкомпонентной ЭТ теоретически могут быть использованы и другие фторхинолоны. Так, в исследовании 8. Miehlke и соавт. [43] применение ТКТ с моксифлоксацином в качестве терапии второго ряда позволило добиться 78,9 и 95% эффективности при 7- и 14-дневных курсах соответственно.
ЭТ третьего ряда.
В настоящее время в европейских рекомендациях отсутствуют стандартные схемы терапии в случае неэффективности ЭТ второго ряда [38]. Согласно документам IV Маастрихтского соглашения рекомендуется выбор терапии на основании определения индивидуальной чувствительности Н. pylori к антибиотикам [6]. Тем не менее методы определения чувствительности микроорганизма еще широко не вошли в клиническую практику. В свою очередь чувствительность культуральных методов исследования обычно не превышает 60% [44]. Кроме того, чувствительность, выявленная in vitro, не всегда соответствует таковой in vivo. Ввиду этого несколько эмпирических схем ЭТ третьего ряда предложены для лечения рефрактерной инфекции Н. pylori.
10-Дневная ЧКТ, включающая ИПН, амоксициллин, левофлоксацин и препарат висмута, позволяет достичь 84% эрадакации у пациентов, не ответивших на ТКТ и ЧКТ на основе препаратов висмута [45].
Протокол 14-дневной ЭТ с рифабутином (ИПН + амоксициллин + рифабутин) в качестве терапии третьего ряда позволяет добиться эффективности в 66% случаев [46]. Однако терапия рифабутином может быть ассоциирована с миелотоксичностью, лейкопенией и тромбоцитопенией [47].
Другой потенциально эффективной схемой ЭТ третьего ряда может являться схема ЧКТ с фуразолидоном (ИПН + висмута трикалия дицитрат + фуразолидон + тетрациклин). Данный 7-дневный протокол продемонстрировал высокую эффективность (90%) в ЭТ третьего ряда [48].
Альтернативные схемы ЭТ. Схема LOAD.
Схема LOAD (ИПН, левофлоксацина, нитазоксанида и доксициклина) представляет собой наиболее изучаемый протокол ЭТ в США, демонстрирующий высокий уровень эрадикации Н.pylori (90%) [10]. По данным Р. Basu и соавт. [49], эффективность схемы LOAD составляет 90 и 88,9% при использовании 10- и 7-дневной терапии соответственно по сравнению с 73,3% 10-дневной стандартной ТКТ. В России нитазоксанид не зарегистрирован, ввиду чего перспективы применения данной схемы в нашей стране пока неясны.
Гибридная схема.
P. Hsu и соавт. [50]сообщили о новой концепции ЭТ, так называемой гибридной схеме (первые 7 дней ИПН + амоксициллин, последующие 7 дней ИПН + амоксициллин + кларитромицин + метронидазол). Среди 117 пациентов успешная эрадикация достигнута у 99,1%. Побочные эффекты наблюдались у 14,5%. Важно отметить, что новая схема терапии высоэффективна в отношении резистентных штаммов H. pylori, устойчивых к кларитромицину и метронидазолу [50]. Результаты одного исследования при всей показательности требуют дальнейшего изучения гибридной схемы ЭТ в различных популяциях для оценки перспектив широкого внедрения данного протокола в клиническую практику.
Китайские исследователи H. Ma и J. Wang [51] предложили альтернативную ЧКТ без препаратов висмута (ИПН + амоксициллин + левофлоксацин + фуразолидон) в качестве терапии первого ряда. Согласно полученным данным применение данной схемы в течение 7 дней ассоциировано с более высокой частотой эрадикации по сравнению с эквивалентной по длительности трехкомпонентной схемой ЭТ: 94,3 и 73% соответственно. Однако частота побочных эффектов была выше в экспериментальной группе (почти в 2 раза), тем не менее нежелательные явления носили легкий характер и отмены терапии не требовалось [51]
Актуальные и перспективные возможности оптимизации ЭТ.
Вопросы дополнительной оптимизации схем ЭТ остаются нерешенными. В клинической практике наиболее доступными методами повышения эффективности ЭТ являются пролонгация протокола ЭТ, применение высоких доз ИПН, включение препарата висмута в состав схемы [6, 7,10, 38].
В IV Маастрихтским соглашении на основе анализа исследований определено, что пролонгация ТКТ с 7 до 10—14 дней повышает уровень эрадикации в среднем на 5% [6]. В свою очередь в недавнем исследовании 8. Karatapanis [52] эффективность ТКТ при ее пролонгации с 7 до 14 дней увеличивалась на 15,7%.
Назначение ИПН в высоких дозах (2 раза в сутки) повышает эффективность классической ТКТ на 6—10% [6, 7, 53, 54]. При этом максимальный эффект достигается в случае применения наиболее современных ИПН: рабепразола и эзомепразола [53].
Другой доступный метод повышения эффективности схем ЭТ — включение препаратов висмута в их состав. В настоящее время существуют успешные работы по включению препаратов висмута не только в схемы ТКТ, но и в последовательную ЭТ [7, 10, 55].
Адъювантная терапия с включением пробиотиков в стандартные схемы ЭТ является полем для активных клинических исследований [1, 10, 38, 56]. В некоторых работах показана антагонистическая роль ряда пробиотиков по отношению к Н. pylori как in vitro, так и in vivo [57]. Наиболее часто в клинических исследованиях изучалась эффективность Saccharomyces boulardii, Lactobacillus spp., а также Bifidobacterium lactis и bifidum [56]. Несколько метаанализов (2009, 2010, 2013) демонстрируют, что добавление перечисленных пробиотиков в стандартные схемы ЭТ увеличивает частоту эрадикации, а также снижает частоту побочных эффектов, связанных с ЭТ, особенно диарею и нарушения вкуса [58-60].
Данные о терапевтическом преимуществе применения витаминов с антиоксидантной активностью (Е и С) в качестве вспомогательных средств ЭТ противоречивы [10]. Согласно метаанализу G. Li и соавт. [61] в настоящее время недостаточно имеющихся данных, чтобы сделать однозначный вывод об эффективности этих средств в рамках лечения инфицированных Н. pylori из-за малых выборок и недостаточного методологического качества исследований.
Перспективы прорыва в области лечения инфекции Н. pylori связаны с новыми антибактериальными препаратами. В настоящее время зарегистрировано несколько патентов потенциальных молекул, оказывающих прямой бактерицидный эффект на Н. pylori in vitro. При этом некоторые из них эффективны даже по отношению к штаммам бактерии, резистентным к кларитромицину и метронидазолу. Однако до реальных клинических испытаний данных молекул еще далеко [8].
Заключение.
Эффективность стандартной трехкомпонентной схемы ЭТ снижается во всем мире, главным образом данная негативная тенденция является следствием увеличения распространенности первичной резистентности Н. pylori к антибактериальным препаратам. Таким образом, лечение больных с инфекцией Н. pylori в клинической практике становится все более трудной задачей, ведь все большему числу пациентов требуется более 2 раз терапевтических режимов подряд. В качестве терапии первого ряда обнадеживающие результаты демонстрируют схемы последовательной ЭТ, а также ЧКТ без препаратов висмута, которые со временем могут занять более важное место в структуре антихеликобактерной терапии.
ЛИТЕРАТУРА
- Ruggiero Р. Helicobacter pylori infection: what’s new. Curr Opin Infect Dis 2012; 25 (3): 337-344.
- Tonkic A., Tonkic M., Lehours P, Megraud F. Epidemiology and diagnosis of Helicobacter pylori infection. Helicobacter 2012; 17 (Suppl. 1): 1-8.
- Shmuely H, Katicic M., Filipec Kanizaj T, Niv Y. Helicobacter pylori and nonmalignant diseases. Helicobacter 2012; 17 (Suppl. 1): 22-25.
- Huang X., Qu X., Yan W et al. Iron deficiency anaemia can be improved after eradication of Helicobacter pylori. Postgrad Med J 2010; 86 (1015): 272-278.
- Stasi R, Sarpatwari A., Segal J.B. et al. Effects of eradication of Helicobacter pylori infection in patients with immune thrombocytopenic purpura: a systematic review. Blood 2009; 113 (6): 1231-1240.
- Malfertheiner Р, Megraud Р, O’Morain С. et al.; European Helicobacter Study Group. Management of Helicobacter pylori infection: the Maastricht IV/ Florence Consensus Report. Gut 2012; 61 (7): 646-664.
- Ивашкин В. T, Маев И.В., Лапина Т.Л. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых. Рос журн гастроэнтерол гепатол, колопроктол 2012; 1:87—89.
- De Francesco V., TerardiE., Hassan C., ZulloA. Helicobacter pylori therapy: Present and future. World J Gastrointest Pharmacol Ther 2012; 3 (4): 68-73.
- Georgopoulos S.D., Papastergiou V., Karatapanis S. Helicobacter pylori eradication therapies in the era of increasing antibiotic resistance: A paradigm shift to improved efficacy. Gastroenterol Res Pract 2012; 2012: 757926.
- Tepes B., O’Connor A., Gisbert J., O’Morain C. Treatment of Helicobacter pylori infection 2012. Helicobacter 2012; 17 (Suppl. 1): 36-42.
- Megraud F. H pylori antibiotic resistance: prevalence, importance, and advances in testing. Gut 2004; 53:1374—1384.
- De Francesco V, Giorgio F., Hassan C. et al. Worldwide H. pylori antibiotic resistance: a systematic review. J Gastrointestin Liver Dis 2010; 19 (4): 409-414.
- Elviss N.C., Owen R.J., Breathnach A. et al. Helicobacter pylori antibiotic-resistance patterns and risk factors in adult dyspeptic patients from ethnic diverse populations in central and south London during 2000. J Med Microbiol 2005; 4:567—574.
- Pajares Garcia J.M., Pajares-Villarroya R., Gisbert J.P Helicobacter pylori infection: antibiotic resistance. Rev Esp Enferm Dig 2007; 99 (2): 63-70.
- Glupczynski Y., Megraud F, Lopez-Brea M. et al. European multicentre survey of in vitro antimicrobial resistance in Helicobacter pylori. Eur J Clin Microbiol Infect Dis 2001; 20: 820—823.
- Megraud F, Coenen S., Verspotten A. et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption. Gut 2013; 62 (1): 34—42.
- Кудрявцева Л.В. Состояние антибиотикорезистентности Helicobacter pylori в России. Экспер клин гастроэнтерол 2003; 3: 4-5.
- Маев И.В., Самсонов А.А., Андреев Д.Н. и др. Современные аспекты диагностики и лечения инфекции Helicobacter pylori (по материалам консенсуса Маастрихт IV, Флоренция, 2010). Мед совет 2012; 8:10-19.
- Rimbara Е., Fischbach L.A., Graham D.Y. Optimal therapy for Helicobacter pylori infections. Nat Rev Gastroenterol Hepatol 2011; 8: 79-88.
- Gisbert J.P, Pajares R, Pajares J.M. Evolution of Helicobacter pylori therapy from a meta-analytical perspective. Helicobacter 2007; 12 (Suppl. 2): 50-58.
- Gisbert J.P., CalvetX. Review article: the effectiveness of standard triple therapy for Helicobacter pylori has not changed over the last decade, but it is not good enough. Aliment Pharmacol Ther 2011; 34 (11): 1255-1268.
- Yoon J.H., Baik G.H., Sohn K.M. et al. Trends in the eradication rates of Helicobacter pylori infection for eleven years. World J Gastroenterol 2012; 18 (45): 6628-6634.
- Fujioka T, Aayama N, Sakai K. etal. A large-scale nationwide multicenter prospective observational study of triple therapy using rabe- prazole, amoxicillin, and clarithromycin for Helicobacter pylori eradication in Japan. J Gastroenterol 2012; 47 (3): 276—283.
- Dore M.P., Farina V, Сисси et al. Twice-a-day bismuth-contain- ing quadruple therapy for Helicobacter pylori eradication: a randomized trial of 10 and 14 days. Helicobacter 2011; 16 (4): 295—300.
- Xu M.H, Zhang G. Y, Li C.J. Efficacy ofbismuth-based quadruple therapy as first-line treatment for Helicobacter pylori infection. Zhejiang Da Xue Xue Bao Yi Xue Ban 2011; 40 (3): 327-331.
- S, Kramer J.R., Graham D.Y, Treiber G. Meta-analysis: four-drug, three-antibiotic, non-bismuth-containing «concomitant therapy» versus triple therapy for Helicobacter pylori eradication. Helicobacter 2009; 14 (2): 109-118.
- Gisbert J.P., Calvet X. Update on non-bismuth quadruple (concomitant) therapy for eradication of Helicobacter pylori. Clin Exp Gastroenterol 2012; 5:23—34.
- Yanai A., Sakamoto K, Akanuma M. et al. Non-bismuth quadruple therapy for first-line Helicobacter pylori eradication: A randomized study in Japan. World J Gastrointest Pharmacol Ther 2012; 3 (1): 1-6.
- Hassan C, De Francesco V., Zullo A. et al. Sequential treatment for Helicobacter pylori eradication in duodenal ulcer patients: improving the cost of pharmacotherapy. Aliment Pharmacol Ther 2003; 18: 641-646.
- Francavilla R., Lionetti E., Castellaneta S.P. et al. Improved efficacy of 10-day sequential treatment for Helicobacter pylori eradication in children: a randomized trial. Gastroenterol 2005; 129: 1414-1419.
- Delgado J., Bujanda L., Gisbert P. et al. Effectiveness of a 10-day sequential treatment for Helicobacter pylori eradication in clinical practice. Gastroenterology 2007; 132: A112.
- Schmilovitz-Weiss H, Shalev T, Chechoulin Y. etal. High eradication rates of Helicobacter pylori infection following sequential therapy: the Israeli experience treating naive patients. Helicobacter 2011; 16 (3): 229-233.
- Kim Y.S., Kim S.J., Yoon J.H et al. Randomized clinical trial: the efficacy of a 10-day sequential therapy vs. a 14-day standard proton pump inhibitor-based triple therapy for Helicobacter pylori in Korea. Aliment Pharmacol Ther 2011; 34 (9): 1098—1105.
- Tsay F.W., Tseng H.H., Hsu PL et al. Sequential therapy achieves a higher eradication rate than standard triple therapy in Taiwan. J Gastroenterol Hepatol 2012; 27 (3): 498—503.
- Kate V., Kalayarasan R., Ananthakrishnan N. Sequential therapy versus standard triple-drug therapy for helicobacter pylori eradication: a systematic review of recent evidence. Drugs 2013; 73 (8): 815-824.
- Wu D. C, Hsu PL, Tseng H.H et al. Helicobacter pylori infection: a randomized, controlled study comparing 2 rescue therapies after failure of standard triple therapies. Medicine (Baltimore) 2011; 90:180-185.
- Gisbert J.P. «Rescue» regimens after Helicobacter pylori treatment failure. World J Gastroenterol 2008; 14: 5385—5402.
- Chuah S.K., Tsay F.W., Hsu PL, Wu D.C. A new look at antiHelicobacter pylori therapy. World J Gastroenterol 2011; 17 (35): 3971-3975.
- Berning M., Krasz S, Miehlke S. Should quinolones come first in Helicobacter pylori therapy? Ther Adv Gastroenterol 2011; 4 (2): 103-114.
- Gisbert J.P., Morena F. Systematic review and meta-analysis: levofloxacin-based rescue regimens after Helicobacter pylori treatment failure. Aliment Pharmacol Ther 2006; 23 (1): 35—44.
- Wong W.M., Gu Q., Chu K.M. et al. Lansoprazole, levofloxacin and amoxicillin triple therapy vs. quadruple therapy as second- line treatment of resistant Helicobacter pylori infection. Aliment Pharmacol Ther 2006; 23:421-427.
- Kuo C.H., Ни H.M., Kuo F.C. etal. Efficacy of levofloxacin-based rescue therapy for Helicobacter pylori infection after standard triple therapy: a randomized controlled trial. J Antimicrob Chemother 2009; 63:1017-1024.
- Miehlke S., Krasz S., Schneider-Brachert W. et al. Randomized trial on 14 versus 7 days of esomeprazole, moxifloxacin, and amoxicillin for second-line or rescue treatment of Helicobacter pylori infection. Helicobacter 2011; 16 (6): 420—426.
- Savarino V., Zentilin P., Pivari M. et al. The impact of antibiotic resistance on the efficacy of three 7-day regimens against Helicobacter pylori. Aliment Pharmacol Ther 2000; 14 (7): 893—900.
- Hsu P.I., Wü D.C., Chen A. et al. Quadruple rescue therapy for Helicobacter pylori infection after two treatment failures. Eur J Clin Invest 2008; 38 (6): 404-409.
- Gisbert J.P., CalvetX., Bujanda L. et al. «Rescue» therapy with rifabutin after multiple Helicobacter pylori treatment failures. Helicobacter 2003; 8 (2): 90-94.
- Apseloff G. Severe neutropenia among healthy volunteers given rifabutin in clinical trials. Clin Pharmacol Ther 2003; 74 (6): 591— 592.
- Treiber G, Ammon S., Malfertheiner P, Klotz U. Impact of furazolidone-based quadruple therapy for eradication of Helicobacter pylori after previous treatment failures. Helicobacter 2002; 7 (4): 225-231.
- Basu P.P, Rayapudi K, Pacana T. et al. A randomized study comparing levofloxacin, omeprazole, nitazoxanide, and doxycycline versus triple therapy for the eradication of Helicobacter pylori. Am J Gastroenterol 2011; 106 (11): 1970-1975.
- Hsu P.I., Wii D. C., Wu J. Y., Graham D. Y. Modified sequential Helicobacter pylori therapy: proton pump inhibitor and amoxicillin for 14 days with clarithromycin and metronidazole added as a quadruple (hybrid) therapy for the final 7 days. Helicobacter 2011; 16 (2): 139-145.
- Ma H.J., Wang J.L. Quadruple therapy for eradication of Helicobacter pylori. World J Gastroenterol 2013; 19 (6): 931—935.
- Karatapanis S., Georgopoulos S.D., Papastergiou V. et al. 7, 10 and 14-days rabeprazole-based standard triple therapies for H. pylori eradication: are they still effective? A randomized trial. Acta Gastroenterol Belg 2011; 74 (3): 407-412.
- Vittoria A. Acid-related diseases: are higher doses of proton pump inhibitors more effective in the treatment of Helicobacter pylori infection? Gastroenterol Hepatol 2008; 31: 546—547.
- Кучерявый Ю.А., Баркалова E.B. Двойные дозы ингибиторов протонной помпы — путь повышения эффективности тройной антихеликобактерной терапии первого ряда. Леч дело 2012; 1: 36-42.
- Uygun A., OzelA.M., Sivri В. et al. Efficacy of a modified sequential therapy including bismuth subcitrate as first-line therapy to eradicate Helicobacter pylori in a Turkish population. Helicobacter 2012; 17(6): 486-490.
- Kuo C.H., Kuo F.C., Hu H.M. etal. The Optimal First-Line Therapy of Helicobacter pylori Infection in Year 2012. Gastroenterol Res Bract 2012; 2012:168361.
- Pinchuk I. V, Bressottier P, Vemeuil B. et al. In vitro anti-Helico- bacter pylori activity of the probiotic strain Bacillus subtilis 3 is due to secretion of antibiotics. Antimicrob Agents Chemother 2001; 45 (11): 3156-3161.
- Zou J., Dong J., Yu К Meta-analysis: Lactobacillus containing quadruple therapy versus standard triple first-line therapy for Helicobacter pylori eradication. Helicobacter 2009; 14 (5): 97—107.
- Szajewska H., Horvath A., Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther 2010; 32 (9): 1069-1079.
- Wang Z.H., Gao Q. Y, Fang J. Y. Meta-Analysis of the Efficacy and safety of Lactobacillus-containing and Bifidobacterium-containing probiotic compound preparation in Helicobacter pylori eradication therapy. J Clin Gastroenterol 2013; 47 (1): 25—32.
- Li G, Li L., Yu C., Chen L. Effect ofvitamins C and E supplementation on Helicobacter pylori eradication: a meta-analysis. Br J Nutr2011; 106 (11): 1632-1637.





