Когнитивные и астенические расстройства после COVID-19


Опубликована Янв. 1, 2022
Последнее обновление статьи Сен. 1, 2022
Аннотация
Новая коронавирусная инфекция нередко влечет за собой стойкие неврологические осложнения, к числу самых распространенных из них относятся когнитивные и астенические симптомы. В статье приводятся данные о частоте встречаемости и клинических особенностях таких симптомов после COVID-19, их связи с тяжестью перенесенного инфекционного заболевания, клиническом значении и влиянии на повседневную жизнь. Обсуждаются механизмы развития когнитивных, астенических и других неврологических осложнений коронавирусной инфекции, в том числе прямая инвазия вируса SARS-CoV-2 церебрального вещества, иммунные и метаболические нарушения, формирование цереброваскулярных заболеваний в результате коронавирусного эндотелиита, церебральная гипоксия, социальная изоляция в связи с ограничительными мерами, декомпенсация сопутствующих заболеваний. В статье также освещаются воп росы профилактики и лечения неврологических осложнений коронавирусной инфекции, в том числе профилактики цереброваскулярных заболеваний. Анализируется влияние антиагрегантной терапии, назначенной пациентам с сердечно-сосудистыми заболеваниями для профилактики повторных ишемических событий, на течение и осложнения COVID-19. Также в статье представлено клиническое наблюдение стойких и выраженных когнитивных нарушений у молодой женщины, перенесшей COVID-19 в легкeeй форме.
Ключевые слова
Астения, COVID-19, цереброваскулярные заболевания., эндотелиит, SARS-CoV-2, когнитивные нарушения, новая коронавирусная инфекция, постковидный синдром
Введение
Нарушение когнитивных функций является одним из наиболее распространенных неврологических симптомов. Каждый человек хотя бы несколько раз в жизни испытывал стойкое и/или значительное недовольство состоянием своей памяти, внимания или умственной работоспособности. В этом плане когнитивные расстройства можно сравнить с головной болью или головокружением, которые также хотя бы несколько раз в жизни испытывает каждый человек. КогнитивныЦ 5 нарушения (КН) могут присутствовать в любом возрасте, но стойкие и клинически значимые расстройства высших мозговых функций достоверно чаще отмечаются у лиц старше 50 лет. По данным исследования «ПРОМЕТЕЙ» [1], которое проводилось в 2004–2005 гг. в России, 87% лиц старше 65 лет, которые пришли на амбулаторный прием к неврологу по какой-либо причине, среди различных жалоб отмечали также снижение памяти или умственной работоспособности. Около 70% амбулаторных неврологических пациентов имели объективные КН по данным нейропсихологических тестов, а у 25% количество баллов по шкале Mini-Mental State Examination (MMSE) составило 24 балла и ниже, что может свидетельствовать о наличии выраженного нейрокогнитивного расстройства (деменции).
Список причин КН обширен и насчитывает множество различных неврологических, соматических, психических и иных заболеваний или временных дисфункций. К этому списку следует добавить еще одну часто встречаемую причину — новую коронавирусную инфекцию. На сегодняшний день нет сомнений в том, что одним из наиболее распространенных, стойких и дезадаптирующих последствий инфицирования SARS-CoV-2 является снижение памяти и других когнитивных функций. При этом КН после перенесенного COVID-19 могут быть результатом декомпенсации существующего церебрального заболевания, например хронической ишемии мозга или болезни Альцгеймера, или совершенно новым симптомом у пациентов молодого и среднего возраста без какого-либо неврологического заболевания в анамнезе.
Клинические проявления неврологических нарушений после COVID-19
Особенностями клинической картины постковидных КН являются трудности концентрации внимания, повышенная утомляемость при умственной работе, ощущение «затуманенности» в голове. За последние месяцы лексикон российских неврологов обогатился термином «мозговой туман», который представляет собой буквальный перевод английского выражения "brain fog". «Мозговой туман» не позволяет пациенту сосредоточиться и продолжать эффективную умственную работу. Таким обр
'e0зом, он, по сути, является субъективным эквивалентом КН. С другой стороны, недостаточная концентрация внимания, ее частые колебания, которые приводят к быстрой утомляемости при умственной работе, паузам и остановкам текущей познавательной деятельности, могут быть совершенно справедливо классифицированы лечащими врачами как психическая астения. Астения (букв. «бессилие») представляет собой стойкие жалобы пациента на слабость, утомляемость, усталость, снижение работоспособности и др., которые не уменьшаются после достаточного отдыха. В случае, если усталость и утомляемость возникают в связи с физическими нагрузками, говорят о физической астении, в связи с умственными или эмоциональными нагрузками — о психической астен ии. После COVID-19, как правило, присутствуют оба вида астении. По данным эпидемиологических исследований [2, 3], астенические расстройства являются самыми распространенными среди последствий новой коронавирусной инфекции (см. таблицу).

Семиотика когнитивных и астенических расстройств после COVID-19
M. Taquet et al. [4] проанализировали международную медицинскую базу данных TriNetX, в которой содержится информация более чем о 81 млн человек, и изучили данные 236 379 пациентов в возрасте 10 лет и старше, переболевших COVID-19. Среди неврологических или психиатрических диагнозов, которые выставлялись пациентам в первые 6 мес. после перенесенного COVID-19, самыми распространенными оказались периферические невропатии (2,85%), острые нарушения мозгового кровообращения (2,66%), деменция (0,67%), миастения (0,45%), болезнь Паркинсона (0,11%) и энцефалит (0,1%). Согласно исследованиям [1, 5] КН легкой степени после перенесенных острых респираторных вирусных инфекций встречаются в повседневной практике значительно чаще, чем нарушения тяжелой степени. Аналогичное соотношение ожидаемо и среди пациентов, переболевших COVID-19.
Британские нейропсихологи провели онлайн-тестирование [6] более 81 тыс. пациентов старше 16 лет (средний возраст составил 46,75 года). Среди этой выборки 12 689 пациентов перенесли COVID-19 с разной степенью тяжести дыхательной недостаточности. В ходе исследования анализировались данные специального опросника, включающего в себя вопросы по оценке влияния пандемии на различные сферы жизни; вопросы социодемографической составляющей и уровня доходов; наличие предполагаемого или подтвержденного COVID-19; персистирующие симптомы и их тяжесть; сведения о сопутствующих заболеваниях; наличие и степень тяжести дыхательных нарушений; оценку выраженности депрессии, тревоги, посттравматического стрессового расстройства, нарушений сна и общей слабости. Когнитивные функции (планирование, умозаключения, оперативная память, внимание и эмоциональный интеллект) оценивались по данным Теста оценки интеллекта жителей Великобритании (Great British Intelligence Test). Результаты, полученные после статистической обработки, подтвердили гипотезу о том, что COVID-19 имеет разностороннее негативное влияние на познавательные функции. Так, результаты выполнения нейропсихологических тестов переболевших пациентов достоверно отличались от возрастных нормативов по интегративным показателям и, особенно, в отношении памяти и внимания. При этом степень отклонения от нормы напрямую зависела от тяжести перенесенной коронавирусной инфекции и объема медицинских пособий по лечению дыхательной недостаточности. Наиболее выраженное когнитивное снижение отмечалось у пациентов, которым потр e5бовалось подключение к аппарату искусственной вентиляции легких (ИВЛ).
По данным S. Miners et al. [7], у пациентов молодого и среднего возраста (средний возраст 42,2 года), перенесших COVID-19 в легкой и среднетяжелой форме, в сравнении с контрольной группой (средний возраст 38,4 года) отмечались нарушения кратковременной памяти, выявленные с помощью специализированных шкал, чувствительных к додементным КН.
T. Lui et al. [8] провели дистанционную оценку когнитивных функций 1539 пациентов старше 60 лет через 6 мес. после заражения вирусом SARS-CoV-2. Были обследованы пациенты с умеренно тяжелым или тяжелым течением COVID-19, потребовавшим госпитализации. Выраженные КН сохранялись у 10,5% больных, а легкие — у 25,2% пациентов с тяжелой формой COVID-19. У пациентов с умеренно тяжелой формой COVID-19 данные показатели составили 0,7% и 4,8% соответственно. Распространенность КН различной степени тяжести после COVID-19 была достоверно большей по сравнению с подобранными по полу и уровню образования сверстниками без коронавирусной инфекции в анамнезе. Более высокий риск КН отмечался у пациентов пожилого возраста, при более тяжелом течении коронавирусной инфекции, в особенности у тех, кто в остром периоде находился на ИВЛ или получал кислородную поддержку. Предикторами когнитивного ухудшения в постковидном периоде были также сердечно-сосудистые заболевания, хроническая обструктивная болезнь легких и делирий в острой фазе коронавирусной инфекции.
Новая коронавирусная инфекция вызывает ухудшение в различных когнитивных сферах. По данным A. Jaywant et al. [9], наиболее часто страдают гибкость мышления, темп познавательной деятельности и непосредственное воспроизведение слов, в то время как случаи трудного отсроченного воспроизведения и узнавания слов относительно редки. В 2021 г. M. Mazza et al. [10] на основании результатов обследования 226 пациентов после коронавирусной пневмонии показали, что самым частым когнитивным симптомом в постковидном периоде является недостаточность управляющей функции (планирование и контроль).
Некоторые авторы [9, 11] сообщают о наличии достоверной связи между КН и некоторыми другими неврологическими осложнениями СOVID-19. Так, M. Almeria et al. [11] приводят данные, что пациенты с головной болью, дисгевзией и аносмией после COVID-19 характеризуются достоверно более низкими показателями оперативной памяти, чем пациенты без данных симптомов. Головная боль также была достоверно связана со степенью недостаточности управляющей функции и интегративным показателем интеллекта.
Патогенетические механизмы неврологического постковидного синдрома
Обсуждается несколько вероятных механизмов патогенного влияния COVID-19 на центральную и периферическую нервную систему.
Прямое инфицирование нейронов и глиоцитов
Инфицирование клетки хозяина происходит посредством связывания спайк-протеина вируса и рецептора ангиотензинпревращающего фермента 2 (АПФ-2). Данный тип рецепторов широко представлен в ЦНС и присутствует как на мембране, так и в цитоплазме нейронов и глиоцитов, в коре и подкорковых серых узлах, клетках гипоталамуса и гипофиза [12, 13]. В связи с этим можно прогнозировать развитие у части пациентов с COVID-19 вирусного энцефалита. Однако к настоящему времени в доступной литературе встречаются лишь единичные описания случаев доказанного коронавирусного энцефалита [14]. Так, L. Zhou et al. [15] опубликовали клиническое наблюдение пациента 56 лет с клиникой энцефалита на фоне подтвержденного диагноза COVID-19, у которого из цереброспинальной жидкости был выделен SARS-CoV-2.
Обсуждаются два возможных пути проникновения SARS-CoV-2 в головной мозг:
гематоэнцефалический путь — из кровеносного русла через гематоэнцефалический барьер вместе с иммунокомпетентными клетками;
нейрональный путь — через слизистую носа и обонятельные нервные волокна [12, 16].
«Цитокиновый шторм»
Головной мозг может быть мишенью так называемого «цитокинового шторма», который сегодня рассматривается в качестве ведущей причины многих угрожающих жизни осложнений COVID-19. Было показано [12], что у пациентов в острой фазе COVID-19 наблюдается повышение проницаемости гематоэнцефалического барьера и выход иммунокомпетентных клеток из кровеносного русла в паренхиму головного мозга, а также активация местной воспалительной микроглиальной реакции в белом веществе. Важную роль в повреждении нервной ткани играют воспалительные изменения в астроцитах. Как известно, астроциты выполняют ряд важнейших функций церебральной деятельности: участвуют в синаптогенезе, контролируют метаболизм нейротрансмиттеров, поддерживают активность нейроваскулярных единиц и лимфатической системы. Индуцированные COVID-19 патологические астроглиальные реакции могут способствовать появлению различных нейропсихических симптомов, манифестации или утяжелению симптомов нейродегенеративных заболеваний [12, 17].
Наиболее тяжелым вариантом иммуноопосредованного поражения головного мозга у пациентов с синдромом «цитокинового шторма» является острая некротическая энцефалопатия [14, 18]. Ее описания при COVID-19 немногочисленны, но встречаются в литературе. Так, в марте 2020 г. N. Poyiadji et al. [19] описали случай острой некротизирующей энцефалопатии у пациентки 58 лет с подтвержденным COVID-19. Менее тяжелые дизимунные расстройства, вероятно, встречаются значительно чаще и играют важную патогенетическую роль в развитии КН после COVID-19. В частности, по данным M. Mazza еt al. [10], выраженность нарушений внимания, управляющей функции и памяти в постковидном периоде достоверно коррелирует с уровнем воспалительных маркеров в начале болезни.
Церебральный гипометаболизм
J.A. Hosp et al. [20] в исследовании с применением позитронно-эмиссионной томографии (ПЭТ) выявили, что COVID-19 приводит к снижению метаболизма глюкозы в лобных и теменных долях головного мозга. Выполняли ПЭТ после 2 отрицательных результатов ПЦР-теста и 2 дней без респираторных симптомов, т. е. после клинического выздоровления. Авторы предполагают, что в основе церебрального гипометаболизма также лежат патологические дизиммунные реакции. Об этом свидетельствует сочетание изменений метаболизма с активацией микроглии в белом веществе, что было выявлено при патоморфологическом исследовании головного мозга у одного из пациентов. Авторы выявили достоверную связь церебральной дисфункции и когнитивного снижения: выраженность гипометаболизма коры Ц 3оловного мозга достоверно коррелировала с результатами нейропсихологических тестов. Примечательно, что при обычной МРТ у обследованных пациентов не выявлялось каких-либо патологических отклонений, за исключением церебрального инфаркта в 1 случае.
Гипоксия
При тяжелом течении COVID-19 у пациентов с дыхательной недостаточностью важным механизмом церебрального повреждения является острая или подострая гипоксия головного мозга [11]. Известно, что нейроны головного мозга очень чувствительны к гипоксии, при этом кора и подкорковые серые узлы страдают раньше и в значительно большей степени, чем белое вещество. Острое повреждение мозга при критической гипоксемии называется острой ишемически-гипоксической энцефалопатией и характеризуется тяжелыми и необратимыми КН и другими неврологическими нарушениями. Считается, что при отсутствии нарушений сознания (без гипоксической комы) ишемически-гипоксическая энцефалопатия имеет благоприятный прогноз. Однако восстановление нормального функционирования нейронов может занять значительное время (иногда до нескольких месяцев), особенно у пациентов с остаточными дыхательными расстройствами [21, 22]. Поэтому наличие астенических расстройств и КН в постковидном периоде у пациент ов с дыхательными расстройствами является закономерным.
Цереброваскулярные нарушения
Как уже отмечалось выше, новая коронавирусная инфекция значительно увеличивает риск ишемических церебральных событий. В литературе представлены многочисленные свидетельства [23–26] прямой инвазии коронавирусом эндотелиоцитов сосудов легких и других органов и тканей. Повреждение эндотелия ведет, в свою очередь, к появлению множественных очагов локальной адгезии тромбоцитов и распространенным микро- и макротромбозам, с вовлечением в том числе церебральных артерий [12, 23]. Очень частой лабораторной находкой у пациентов с COVID-19 является повышение уровня D-димера и фибриногена, что свидетельствует о текущем процессе тромбообразования [24–26]. Имеется также сообщение [25] о повышенной частоте встречаемости антител к волчаночному антикоагулянту и кардиолипину, что указывает на развитие вторичного антифосфолипидного синдрома у части пациентов. В исследовании K.W. Miskowiak et al. [27] получена достоверная корреляция между показателями отсроченной памяти, темпом познавательной деятельности и уровнем D-димера в острой фазе, что является косвенным подтверждением роли сосудистых событий в снижении когнитивных функций после перенесенного COVID-19.
Обычно острые нарушения мозгового кровообраще edия на фоне COVID-19 развиваются у пожилых пациентов с сопутствующими сердечно-сосудистыми заболеваниями, такими как артериальная гипертензия, ишемическая болезнь сердца, гиперлипидемия, стенозы сонных артерий и др. Однако в доступной литературе имеется немало описаний развития инсульта у пациентов молодого и среднего возраста с нетяжелым течением новой коронавирусной инфекции и при отсутствии значимой сердечно-сосудистой патологии [27, 28].
Профилактика и лечение неврологических расстройств, ассоциированных с COVID-19
Из-за небольшого периода времени с начала пандемии пока не существует основанного на доказательствах подхода к лечению постковидных когнитивных и астенических нарушений. В повседневной практике клиницисты руководствуются традиционным для отечественной неврологической практики алгоритмом — при субъективных легких и умеренных когнитивных и астенических нарушениях назначаются вазотропные и нейрометаболические препараты. Выраженные нейрокогнитивные расстройства являются показанием для назначения мемантина и/или ингибиторов ацетилхолинэстеразы. Ацетилхолинергические препараты следует использовать, в первую очередь, у пациентов с признаками нейродегенеративного процесса — болезни Альцгеймера или болезни диффузных телец Леви, клинические проявления которых могут значительно усугубляться после перенесенной новой коронавирусной инфекции. При сочетании КН с астеническими нарушениями приоритетны нейрометаболические препараты с антиастеническими свойствами (пентоксифиллин, фонтурацетам, пирацетам и др.) [12].
Большое значение для профилактики постковидного неврологического синдрома имеет правильное ведение пациентов в остром периоде новой коронавирусной инфекции. С учетом несомненной роли коронавирусного эндотелиита активно изучаются потенциальные возможности лекарственных средств, которые используются для профилактики тромботических событий. При осложненном течении коронавирусной инфекции и/или у пациентов с сопутствующими сердечно-сосудистыми заболеваниями в остром периоде нередко назначаются пероральные антикоагулянты [7, 8]. Представляет практический интерес также изучение влияния антиагрегантной терапии на течение и последствия COVID-19. Этот вопрос закономерно возникает в связи с тем, что многие пациенты пожилого возраста с сопутствующей сердечно-сосудистой патологией, заболевшие COVID-19, получают антиагрегантную терапию для профилактики ишемических собы тий еще с докоронавирусного периода.
Большое число авторов [29–33] анализировали, как подобная терапия влияет на течение основного инфекционного заболевания и риск его тромботических осложнений. Так, J. Chow et al. [29] провели ретроспективную оценку эффективности антиагрегантной терапии у 412 госпитальных пациентов с COVID-19, из которых 314 пациентов получали ацетилсалициловую кислоту (АСК). Использование АСК было достоверно связано со снижением частоты ИВЛ и уменьшением внутрибольничной летальности. О снижении 30-дневной госпитальной летальности и/или потребности в ИВЛ у пациентов с COVID-19 на фоне применения АСК сообщают также A. Sisinni et al. [30] на основании наблюдения за 984 пациентами, из которых 253 получали антиагрегантную терапию.
Результаты одного из наиболее крупных исследований эффективности антиагрегантной терапии при COVID-19 были представлены T.F. Osborne et al. [31]. Были проанализированы данные более 26 тыс. пожилых пациентов, из них более 6 тыс. применяли АСК. Все пациенты получали антиагрегантные препараты до заболевания COVID-19 в качестве вторичной профилактики ишемических событий. Было показано, что применение антиагрегантной терапии ассоциировано с достоверным уменьшением 2-недельной и месячной летальности у пожилых пациентов с сопутствующими сердечно-сосудистыми заболеваниями. Также о достоверном снижении госпитальной летальности на фоне проводимой антиагрегантной терапии сообщили M.L. Meizlish et al. [32] и A.M. Haji et al. [33]. По данным многофакторного регрессионного анализа, использование АСК снижает относительный риск смерти от всех причин у госпитализированных пациентов с COVID-19 тяжелого течения на 25% [32].
В отдельных работах [34, 35] сравнивали эффективность антиагрегантной и антикоагулянтной терапии у пациентов, инфицированных SARS-CoV-2. В исследовании H.W. Abdelwahab et al. [34] сопоставлялась частота возникновения тромботических осложнений на фоне приема АСК и при лечении эноксапарином. Риск тромбоэмболических осложнений достоверно снижался в обеих терапевтических группах, в несколько большей степени — в группе эноксапарина. Кроме того, сочетанное назначение АСК и эноксапарина приводило к снижению потребности в ИВЛ.
Следует отметить, что не все исследования говорят о положительном влиянии антиагрегантной терапии при COVID-19 [36, 37]. В частности, не было показано преимуществ АСК в малых дозах в проспективном исследовании ACTIV-4B [38]. В этой работе все пациенты с COVID-19 были рандомизированы в 4 группы: 1-я получала АСК, 2-я — антикоагулянт в профилактической дозе, 3-я — антикоагулянт в терапевтической дозе и 4-я — плацебо. Преимуществ какого-либо вида активной терапии перед плацебо показано не было. Однако в данное наблюдение включались стабильные амбулаторные пациенты с нетяжелым течением COVID-19, поэтому риск тромботических осложнений, дыхательной недостаточности или смерти изначально был небольшим.
Данных о влиянии антиагрегантной терапии на течение новой коронавирусной инфекции пока недостаточно для какого-либо обоснованного вывода. Необходимо дальнейшее изучение этого вопроса с использованием двойного слепого метода. Следует отметить, что самый часто наз edачаемый антиагрегантный препарат — АСК обладает также противовоспалительным эффектом и воздействует на цитокиновый каскад, связанный с репликацией вируса [39]. Поэтому использование данного препарата у пациентов с СOVID-19 перспективно не только в плане профилактики тромботических осложнений, но и, возможно, в плане модификации течения основного инфекционного процесса.
Клиническое наблюдение
Пациентка, 38 лет, по профессии юрист, в настоящее время получает второе высшее образование, учится на психологическом факультете. Обратилась с жалобами на повышенную утомляемость, трудности концентрации внимания, «туман в голове», забывчивость, избыточную сонливость. Указанные симптомы доставляют существенный дискомфорт в повседневной жизни и привели к значительному снижению академической успеваемости.
Пациентка 9 мес. назад переболела COVID-19 в легкой форме: отмечались катаральные явления при нормальной температуре тела, выраженная апатия, астения, психомоторная заторможенность и сонливость. Через 2 нед. после начала заболевания пациентка была выписана к труду после получения повторного отрицательного результата ПЦР-теста. Однако апатия, утомляемость и сонливость сохранялись вплоть до дня консультации.
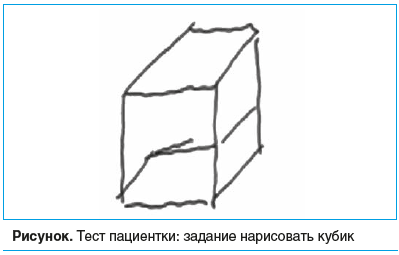
При осмотре: очаговой неврологической симптоматики нет. MMSE — 25 баллов (норма — 28–30 баллов). Познавательная деятельность протекает в значительно замедленном темпе, пробу Шульте выполняет за 56 с (норма — не более 25–30 с). Запоминание 3 слов, 3 попытки: 2–1–3. Ошибки в серийном счете. Конструктивная диспраксия (см. рисунок).
МРТ головного мозга — без патологических отклонений.
Таким образом, пациентка молодого возраста, не страдающая каким-либо заболеванием головного мозга, переболела COVID-19 в легкой форме. После этого в течение 9 мес. у нее сохраняются выраженные астенические расстройства и умеренные КН, которые существенно снижают качество жизни, препятствуют продолжению обучения. Важно подчеркнуть, что до заболевания COVID-19 пациентка не предъявляла каких-либо жалоб на изменение когнитивных функций, вела активный образ жизни. Астенические и когнитивные нарушения у пациентки фиксируются на фоне нормальной картины МРТ головного мозга, что характерно для неврологического постковидного синдрома.
Заключение
Таким образом, COVID-19 вызывает ухудшение в различных когнитивных сферах не только у пациентов пожилого возраста, но и у молодых. В настоящее время выявлено несколько вероятных механизмов патогенного влияния новой коронавирусной инфекции на центральную и периферическую нервную систему. Для профилактики и лечения неврологических нарушений, ассоциированных с COVID-19, отечественными специалистами применяются вазотропные и нейрометаболические препараты (легкие и умеренные КН), мемантин и ингибиторы ацетихолинэстеразы (тяжелые КН). Особого внимания заслуживает назначение антикоагулянтной и антиагрегантной терапии. Не вызывает сомнений необходимость продолжать ранее назначенную по показаниям антиагрегантную терапию в случае инфицирования SARS-CoV-2. Использование АСК у пациентов с СOVID-19 перспективно не только в плане профилактики тромботических осложнений, но и, возможно, в плане модификации течения основного инфекционного процесса. Необходимы дальнейшие исследования медикаментозной терапии КН, ассоциированных с COVID-19, с использованием двойного слепого метода.
Литература
2. Davido B., Seang S., Tubiana R., de Truchis P. Post-COVID-19 chronic symptoms: a post-infectious entity? Clin Microbiol Infec. 2020;26:1448–1449. DOI: 10.1016/j.cmi.2020.07.028.
3. Vanichkachorn G., Newcomb R., Cowl C.T. et al. Post-COVID-19 Syndrome (Long Haul Syndrome): Description of a Multidisciplinary Clinic at Mayo Clinic and Characteristics of the Initial Patient Cohort. Mayo Clin Proc. 2021;96(7):1782–1791. DOI: 10.1016/j.mayocp.2021.04.024.
4. Taquet M., Geddes J.R., Husain M. et al. 6-month neurological and psychiatric outcomes in 236 379 survivors of COVID-19: a retrospective cohort study using electronic health records. Lancet Psychiatry. 2021;8(5):416–427. DOI: 10.1016/S2215-0366(21)00084-5.
5. Захаров В.В., Вахнина Н.В., Громова Д.О. и др. Клинический спектр недементных когнитивных расстройств: субъективные, легкие и умеренные нарушения. Неврология, нейропсихиатрия, психосоматика. 2015;7(4):83–91. [Zakharov V.V., Vakhnina N.V., Gromova D.O. et al. Clinical spectrum of cognitive impairment without dementia: subjective, mild and moderate. Nevrologia, neuropsychiatriya, psychosomatika. 2015;7(4):83–91 (in Russ.)].
6. Hampshire A., Trender W., Chamberlain S. et al. Cognitive deficits in people who have recovered from COVID-19 relative to controls: An N=84,285 online study. E Clinical Medicine. 2021;39:101044. DOI: 10.1016/j.eclinm.2021.101044.
7. Miners S., Kehoe P.G., Love S. Cognitive impact of COVID-19: looking beyond the short term. Alzheimer’s Res Ther. 2020;12(1):170. DOI: 10.1186/s13195-020-00744-w.
8. Liu Y.H., Wang Y.R., Wang Q.H. et al. Post-infection cognitive impairments in a cohort of elderly patients with COVID-19. Mol Neurodegeneration. 2021;16:48–49. DOI: 10.1186/s13024-021-00469-w.
9. Jaywant A., Vanderlind W.M., Alexopoulos G.S. et al. Frequency and profile of objective cognitive deficits in hospitalized patients recovering from COVID-19. Neuropsychopharmacology. 2021;10:1–6. DOI: 10.1038/s41386-021-00978-8.
10. Mazza M.G., Palladini M., De Lorenzo R. et al. Persistent psychopathology and neurocognitive impairment in COVID-19 survivors: Effect of inflammatory biomarkers at three-month follow-up. Brain Behav Immun Health. 2021;94:138–147. DOI: 10.1016/j.bbi.2021.02.021.
11. Almeria M., Cejudo J.C., Sotoca J. et al. Cognitive profile following COVID-19 infection: Clinical predictors leading to neuropsychological impairment. Brain Behav Immun Health. 2020;9:100163. DOI: 10.1016/j.bbih.2020.100163.
12. Хасанова Д.Р., Житкова Ю.В., Васкаева Г.Р. Постковидный синдром: обзор знаний о патогенезе, нейропсихиатрических проявлениях и перспективах лечения. Неврология, нейропсихиатрия, психосоматика. 2021;13(3):93–98. [Khasanova D.R., Jitkova Yu.V., Vaskaeva G.R. Post-COVID syndrome: review of knowledge of pathogenesis, neuropsyhiatriс manifestations and treatment perspectives. Nevrologia, neuropsychiatriya, psychosomatika. 2021;13(3):93-98 (in Russ.)]. DOI: 10.14412/2074-2711-2021-3-93-98].
13. Zubair A.S., McAlpine L.S., Gardin T. et al. Neuropathogenesis and Neurologic Manifestations of the Coronaviruses in the Age of Coronavirus Disease 2019: A Review. JAMA Neurol. 2020;77(8):1018–1027. DOI: 10.1001/jamaneurol.2020.2065.
14. Ellul M.A., Benjamin L., Singh B. et al. Neurological associations of COVID-19. Lancet Neurol. 2020;19(9):767–783. DOI: 10.1016/S1474-4422(20)30221-0.
15. Zhou L., Zhang M., Wang J., Gao J. SARS-CoV-2: underestimated damage to nervous system. Travel Med Infect Dis. 2020;1:101642. DOI: 10.1016/j.tmaid.2020.101642.
16. Kumari P., Rothan H.A., Natekar J.P. et al. Neuroinvasion and Encephalitis Following Intranasal Inoculation of SARS-CoV-2 in K18- hACE2 Mice. Viruses. 2021;13(1):132. DOI: 10.3390/v13010132.
17. Futtrup J., Margolinsky R., Benros M.E. et al. Blood-brain barrier pathology in patients with severe mental disorders: a systematic review and meta-analysis of biomarkers in case control studies. Brain Behav Immun Health. 2020;90:364–380. DOI: 10.1016/j.bbi.2020.08.028.
18. Преображенская И.С. Неврологические проявления COVID-19. Эффективная фармакотерапия. 2020;16(23):50–55. [Preobrajenskaya I.S. Neurologic manifestations of COVID-19. Effective pharmacotherapy. 2020;16(23):50–55 (in Russ.)]. DOI: 10.33978/2307-3586-2020-16-23-50-55.
19. Poyiadji N., Shahin G., Noujaim D. et al. COVID-19-associated acute hemorrhagic necrotizing encephalopathy: CT and MRI features. Radiology. 2020;296(2):E119–E120. DOI: 10.1148/radiol.2020201187.
20. Hosp J.A., Dressing A., Blazhenets G. et al. Cognitive impairment and altered cerebral glucose metabolism in the subacute stage of COVID-19. Brain. 2021;144(4):1263–1276. DOI: 10.1093/brain/awab009.
21. Dodd J.W., Getov S.V., Jones P.W. Cognitive function in COPD. Eur Respir J. 2010;35(4):913–922. DOI: 10.1183/09031936.00125109.
22. Hung W.W., Wisnivesky J.P., Siu A.L., Ross J.S. Cognitive decline among patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009;180(2):134–137. DOI: 10.1164/rccm.200902-0276OC.
23. Воробьев П.А. Рекомендации по ведению больных с коронавирусной инфекцией COVID-19 в острой фазе и при постковидном синдроме в амбулаторных условиях. Проблемы стандартизации в здравоохранении. 2021;7–8:3–96. DOI: 10.26347/1607-2502202107-08003-096. [Vorobyev P.A. Recommendation on coronavirus infection COVID-19 outpatients management. Problemi standartizatzii v zdravoohranenii. 2021;7-8:3-96 (in Russ.)]. DOI: 10.26347/1607-2502202107-08003-096.
24. Koralnik I.J., Tyler K.L. COVID-19: A Global Threat to the Nervous System. Ann Neurol. 2020;88(1):1–11. DOI: 10.1002/ana.25807.
25. Tan Y.K., Goh C., Leow A.S.T. et al. COVID-19 and ischemic stroke: a systematic review and meta-summary of the literature. J Thromb Thrombolysis. 2020;50(3):587–595. DOI: 10.1007/s11239-020-02228-y.
26. Rostami M., Mansouritorghabeh H. D-dimer level in COVID-19 infection: a systematic review. Expert Rev Hematol. 2020;13(11):1265–1275. DOI: 10.1080/17474086.2020.1831383.
27. Miskowiak K.W., Johnsen S., Sattler S.M. et al. Cognitive impairments four months after COVID-19 hospital discharge: Pattern, severity and association with illness variables. Eur Neuropsychopharmacol. 2021;46:39–48. DOI: 10.1016/j.euroneuro.2021.03.019.
28. Oxley T.J., Mocco J., Majidi S. et al. Large-vessel stroke as a presenting feature of Covid-19 in the young. N Engl J Med. 2020;382:e60. DOI: 10.1056/nejmc2009787.
29. Chow J.H., Khanna A.K., Kethireddy S. et al. Aspirin Use Is Associated With Decreased Mechanical Ventilation, Intensive Care Unit Admission, and In-Hospital Mortality in Hospitalized Patients With Coronavirus Disease 2019. Anesth Analg. 2021;132(4):930–941. DOI: 10.1213/ANE.0000000000005292.
30. Sisinni A., Rossi L., Battista A. et al. Pre-admission acetylsalicylic acid therapy and impact on in-hospital outcome in COVID-19 patients: The ASA-CARE study. Int J Cardiol. 2021;344:240–245. DOI: 10.1016/j.ijcard.2021.09.058.
31. Osborne T.F., Veigulis Z.P., Arreola D.M. et al. Association of mortality and aspirin prescription for COVID-19 patients at the Veterans Health Administration. PLoS One. 2021;16(2):e0246825. DOI: 10.1371/journal.pone.0246825.
32. Meizlish M.L., Goshua G., Liu Y. et al. Intermediate-dose anticoagulation, aspirin, and in-hospital mortality in COVID-19: A propensity score-matched analysis. Am J Hematol. 2021;96(4):471–479. DOI: 10.1002/ajh.26102.
33. Haji Aghajani M., Moradi O., Amini H. et al. Decreased in-hospital mortality associated with aspirin administration in hospitalized patients due to severe COVID-19. J Med Virol. 2021;93(9):5390–5395. DOI: 10.1002/jmv.27053.
34. Abdelwahab H.W., Shaltout S.W., Sayed Ahmed H.A. et al. Acetylsalicylic Acid Compared with Enoxaparin for the Prevention of Thrombosis and Mechanical Ventilation in COVID-19 Patients: A Retrospective Cohort Study. Clin Drug Investig. 2021;41(8):723–732. DOI: 10.1007/s40261-021-01061-2.
35. Sahai A., Bhandari R., Godwin M. et al. Effect of aspirin on short-term outcomes in hospitalized patients with COVID-19. Vasc Med. 2021:1358863X211012754. DOI: 10.1177/1358863X211012754.
36. Yuan S., Chen P., Li H. et al. Mortality and pre-hospitalization use of low-dose aspirin in COVID-19 patients with coronary artery disease. J Cell Mol Med. 2021;25(2):1263–1273. DOI: 10.1111/jcmm.16198.
37. Pan D., Ip A., Zhan S. et al. Pre-hospital antiplatelet medication use on COVID-19 disease severity. Heart Lung. 2021;50(5):618–621. DOI: 10.1016/j.hrtlng.2021.04.010.
38. Connors J.M., Brooks M.M., Sciurba F.C. et al. Effect of antithrombotic therapy on clinical outcomes in outpatients with clinically stable symptomatic covid-19: the ACTIV-4B randomized clinical trial. JAMA. 2021;1:e2117272. DOI: 10.1001/jama.2021.17272.
39. Tantry U.S., Schror K., Navarese E.P. et al. Aspirin as an adjunctive pharmacological therapy option for COVID-19: anti-inflammatory, antithrombotic, and antiviral effects all in one agent. J Exp Pharmacol. 2021;13:257–270





