Оптимизация ранней диагностики патологических состояний слизистой оболочки рта


Опубликована Янв. 1, 2017
Последнее обновление статьи Сен. 30, 2022
Аннотация
Цель исследования — усовершенствовать алгоритм для ранней диагностики патологических, в том числе злокачественных, процессов на слизистой оболочке рта и для определения их истинных границ путем включения в него метода прямой визуализации аутофлюоресценции тканей.
Материалы и методы. Проведено проспективное рандомизированное клиническое исследование, результаты которого позволили усовершенствовать алгоритм обследования слизистой оболочки рта. Разработана схема топографирования и кодирования элементов поражения слизистой оболочки губ с учетом зоны локализации патологического процесса. Уточнены пределы возможности метода прямой визуализации аутофлюоресценции тканей для верификации поражений слизистой оболочки рта различного генеза.
Результаты. Предложен новый алгоритм обследования пациентов с патологическими изменениями слизистой оболочки рта, который включает в себя визуальный осмотр полости рта и выявление патологических процессов, топографирование и кодирование элементов поражения слизистой оболочки, визуализацию и анализ полиморфизма клеток эпителия слизистой оболочки с помощью метода прямой визуализации аутофлюоресценции тканей, а также микроскопию биоптата.
Ключевые слова
Полость, предрак;, рта;, прямая, диагностика;, аутофлюоресценции, ранняя, тканей, визуализация, рак;
Результаты последнего национального эпидемиологического стоматологического обследования свидетельствуют о том, что заболевания слизистой оболочки рта все чаще встречаются у лиц молодого возраста, приводя у зрелого населения к утяжелению и хронизации процесса, а в некоторых случаях и к малигнизации [1, 2].
По данным ВОЗ, в структуре смертности онкологические заболевания занимают второе место после сердечно-сосудистой патологии [3]. В 2015 г. смертность населения в России от злокачественных новообразований приблизилась к 300 000 человек [1].
После постановки диагноза при локализации процесса в области головы и шеи каждый третий онкологический больной умирает в течение года, а порог выживаемости лиц с данной патологией не превышает 5 лет [3, 4]. Одной из причин позднего обращения к врачу является смазанная клиническая картина на начальных стадиях заболевания. Несмотря на кажущуюся простоту клинической визуализации изменений слизистой оболочки рта, определение нозологической формы предрака, основанное только на впечатлении от осмотра и пальпации, нередко ведет к диагностическим ошибкам, так как различная степень ороговения или изъязвления элементов поражения делает их трудно дифференцируемыми [5]. Особенно затруднительна ранняя диагностика озлокачествления, поскольку его клинические признаки появляются намного позднее реально возникшей злокачественной трансформации. Процент инкурабельных форм рака слизистой оболочки из-за диагностических ошибок, по данным разных авторов, достигает 58,4–70,0% [4, 5]. В связи с этим проблема ранней диагностики патологических процессов на слизистой оболочке рта является не просто актуальной, а жизненно необходимой, социально значимой, требующей для своего решения внедрения современных скрининговых технологий.
Отсутствие методологического подхода и четких алгоритмов ранней диагностики морфологических признаков заболеваний слизистой оболочки рта является основанием для изучения данной проблемы.
Цель исследования — усовершенствовать алгоритм для ранней диагностики патологических, в том числе злокачественных, процессов на слизистой оболочке рта и для определения их истинных границ путем включения в него метода прямой визуализации аутофлюоресценции тканей.
Материалы и методы. Проведен онкоскрининг слизистой оболочки рта 80 пациентов обоего пола в возрасте от 20 до 60 лет. В зависимости от клинического состояния слизистой оболочки, которое определялось наличием или отсутствием видимых патологических процессов, пациенты были разделены на две группы: 1 группа — 40 человек с клиническими проявлениями патологических процессов на слизистой оболочке рта;
2 группа (контрольная) — 40 здоровых лиц без видимых изменений на слизистой оболочке, без сопутствующей соматической патологии на основании заключения врача-терапевта (табл. 1).
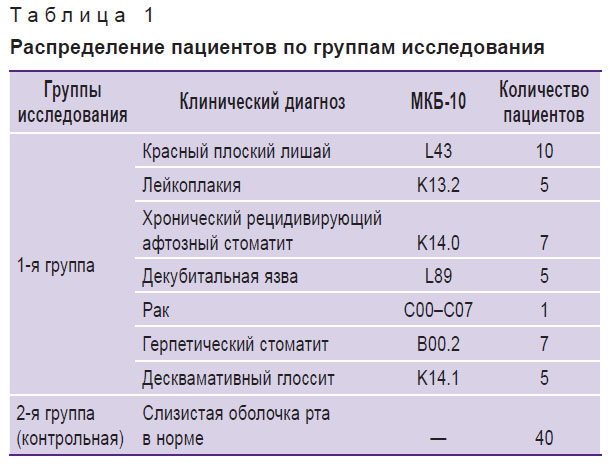 | Таблица 1. Распределение пациентов по группам исследования |
Работа основывалась на принципах доказательной медицины. Все исследуемые были стандартизированы по гендерным признакам, возрастным категориям и нозологическим формам. Исследование проводилось в соответствии с Хельсинской декларацией (Хельсинки, Финляндия, 1964 г.), пересмотренной в Эдинбурге (Шотландия) в 2000 г., одобрено Этическим комитетом Нижегородской государственной медицинской академии. От каждого пациента получено информированное согласие.
Для оценки диагностического потенциала метода прямой визуализации аутофлюоресценции тканей проведено исследование, основанное на способности пораженной ткани к накоплению специфического фотосенсибилизатора или индукции образования эндогенных порфиринов и регистрации их флюоресценции при облучении светом определенной длины волны. При таком обследовании аутофлюоресценция здоровых тканей наблюдается в зеленой части спектра, в месте развития злокачественного процесса регистрируется резкое снижение интенсивности аутофлюоресцентного излучения относительно окружающей здоровой ткани. Данный эффект получил название «темного пятна» по причине того, что эпителий предраковых и злокачественных образований излучает свечение меньшей интенсивности, чем эпителий здоровой слизистой оболочки.
Поставленную задачу реализовали с помощью аппарата VELscope Vх (WhiteRock, Канада). Принцип его работы заключается в использовании светового потока определенного спектра для обнаружения структурно-измененных тканей. Так, под действием световой волны от 400 до 460 нм происходит возбуждение зелено-красной флюоресценции эндогенных тканевых флюорофоров слизистой оболочки рта. Флюоресценция тканей рассматривается непосредственно вдоль оптической оси, коллинеарной с осью возбуждения. Нормальная слизистая оболочка испускает различные оттенки зеленой аутофлюоресценции (рис. 1), при патологических изменениях наблюдается гашение флюоресценции и визуализируется темное пятно на фоне окружающих тканей (рис. 2). Таким образом, зоны потери нормальной ярко-зеленой флюоресценции трактуются как очаги, требующие дальнейшего изучения и исследования, а также как зоны локализации патологического процесса [6, 7].
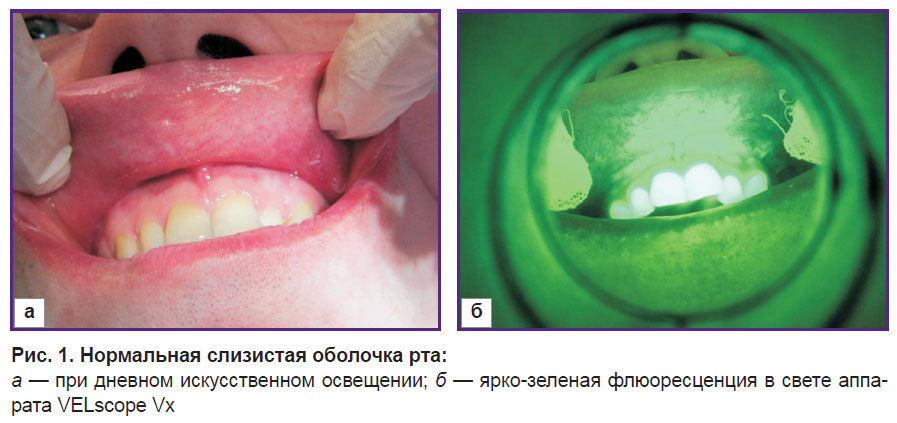 | Рис. 1. Нормальная слизистая оболочка рта: а — при дневном искусственном освещении; б — ярко-зеленая флюоресценция в свете аппарата VELscope Vx |
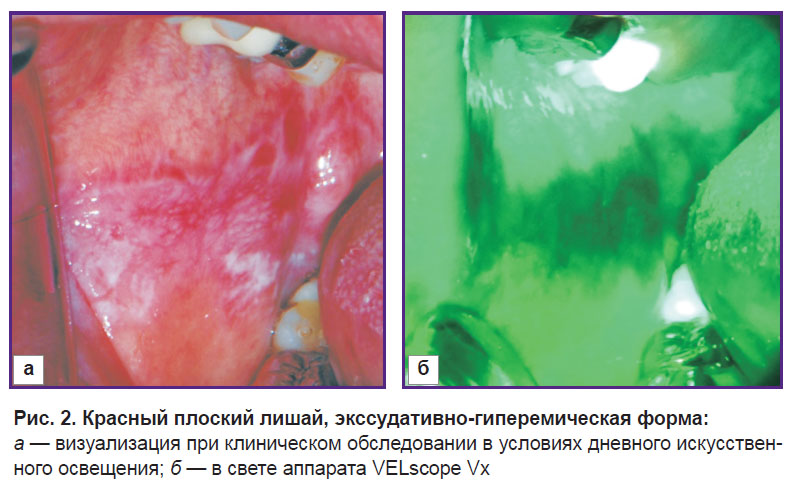 | Рис. 2. Красный плоский лишай, экссудативно-гиперемическая форма: а — визуализация при клиническом обследовании в условиях дневного искусственного освещения; б — в свете аппарата VELscope Vx |
Важным аспектом является соблюдение техники проведения прямой визуализации тканей. Данную методику необходимо проводить в затемненном помещении, располагая тубус аппарата в 20 см от слизистой оболочки рта. Особое внимание уделяется клинически не измененным участкам слизистой оболочки, имеющим гашение флюоресценции.
Согласно рекомендациям ВОЗ, визуальный осмотр полости рта и выявление патологических процессов на слизистой оболочке осуществляли по 4-уровневой системе диагностики. Топографирование и кодирование элементов поражения слизистой оболочки рта выполняли по B. Roed-Petersen и G. Renstrup (1969) в модификации О.С. Гилевой с соавт. (2008): слизистая оболочка щек — 19, 20 ТК ВОЗ (ТК — топографический код); язык — 39–47 ТК ВОЗ; альвеолярный отросток — 27–38 ТК ВОЗ; красная кайма губ — 13, 14 ТК ВОЗ. Для уточнения зон поражения слизистой оболочки губ на кафедре стоматологии ФПКВ Нижегородской государственной медицинской академии была разработана и внедрена в практическую стоматологию схема, включающая восемь сегментов с нумерацией от I до VIII и кодом морфологического элемента поражения — первой буквой его латинского названия: пятно (macula) — код «М», узелок (papula) — код «P», узел (nodus) — код «N», бугорок (tuberculum) — код «Т», язва (ulcus) — код «U», трещина (rhagades) — код «Rh», чешуйка (squama) — код «Sq», корка (crusta) — код «С», эрозия (erozia) — код «Е» [8].
Для сравнения площади поражения слизистой оболочки рта, оцененной при визуальном осмотре и при использовании аппарата VELscope Vx, мы выполняли регистрацию размеров (продольного и поперечного), патологических элементов с помощью измерительного циркуля. Площадь очагов поражения на слизистой оболочке рта рассчитывали по формуле [9]:
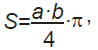
где а — продольный размер, b — поперечный размер.
Результаты и обсуждение. С целью определения необходимости обязательного включения метода прямой визуализации аутофлюоресценции тканей в алгоритм исследования аппарат Velscope Vx применен у всех 80 пациентов. В 44 случаях наблюдали потерю флюоресценции (55%): изменение нормального ярко-зеленого свечения слизистой оболочки рта отмечено во всех случаях у лиц 1-й группы и в 4 случаях — у лиц 2-й, тогда как в 36 случаях (45%) в контрольной группе никаких отклонений от нормальных оптических изображений не наблюдали. Таким образом, у 4 пациентов 2-й группы (здоровые лица) выявлена потеря флюоресценции при отсутствии клинических изменений (рис. 3).
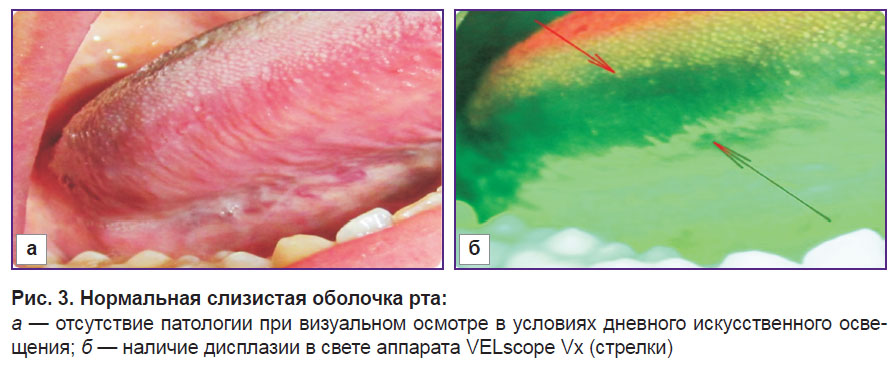 | Рис. 3. Нормальная слизистая оболочка рта: а — отсутствие патологии при визуальном осмотре в условиях дневного искусственного освещения; б — наличие дисплазии в свете аппарата VELscope Vx (стрелки) |
У 40 пациентов 1-й группы при явном наличии патологии в более чем 75% случаев (n=30) отмечена полная потеря флюоресценции в области проблемного участка, в 10 случаях — частичная (рис. 4). Ряд изображений имели смешанный результат — чередующиеся участки гашения и усиления свечения в различных областях зоны поражения (2,4%).
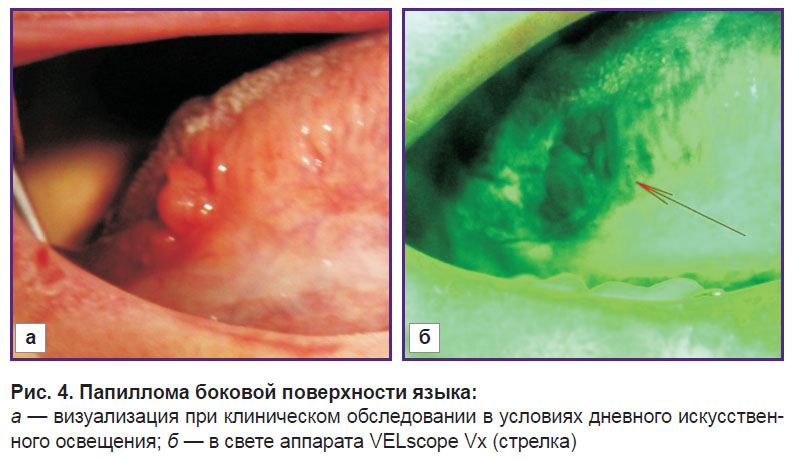 | Рис. 4. Папиллома боковой поверхности языка: а — визуализация при клиническом обследовании в условиях дневного искусственного освещения; б — в свете аппарата VELscope Vx (стрелка) |
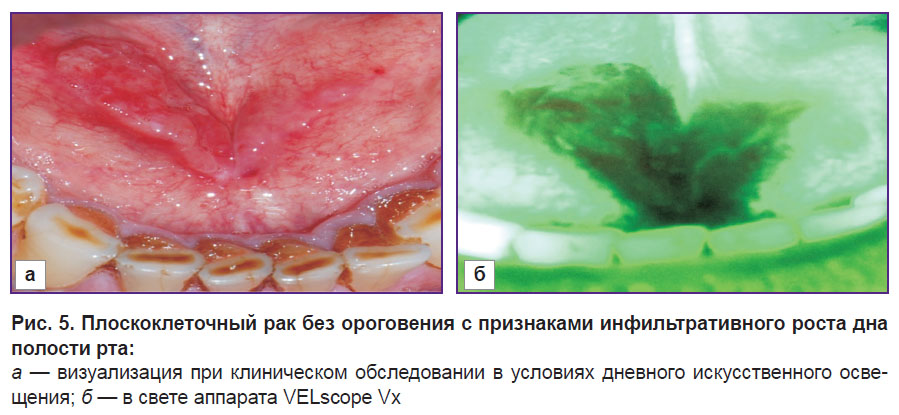
В 21 случае (48%) площадь области потери флюоресценции значительно превышала площадь поражения при осмотре невооруженным глазом (рис. 5).
Таким образом, у каждого из 40 пациентов с заболеваниями слизистой оболочки рта была рассчитана площадь патологических элементов: при визуализации невооруженным глазом в ходе клинического стоматологического обследования и при использовании аппарата VELscope Vx. Показатели средней площади элементов поражения при конкретной нозологической форме заболеваний слизистой оболочки представлены в табл. 2.
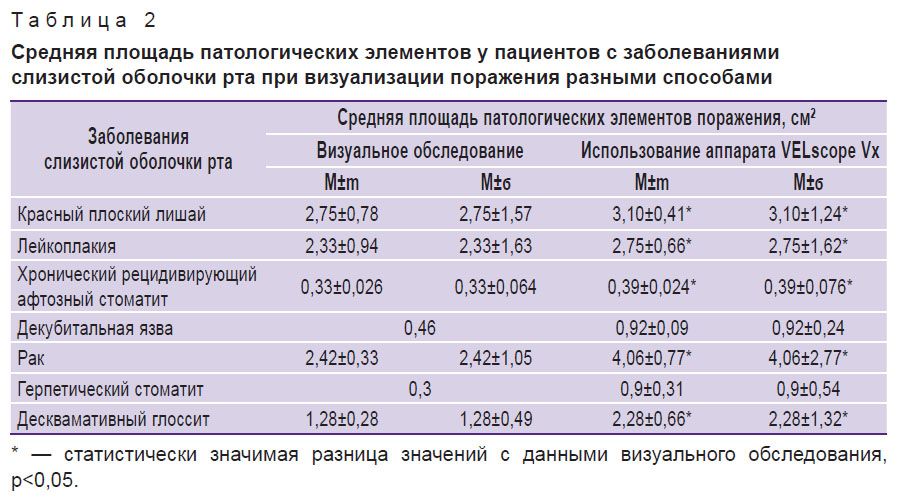 | Таблица 2. Средняя площадь патологических элементов у пациентов с заболеваниями слизистой оболочки рта при визуализации поражения разными способами |
При анализе полученных данных нами было отмечено, что у обследованных имеется статистически значимая разница (р<0,05) в средней площади элементов поражения на слизистой оболочке рта, визуализируемой клинически и при использовании аппарата VELscope Vx. Таким образом, метод прямой визуализации аутофлюоресценции тканей позволяет неинвазивно определить истинные границы патологического процесса, что является значимым при выборе тактики лечения и оценке его эффективности. Кроме того, комплексное использование визуального осмотра слизистой оболочки рта и метода прямой визуализации аутофлюоресценции тканей позволяет выявить зоны риска возникновения патологических процессов, в том числе предраковых состояний и онкопатологии (табл. 3, рис. 6).
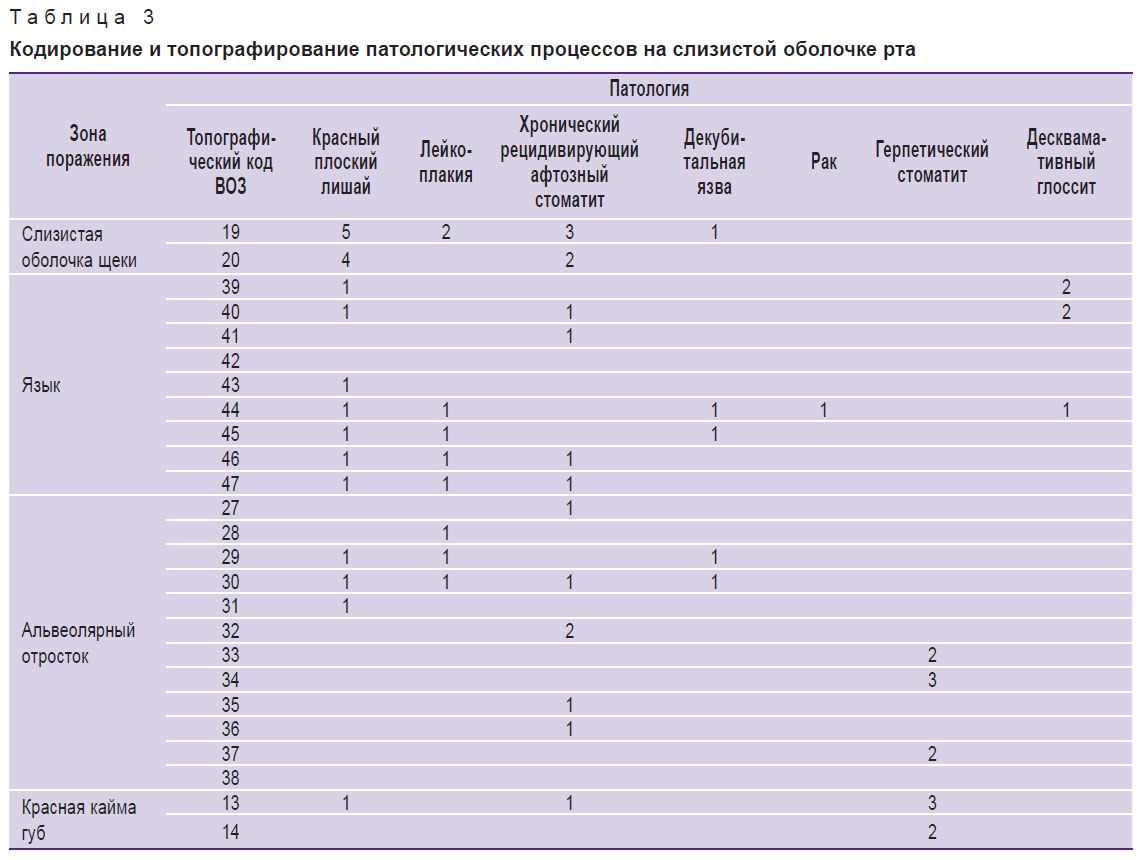 | Таблица 3. Кодирование и топографирование патологических процессов на слизистой оболочке рта |
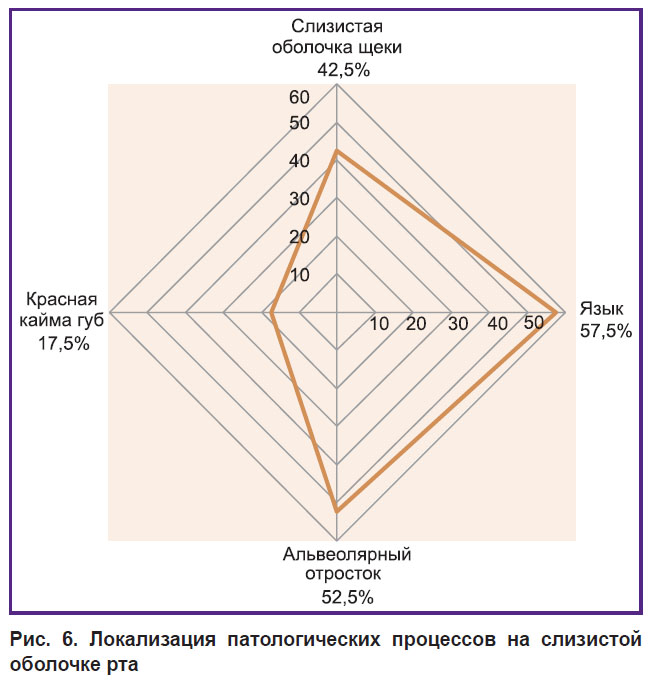 | Рис. 6. Локализация патологических процессов на слизистой оболочке рта |
Результаты проведенного исследования показали, что наиболее пристальное внимание при обследовании слизистой оболочки рта пациента врач-стоматолог должен уделять участкам, являющимся потенциальными зонами риска: слизистой оболочке щек, языка, дна полости рта и ретромолярных областей.
Однако следует понимать, что методика прямой визуализации аутофлюоресценции тканей не может служить основанием для постановки окончательного диагноза, все-таки признанным «золотым стандартом» диагностики является только прижизненное патоморфологическое исследование — биопсия из области поражения. При возникновении подозрения на обнаружение онкологического процесса необходимо проведение биопсии в обязательном порядке.
Все полученные нами результаты, свидетельствующие о наличии как явной, так и скрытой патологии эпителия слизистой оболочки рта, подтверждены морфологически с помощью исследований биоптатов, взятых из «проблемных» участков. Большинство диагностированных поражений были доброкачественными. Анализ данных, полученных в результате выполнения всего комплекса представленных исследований, позволил нам усовершенствовать существующий алгоритм обследования пациента с целью ранней диагностики предраковых и злокачественных изменений слизистой оболочки полости рта. Данный алгоритм в обязательном порядке должен включать в себя проведение следующих диагностических процедур:
1) визуальный осмотр полости рта и выявление патологических процессов на слизистой оболочке;
2) топографирование и кодирование элементов поражения слизистой оболочки;
3) визуализация и анализ полиморфизма клеток эпителия слизистой оболочки рта с помощью метода прямой визуализации аутофлюоресценции тканей;
4) микроскопия биоптата.
Заключение. Для своевременного и надежного обнаружения потенциально опасных (предраковых или злокачественных) поражений слизистой оболочки рта требуется выполнение целого комплекса исследовательских процедур. Предлагаемый алгоритм ранней диагностики таких поражений будет способствовать оптимизации и эффек-
тивности проводимого в дальнейшем лечения.
Финансирование исследования и конфликт интересов. Данное исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данными изысканиями, отсутствуют.
Литература
- Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. М: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИРЦ» Минздрава России, 2017; 250 с.
- Гажва С.И., Грехов А.В., Горячева Т.П., Сенина-Волжская И.В. Проблема ранней диагностики онкопатологии слизистой оболочки рта (социальные аспекты). Современные проблемы науки и образования 2015; 3. URL: http://science-education.ru/ru/article/view?id=19168.
- American Cancer Society. Cancer Facts & Figures 2013. URL: https://assets.documentcloud.org/documents/1109107/acs-facts-and-figures-2013.pdf.
- Mehrotra R., Gupta D.K. Exciting new advances in oral cancer diagnosis: avenues to early detection. Head Neck Oncol 2011; 3: 33, https://doi.org/10.1186/1758-3284-3-33.
- Гилева О.С., Либик Т.В., Позднякова А.А., Сатюкова Л.Я. Предраковые заболевания в структуре патологии слизистой оболочки полости рта. Проблемы стоматологии 2013; 2: 3–9.
- Kois J.C., Truelove E. Detecting oral cancer: a new technique and case reports. Dent Today 2006; 25(10): 94–97.
- Poh C.F., Zhang L., Anderson D.W., Durham J.S., Williams P.M., Priddy R.W., Berean K.W., Ng S., Tseng O.L., MacAulay C., Rosin M.P. Fluorescence visualization detection of field alterations in tumor margins of oral cancer patients. Clin Cancer Res 2006; 12(22): 6716–6722, https://doi.org/10.1158/1078-0432.ccr-06-1317.
- Дятел А.В. Повышение эффективности диагностики и лечения заболеваний красной каймы губ у пациентов с атопическим дерматитом. Дис. … канд. мед. наук. Н. Новгород; 2015.
- Орешака О.В., Дементьева Е.А. Некоторые аспекты комплексного лечения плоской формы лейкоплакии слизистой оболочки рта. Маэстро стоматологии 2012: 1: 72–74.