Проект консенсус совета экспертов Российской ассоциации эндокринологов (РАЭ) по инициации и интенсификации сахароснижающей терапии сахарного диабета 2 типа?


Опубликована Янв. 1, 2011
Последнее обновление статьи Ноя. 23, 2022
Аннотация
С учетом масштаба развивающейся эпидемии СД существует острейшая необходимость разработки эффективного терапевтического алгоритма сахароснижающего лечения, позволяющего достичь компенсации углеводного обмена и предупредить развитие тяжелых сосудистых осложнений этого заболевания. При этом приоритетом в выборе терапевтических средств должна стать эффективность сахароснижающего действия препаратов при их безопасности для пациентов (как крат- косрочной, так и отдаленной).
Ключевые слова
Сахарный диабет, консенсус, сахароснижающая терапия
Российской Федерации, как и во всем мире, продолжается прогрессирующее нарастание распространенности сахарного диабета 2 типа (СД2). По данным Государственного Регистра, на 01 января 2010 г. в России по обращаемости зарегистрировано 3 млн 121 тыс. больных СД, из них 90% – это больные СД2 [1]. В то же время данные контрольно-эпидемиологических исследований, проведенных ФГУ Эндокринологический научный центр за период 2005–2010 гг., свидетельствуют о том, что реальное число пациентов с СД превышает зарегистрированное в 2–3 раза. За последние 10 лет количество больных СД в России удвоилось.
С учетом масштаба развивающейся эпидемии СД существует острейшая необходимость разработки эффективного терапевтического алгоритма сахароснижающего лечения, позволяющего достичь компенсации углеводного обмена и предупредить развитие тяжелых сосудистых осложнений этого заболевания. При этом приоритетом в выборе терапевтических средств должна стать эффективность сахароснижающего действия препаратов при их безопасности для пациентов (как краткосрочной, так и отдаленной).
Международные и национальные алгоритмы сахароснижающей терапии СД2 регулярно обновляются в связи с получением новых результатов широкомасштабных рандомизированных исследований, меняющих представления о целевых значениях в терапии СД и способах их достижения, в связи с появлением новых групп сахароснижающих препаратов и их внедрением в клиническую практику, а также в связи с появлением серьезных ограничений в отношении ранее использовавшихся средств.
Одним из наиболее признанных международных алгоритмов лечения СД2 является совместный алгоритм ADA (Американской Диабетологической Ассоциации) и EASD (Европейской Ассоциации по Изучению Диабета), предложенный в 2006 г. и измененный в 2009 гг. [2, 3]. В этом документе терапия СД2 распределена на 2 ряда: терапия 1-го ряда – с наиболее доказанным терапевтическим эффектом и терапия 2-го ряда – с меньшим уровнем доказанности. Целью сахароснижающей терапии является достижение и поддержание уровня НbА1с<7%. Терапия 1-го ряда: метформин и активное изменение образа жизни являются первыми базовыми мероприятиями при установлении диагноза СД2. Если это лечение не приводит к достижению поставленной цели по снижению гликемии в течение 2–3 мес после инициации терапии (т.е. уровень НbА1с >7%), то следует добавить второй сахароснижающий препарат: либо препарат сульфонилмочевины (СМ), либо инсулин (предпочтителен у лиц с НbА1с более 8,5% или при наличии симптомов гипергликемии). Если же сочетанное применение метформина, СМ/базального инсулина и изменение образа жизни не приводят к достижению целей, то должна быть начата или интенсифицирована инсулинотерапия. Терапия 2-го ряда: дополнительно к метформину и модификации образа жизни предлагается назначать тиазолидиндион (ТЗД) (пиоглитазон), либо агонист рецепторов глюкагоноподобного пептида-1 (ГПП‑1) (эксенатид). Если на фоне терапии препаратами 2-го ряда через 3 мес целевой уровень НbА1с не достигается, то возможно или добавление препаратов СМ, или переход на инсулинотерапию.
Отдавая должное логичности предложенной модели лечения СД2, нельзя не отметить, что некоторые позиции этого базового алгоритма весьма дискутабельны.
Недостатки базового алгоритма ADA/EASD 2009:
- отсутствует персонифицированный подход к лечению пациентов (не определены индивидуальные цели лечения);
- не учитывается исходный уровень контроля углеводного обмена при назначении стартовой терапии;
- ограничен выбор сахароснижающей терапии в «дебюте» СД2;
- предлагается высокий темп интенсификации терапии (каждые 2–3 мес.);
- не определено место препаратов инкретинового ряда.
Отсутствие индивидуальных целей терапии: в алгоритме предлагается практически универсальная цель НbА1с<7,0% (с небольшими допущениями), тогда как в настоящее время стала очевидной необходимость дифференцированных подходов к лечению у лиц разных возрастных групп с различной выраженностью осложнений, сопутствующей патологии, с разным риском гипогликемий. Недавно завершившиеся рандомизированные исследования ACCORD (Action to Control Cardiovascular Risk in Diabetes) [4], ADVANCE (Action in Diabetes and Vascular Disease) [5] и VADT (Veteran Affairs Diabetes Trial) [6] убедительно продемонстрировали важность выбора индивидуальных целей гликемического контроля для каждого пациента в зависимости от возраста, длительности СД, наличия сердечно-сосудистых осложнений.
Не учитывается исходный уровень контроля углеводного обмена: всем больным с впервые диагностированным СД2 вне зависимости от исходного уровня контроля углеводного обмена предлагается стартовая терапия метформином на фоне соблюдения здорового образа жизни. Такой подход не всегда может быть эффективным, поскольку при исходном крайне неудовлетворительным метаболическом контроле более целесообразно назначить комбинированную сахароснижающую терапию, а возможно даже инициировать инсулинотерапию.
Ограничение выбора терапии в «дебюте» СД2: стартовая медикаментозная терапия представлена только метформином, при этом не учитываются индивидуальные особенности пациентов. Между тем, препарат имеет достаточно обширный список противопоказаний, включающий патологию почек (снижение скорости клубочковой фильтрации менее 60 мл/мин), тяжелые состояния гипоксии (сердечная недостаточность III–IV класса, дыхательная недостаточность, анемия), алкогольная болезнь. Кроме того у 10–20% может отмечаться непереносимость препарата.
Высокий темп интенсификации терапии: в алгоритме обозначен очень быстрый темп интенсификации терапии (каждые 2–3 месяца при отсутствии достижения цели предполагается усиление или радикальное изменение лечения). Вместе с тем, полученные результаты исследований ADVANCE, VADT, ACCORD предостерегают от излишне агрессивного достижения показателей, близких к нормогликемии и диктуют необходимость более плавного достижения поставленных целей [4, 5, 6].
Не определено место препаратов инкретинового ряда: с момента последнего обновления алгоритма ADA/EASD арсенал сахароснижающих средств пополнился новой группой препаратов инкретинового ряда – ингибиторами дипептидилпептидазы-4 (ДПП-4). Место этих препаратов не было определено в алгоритме ADA/EASD-2009, поскольку в то время опыт их применения был невелик. Кроме того, за последний год расширился список препаратов из группы агонистов ГПП-1: помимо эксенатида (миметика ГПП-1) в разных странах мира и в России зарегистрирован первый аналог ГПП-1 – лираглутид. В связи с этим требуется четкое определение места инновационных препаратов в алгоритме лечения СД2.
В значительной степени все недостатки алгоритма ADA/EASD учтены в опубликованном в октябре 2009 г. совместном алгоритме Американской Ассоциации Клинических Эндокринологов и Американского Колледжа Эндокринологии ААСЕ/АСЕ [7].
Принципиальными отличиями алгоритма ААСЕ/АСЕ-2009 от алгоритма ADA/EASD-2009 являются:
- стратификация лечения в зависимости от исходного уровня НbА1с;
- использование всех зарегистрированных классов сахароснижающих препаратов;
- приоритет эффективности и безопасности лечения над стоимостью и длительностью использования в клинической практике;
- некоторое ограничение роли препаратов сульфонилмочевины, которые несомненно весьма привлекательны вследствие относительно низкой стоимости и многолетнего опыта применения, однако ассоциированы с высоким риском гипогликемий и снижением их эффективности по мере длительного применения.
Совет экспертов Российской Ассоциации Эндокринологов (РАЭ) разработал настоящий Консенсус по инициации и интенсификации сахароснижающей терапии СД2, взяв за основу модель Алгоритма ААСЕ/АСЕ-2009. В представленном проекте алгоритма РАЭ главный акцент сделан на индивидуальный подход к лечению пациента. Приоритетом в выборе терапии должны стать безопасность и эффективность лечения. По мнению экспертов РАЭ, эти параметры являются гораздо более важными, чем стоимость препарата или длительность его использования в клинической практике. Следует четко представлять, что стоимость сахароснижающих препаратов представляет собой лишь малую часть всей стоимости лечения СД (включая средства самоконтроля, лечение гипогликемических эпизодов и их последствий, госпитализаций и т.д.). Наибольшая часть расходов связана с лечением осложнений СД, развитие которых практически неизбежно при отсутствии адекватного гликемического контроля.
Представленный алгоритм инициации и интенсификации сахароснижающей терапии СД2 является согласованным решением совета экспертов РАЭ, основанным на обобщении Российского и международного опыта лечения СД и опирающимся на данные доказательной медицины. На сегодняшний день такой вариант является единственным способом создать удобный в практическом использовании алгоритм, удовлетворяющий потребностям практического здравоохранения.
ОБЩИЕ ПОЛОЖЕНИЯ КОНСЕНСУСА РАЭ ПО ИНИЦИАЦИИ И ИНТЕНСИФИКАЦИИ САХАРОСНИЖАЮЩЕЙ ТЕРАПИИ СД2
ОПРЕДЕЛЕНИЕ ИНДИВИДУАЛЬНОГО ЦЕЛЕВОГО ЗНАЧЕНИЯ КОНТРОЛЯ ГЛИКЕМИИ ПО УРОВНЮ НBА1С
Для каждого пациента индивидуально устанавливается целевой уровень НbА1с, который зависит от возраста пациента или ожидаемой продолжительности его жизни, наличия сосудистых осложнений, риска развития гипогликемий.
На выбор индивидуальных целей НbА1с также могут оказывать влияние и другие факторы: мотивация, приверженность к лечению, уровень образования пациента, использование других лекарственных средств.
СТРАТИФИКАЦИЯ ТЕРАПЕВТИЧЕСКОЙ ТАКТИКИ В ЗАВИСИМОСТИ ОТИСХОДНОГО УРОВНЯ НBА1С
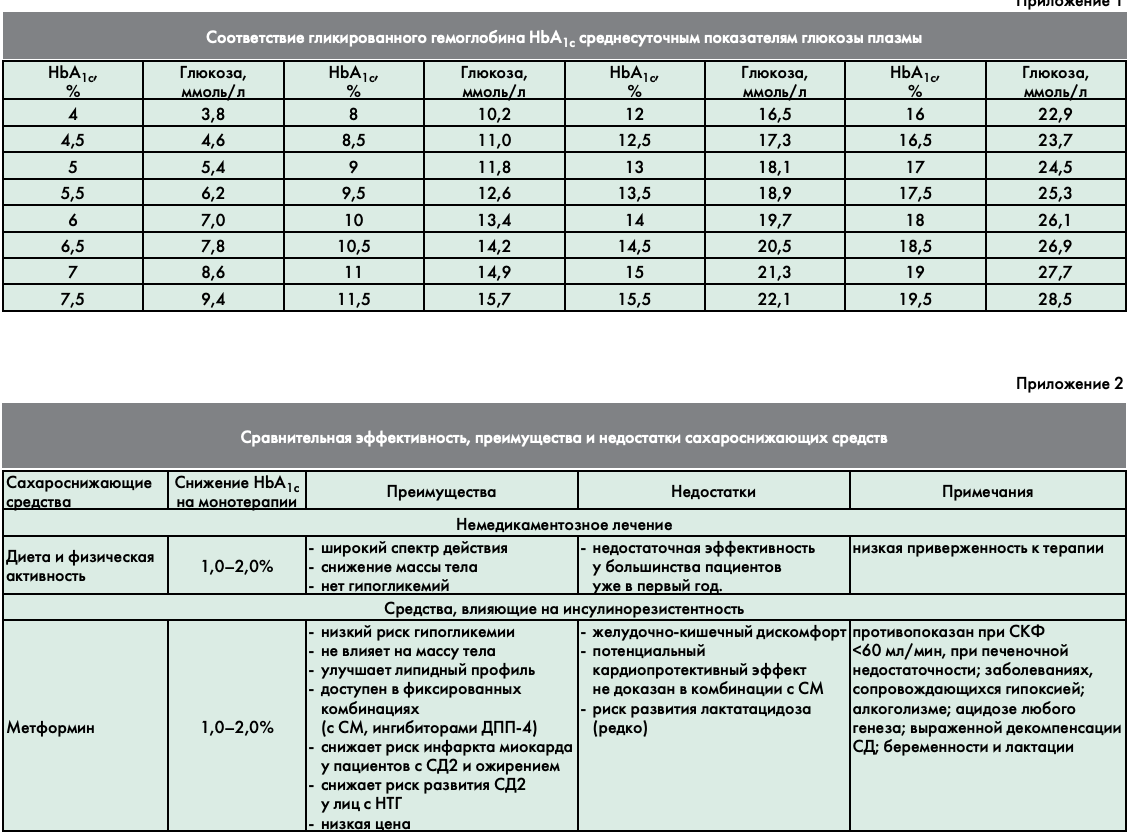
Совет экспертов РАЭ принял решение, что основным ориентиром в выборе стратегии лечения пациентов с СД2 должен являться показатель гликированного гемоглобина НbА1с, так как значения гликемии в течение суток имеют большую вариабельность. Показатели гликемии (натощак и постпрандиальные) могут быть использованы для принятия решений при невозможности получить результаты НbА1с (Приложение 1.).
- Изменение образа жизни (снижение массы тела при ее избытке, ограничение легкоусвояемых углеводов и насыщенных жиров, активизация физических нагрузок) является основой терапии СД2 при любом исходном уровне метаболического контроля. Обучение и мотивация больного должны начинаться незамедлительно. Тем не менее, низкая приверженность к данному немедикаментозному лечению диктует необходимость назначения лекарственной терапии. Поэтому терапия сахароснижающими препаратами в подавляющем большинстве случаев добавляется к изменению образа жизни уже в дебюте заболевания.
- При исходном НbА1с 6,5–7,5% достижение целевых значений гликемии возможно при использовании монотерапии сахароснижающими препаратами. Если при монотерапии достичь поставленных целей не удается, то в последующем возможно применение комбинированного лечения (2 или 3 препарата).
- При исходном НbА1с 7,6–9,0% следует сразу начинать с комбинированной терапии. При неэффективности возможно сочетание трех сахароснижающих препаратов или начало инсулинотерапии.
- При исходном НbА1с более 9,0% следует назначить инсулинотерапию (изолированную или в комбинации с пероральными сахароснижающими препаратами). Тактика назначения инсулинотерапии изложена в Российских клинических рекомендациях «Оптимизация и интенсификация инсулинотерапии при сахарном диабете 2 типа» от 2010 г. [8]. В дальнейшем, в случае достижения целевых показателей метаболического контроля, пациент может быть переведен на комбинированное лечение без инсулина.
ПРИНЯТИЕ РЕШЕНИЯ ОБ ИЗМЕНЕНИИ (ИНТЕНСИФИКАЦИИ) РАНЕЕ НАЗНАЧЕННОЙ ТЕРАПИИ
- Мониторинг эффективности сахароснижающей терапии по уровню НbА1с рекомендуется осуществлять каждые 3 мес. Титрация дозы назначенных сахароснижающих препаратов до максимально эффективной (переносимой) осуществляется по данным самоконтроля гликемии.
- Изменение (интенсификация) сахароснижающей терапии при ее неэффективности (т.е. при отсутствии достижения индивидуальных целей НbА1с) должно быть выполнено не позднее чем через 6 мес.; в случае ухудшения самочувствия или при отсутствии признаков эффективности лечения решение об интенсификации может быть принято раньше.
- Безопасность и эффективность являются приоритетами в выборе лечения. Индивидуальный подход должен применяться как на старте терапии, так и на любом этапе лечения.
ОПРЕДЕЛЕНИЕ ИНДИВИДУАЛЬНОГО ЦЕЛЕВОГО ЗНАЧЕНИЯ КОНТРОЛЯ ГЛИКЕМИИ ПО УРОВНЮ HBA1C
Индивидуальный подход к больному и, соответственно, определение индивидуального целевого уровня НbА1с должны являться основой выбора стратегии сахароснижающего лечения.
При выборе индивидуального целевого уровня НbА1с в первую очередь следует учитывать:
- возраст пациента;
- ожидаемую продолжительность жизни;
- наличие тяжелых осложнений;
- риск развития тяжелых гипогликемий.
Доказано, что сердечно-сосудистые осложнения и смертельный исход более часто встречаются у пациентов с гипогликемическими эпизодами (особенно тяжелыми гипогликемиями).
Риски интенсивной сахароснижающей терапии, имеющей целью предупредить развитие сосудистых осложнений диабета, могут превысить ожидаемую пользу по мере увеличения длительности диабета, возраста пациента и наличия уже имеющихся сосудистых осложнений.
Результаты исследования ACCORD показали, что чрезмерно быстрое или агрессивное регулирование терапии ассоциировано с повышенным риском развития гипогликемий и смертности от сердечно-сосудистых причин [4].
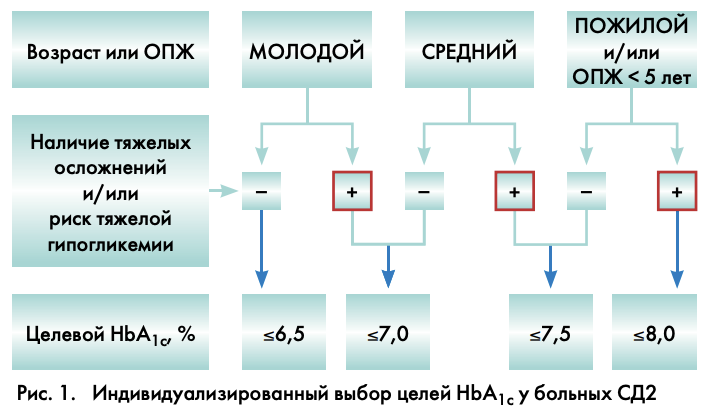
Основываясь на результатах международных исследований ACCORD, VADT, UKPDS и ADVANCE (в котором также принимали участие Российские эндокринологические и кардиологические центры), совет экспертов Российской Ассоциации Эндокринологов предлагает установить следующие индивидуальные цели сахароснижающей терапии по уровню НbА1с (рис. 1).
ПОЯСНЕНИЯ К ИНДИВИДУАЛИЗИРОВАННОМУ ВЫБОРУ ЦЕЛЕЙ НBА1С
- Возраст пациента не позволяет четко разграничить цели гликемического контроля, поскольку функциональное изнашивание органов и систем каждого человека с возрастом строго индивидуально. Поэтому параллельно с относительными понятиями «молодой», «средний» и «пожилой» возраст существует понятие «ожидаемой продолжительности жизни» (ОПЖ), которая в большей степени, чем возраст, позволяет определить предполагаемое общее состояние пациента и вероятность развития у него сосудистых осложнений. У пациентов молодого и среднего возраста с высокой ОПЖ предлагается достижение более строгих целей контроля гликемии для предупреждения развития микро- и макрососудистых осложнений диабета. У пациентов с ОПЖ<5 лет (вне зависимости от возраста) цели гликемического контроля могут быть менее строгими, поскольку прогноз жизни такого пациента, как правило, определяется другой патологией (например, онкологическим заболеванием).
- Наличие тяжелых осложнений сахарного диабета (особенно – сердечно-сосудистых) накладывает определенные ограничения на постановку индивидуальных целей контроля гликемии. Вышеупомянутые исследования ACCORD и VADT показали, что при наличии сердечно-сосудистых осложнений достижение нормогликемии опасно развитием гипогликемических состояний, влекущих за собой кардио- и цереброваскулярные исходы.
- Риск тяжелой гипогликемии резко ограничивает возможность строгого контроля гликемии, поскольку влечет за собой риск сердечно-сосудистых событий. По данным исследования VADT, перенесенная тяжелая гипогликемия в 4 раза повышает риск сердечно-сосудистой смертности и по значимости превосходит другие факторы риска, такие как возраст, наличие дислипидемии и сердечно-сосудистых заболеваний [6].
В группу риска развития тяжелой гипогликемии входят пациенты:
- пожилые;
- с длительным течением СД;
- с нарушенным распознаванием гипогликемии;
- со сниженной функцией почек и печени;
- получающие β-блокаторы (особенно неселективные или слабоселективные).
Таким образом, предлагаются следующие целевые значения гликемического контроля.
При отсутствии тяжелых осложнений/низком риске тяжелых гипогликемий:
- молодой возраст: ≤6,5%;
- средний возраст: ≤7,0%;
- пожилой возраст (или ОПЖ <5 лет): ≤7,5%.
При наличии тяжелых осложнений/высоком риске тяжелых гипогликемий:
- молодой возраст: ≤7,0%;
- средний возраст: ≤7,5%;
- пожилой возраст: (или ОПЖ <5 лет): ≤8,0%.
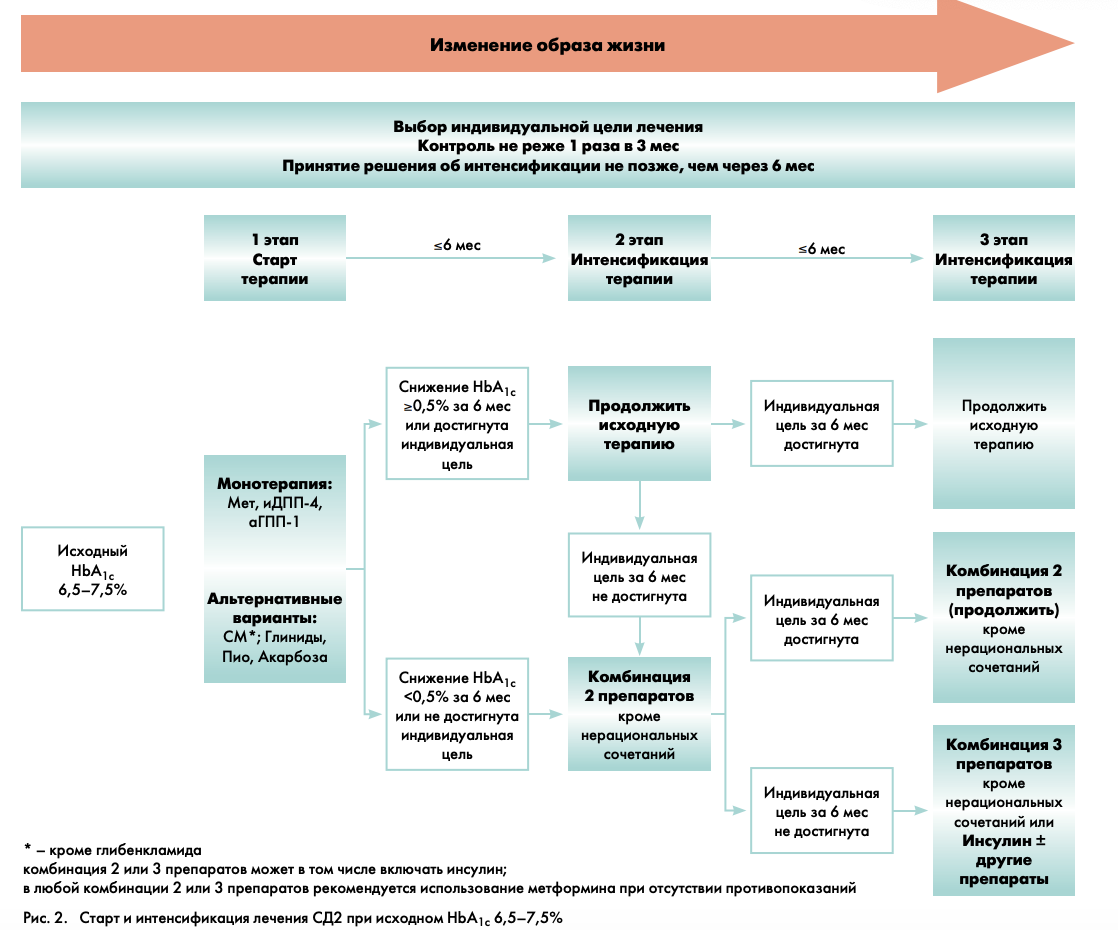
СТРАТИФИКАЦИЯ ТЕРАПЕВТИЧЕСКОЙ ТАКТИКИ ПРИ ИСХОДНОМ УРОВНЕ НBА1С 6,5–7,5%
На рис. 2. представлена схема выбора стартовой сахароснижающей терапии (1-й этап) и ее интенсификация (2-й и 3-й этапы) при исходном уровне НbА1с 6,5–7,5%.
1-Й ЭТАП – СТАРТ ТЕРАПИИ
Прежде, чем начать медикаментозную терапию, необходимо определить индивидуальное целевое значение уровня НbА1с конкретного пациента (рис. 1). В том случае, если индивидуальная цель оказалась выше указанного диапазона (это может быть у пожилых лиц с тяжелыми сосудистыми осложнениями), то следует обучить пациента правилам здорового питания и определить график наблюдения за пациентом на фоне предложенной диетотерапии.
Если же индивидуальная цель ниже или в рамках указанного диапазона НbА1с, то в этом случае диетотерапию необходимо дополнить медикаментозной монотерапией. Исходя из реальной клинической ситуации и поставленных индивидуальных целей, врач может выбрать препарат, оптимально подходящий конкретному пациенту (характеристика всех групп препаратов, используемых в современной диабетологии, представлена в приложении 2).
При выборе препарата необходимо учесть следующие факторы:
- ожидаемая сахароснижающая эффективность;
- риск гипогликемий;
- масса тела;
- возраст;
- наличие сосудистых осложнений;
- наличие сопутствующей патологии;
- длительность диабета.
Кроме того, на выбор препарата могут влиять: удобство использования, предполагаемая степень приверженности пациента к лечению, стоимость препарата.
Приоритет в этой клинической ситуации должен быть отдан средствам с минимальным риском гипогликемий. Особого внимания требует при этом группа высокого риска, часто требующая постановки индивидуальных терапевтических целей: пациенты, с выраженной макрососудистой патологией, отсутствием распознавания гипогликемий, ограниченной ожидаемой продолжительностью жизни или серьезными сопутствующими заболеваниями.
Препараты первого ряда для старта терапии:
- метформин;
- ингибиторы ДПП-4;
- агонисты рецепторов ГПП-1.
Метформин остается наиболее изученным с точки зрения эффективности и безопасности препаратом при монотерапии. Препарат не вызывает гипогликемии и прибавки массы тела. Предпочтительно назначение больным с избытком массы тела или ожирением. Обладает рядом дополнительных положительных эффектов помимо сахароснижающего (кардиопротективным, гиполипидемическим действием). Метформин рекомендован в качестве стартовой терапии всеми ведущими профессиональными сообществами диабетологов. Необходимо помнить, что наибольшая сахароснижающая эффективность метформина отмечается при достижении дозы 2000–2500 мг/сутки. Эта доза должна достигаться методом постепенной титрации по 500 мг каждую неделю (для минимизации нежелательных побочных явлений со стороны желудочно-кишечного тракта). Метформин противопоказан при нарушении функции почек (снижении скорости клубочковой фильтрации ниже 60 мл/мин), при состояниях тяжелой гипоксии (сердечной недостаточности III–IV функционального класса в соответствии с классификацией NYHA, дыхательной недостаточностью), при злоупотреблении алкоголем. При проведении рентгеноконтрастных исследований требуется временная отмена метформина c учетом риска развития контрастиндуцированной нефропатии.
Ингибиторы ДПП-4 (вилдаглиптин, ситаглиптин, саксаглиптин) – новая группа препаратов из класса инкретинов для перорального применения. Не вызывают гипогликемии и прибавки массы тела. Предположительно (доказано в эксперименте на животных) эти препараты обладают дополнительным преимуществом в отношении сохранения массы β-клеток поджелудочной железы [9, 10]. Предпочтительно назначение больным с избытком массы тела или ожирением, лицам с высоким риском гипогликемий, больным пожилого возраста. Препараты не рекомендуется применять при тяжелой почечной (скорости клубочковой фильтрации менее 30 мл/мин) и печеночной патологии. Требуется осторожность при назначении препаратов пациентам с анамнестическими указаниями на рецидивирующий панкреатит.
Агонисты рецепторов ГПП-1 (эксенатид, лираглутид) – новая группа препаратов из класса инкретинов для подкожного введения. Лираглутид – первый аналог человеческого ГПП-1, вводится один раз в сутки. Препараты не вызывают гипогликемии, снижают массу тела и артериальное давление. Предположительно (доказано в эксперименте на животных) обладают дополнительным преимуществом в отношении сохранения массы β-клеток поджелудочной железы [11, 12]. У больных с ожирением позволяют ожидать дополнительный эффект в виде снижения массы тела. Препараты не рекомендуется применять у пациентов с тяжелыми нарушениями функции почек (скоростью клубочковой фильтрации менее 30 мл/мин), нарушениями функции печени, сердечной недостаточностью III–IV функционального класса (в соответствии с классификацией NYHA), воспалительными заболеваниями кишечника; парезом желудка. Требуется осторожность при назначении препаратов пациентам с анамнестическими указаниями на рецидивирующий панкреатит.
Альтернативные препараты для старта терапии:
- препараты СМ;
- глиниды;
- тиазолидиндионы (глитазоны);
- ингибиторы альфа-глюкозидаз.
Препараты СМ при исходном уровне НbА1с 6,5–7,5% не являются средствами первого ряда. Серьезным ограничением их применения является риск развития гипогликемий и прибавка массы тела. Поэтому назначение этих препаратов при данном уровне НbА1с оправданно только при отсутствии избыточной массы тела или ожирения (что свидетельствует в пользу сниженной секреции инсулина у конкретного пациента), при наличии непереносимости или противопоказаний к применению препаратов с низким риском гипогликемии. Из препаратов СМ предпочтительно назначение гликлазида МВ или глимепирида. Препарат глибенкламид не рекомендуется в качестве стартового сахароснижающего средства, поскольку ассоциирован с наиболее высоким риском гипогликемий [13].
Глиниды (репаглинид, натеглинид) как и препараты СМ ассоциируются с риском гипогликемий и увеличением массы тела. Показаны для лиц с отсутствием избыточной массы тела или ожирения, т.е. с признаками недостаточной секреции инсулина.
ТЗД (пиоглитазон, росиглитазон). Несмотря на чрезвычайно благоприятный метаболический профиль действия (снижение инсулинорезистентности, сахароснижающий эффект без риска развития гипогликемии, гиполипидемический эффект, данные о сохранении функции β-клеток), использование этих препаратов имеет весьма серьезные ограничения. На настоящий момент росиглитазон по решению Европейской Медицинской Ассоциации (ЕМЕА) изъят с рынка в связи с негативными сердечно-сосудистыми эффектами, а в США наложены серьезные ограничения к применению этого препарата. В России применение росиглитазона прекращается с 01.01.2011 г. Поэтому единственным представителем этого класса препаратов в России остается пиоглитазон. Общим негативным эффектом глитазонов является прибавка массы тела, возможность развития отеков, повышенный риск развития переломов трубчатых костей. Пиоглитазон рекомендуется в качестве монотерапии пациентам с выраженной инсулинорезистентностью, отсутствием сердечно-сосудистой патологии в случае непереносимости или противопоказаний к применению препаратов первого ряда.
Ингибиторы альфа-глюкозидаз (акарбоза) обладают относительно скромным сахароснижающим потенциалом и выраженными побочными эффектами со стороны желудочно-кишечного тракта, что обусловливает крайне низкую приверженность к лечению у пациентов. Препарат не оказывает системного действия, не вызывает гипогликемий, снижает главным образом уровень постпрандиальной гликемии. В качестве монотерапии может быть рекомендован пациентам при непереносимости или наличии противопоказаний к препаратам первого ряда.
Инсулинотерапия при уровне НbА1с 6,5–7,5%, как правило, не требуется, однако у ряда пациентов с выраженными клиническими признаками дефицита инсулиновой секреции (отсутствие избыточной массы тела, выраженная потеря массы тела в последние месяцы, жажда, сухость, полиурия) лечение может быть начато с инсулинотерапии. Такой вариант начала СД необходимо дифференцировать с медленно прогрессирующим аутоиммунным сахарным диабетом взрослых (LADA).
2-Й ЭТАП – ИНТЕНСИФИКАЦИЯ ТЕРАПИИ
(комбинация 2 препаратов)
Принятие решения об активном действии (усилении либо принципиальном изменении терапии при ее недостаточной эффективности) следует осуществить не позже, чем через 6 мес. Однако, в случае ухудшения самочувствия пациента либо отсутствия признаков эффективности лечения решение по изменению лечения может быть принято раньше.
В случае достижения индивидуальных целей метаболического контроля или снижении уровня НbА1с более чем на 0,5% от исходного за 6 мес наблюдения используемую ранее монотерапию следует продолжить.
При отсутствии достижения индивидуальных целей гликемического контроля или при снижении уровня НbА1с менее чем на 0,5% от исходного за 6 мес наблюдения на втором этапе необходимо назначение комбинации 2 препаратов, обладающих взаимодополняющим механизмом действия.
К наиболее рациональным комбинациям сахароснижающих препаратов относятся:
- Мет+иДПП-4;
- Мет+аГПП-1;
- Мет+СМ или Глинид.
Все три комбинации одновременно уменьшают инсулинорезистентность и стимулируют секрецию инсулина. При этом комбинации Мет+иДПП-4 или Мет+аГПП-1 обладают минимальным риском гипогликемии и не сопровождаются прибавкой массы тела, а комбинация Мет+аГПП-1 приводит к ее снижению.
Акарбоза может быть использована в комбинации с другими препаратами, однако не следует ожидать существенного улучшения сахароснижающего эффекта. Кроме того, требуется особая осторожность при сочетании акарбозы и инсулина либо секретагогов, поскольку купирование гипогликемии с помощью употребления сложных углеводов в этом случае затруднено, так как акарбоза препятствует их расщеплению и всасыванию в кишечнике. В такой ситуации купирование гипогликемии возможно только при употреблении чистой глюкозы.
Необходимо помнить о нерациональных комбинациях препаратов, сочетание которых противопоказано (например, ТЗД + инсулин) или не приносит дополнительного эффекта (например, иДПП-4 + аГПП-1 и другие) (перечень нерациональных комбинаций представлен в приложении 3).
На рисунке 3 отражены все возможные комбинации сахароснижающих препаратов. Комбинация аГПП-1 с базальным инсулином в настоящее время проходит стадии клинических испытаний и пока еще не зарегистрирована.
Возможно назначение фиксированных комбинаций 2 различных препаратов. В России зарегистрированы к применению готовые комбинации: СМ+Мет и иДПП-4+Мет.
3-Й ЭТАП – ДАЛЬНЕЙШАЯ ИНТЕНСИФИКАЦИЯ ТЕРАПИИ
(комбинация 3 препаратов или инсулинотерапия)
Решение о дальнейшей интенсификации терапии должно быть принято не позднее, чем через 6 мес после 2-го этапа (контроль НbА1с при этом рекомендуется проводить 1 раз в 3 мес).
В случае достижения индивидуальных целей гликемического контроля применявшуюся ранее комбинацию 2 сахароснижающих препаратов следует продолжить.
Если двойная терапия оказалась недостаточно эффективной, даже при использовании обоих компонентов в максимально эффективной дозе, то следующим шагом будет являться попытка назначения тройной комбинации или инсулинотерапии.
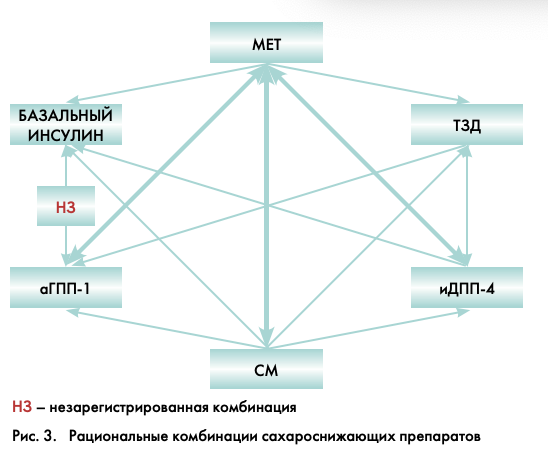
В лечении, исходя из конкретной ситуации, могут быть использованы любые сочетания препаратов (в том числе инсулин), кроме нерациональных комбинаций (рис. 3).
Метформин продолжает являться основой лечения на данном этапе, даже когда требуется интенсификация лечения и назначение инсулинотерапии. В тройной комбинации в зависимости от исходной клинической ситуации вторым и третьим компонентами могут быть препарат инкретинового ряда (иДПП-4 или аГПП-1), или препарат СМ/Глинид, или в отдельных случаях ТЗД (исключая нерациональные сочетания, перечисленные в приложении 3).
Препараты инкретинового ряда являются предпочтительным компонентом комбинированной терапии с учетом их профиля безопасности, низким риском гипогликемий и потенциальным снижением веса.
Инсулинотерапия
Если при применении комбинации 3 сахароснижающих препаратов не удается достичь эффективного контроля гликемии, то наиболее вероятно, что функциональные резервы β-клеток поджелудочной железы уже полностью истощены и необходимо проведение инсулинотерапии согласно принципам Российских рекомендаций по инициации и интенсификации инсулинотерапии [8].
Список препаратов, которые можно комбинировать с инсулином, ограничен.
Метформин в целом является достаточно безопасным препаратом для комбинации с инсулином (при отсутствии противопоказаний к метформину).
Ингибиторы ДПП-4: Вилдаглиптин возможно применять в комбинации с базальным инсулином. У остальных препаратов этой группы не зарегистрировано показание совместного применения с инсулином.
Использование ТЗД с инсулином ассоциируется с нарастанием веса, задержкой жидкости, повышенным риском сердечной недостаточности, в связи с чем эта группа препаратов не рекомендуется к совместному применению с инсулином [14].
Эффективность ингибиторов альфа-глюкозидаз не высока на этом этапе, когда требуется назначение инсулина.
Использование СМ и глинидов с инсулином требует осторожности, так как повышает риск гипогликемий. Целесообразно прекратить их прием, когда начинается терапия прандиальным инсулином.
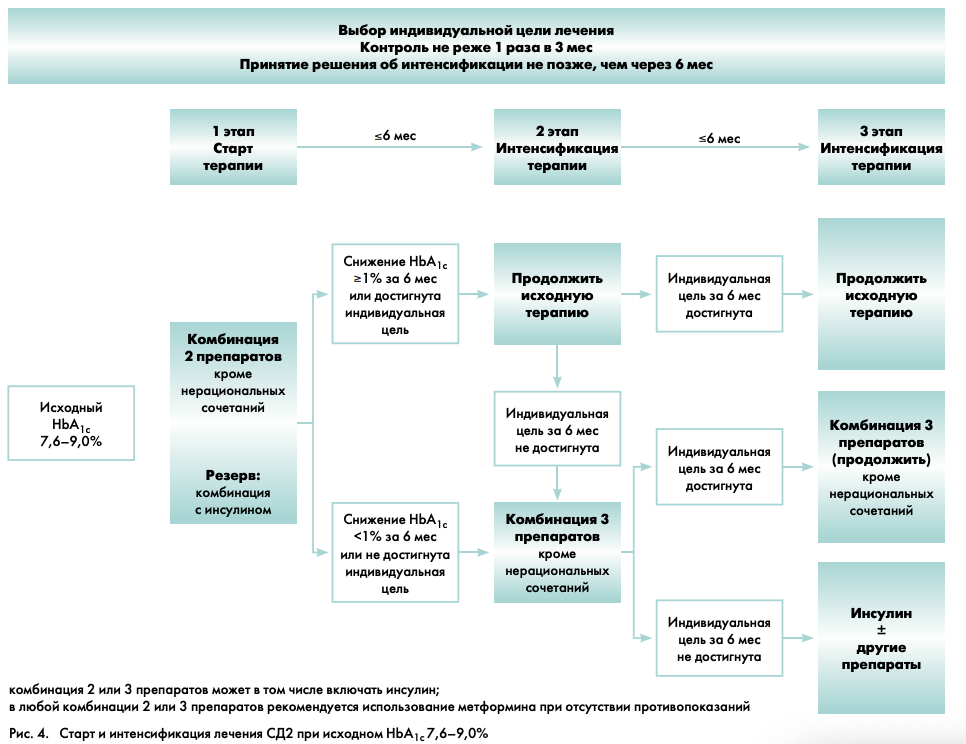
СТРАТИФИКАЦИЯ ТЕРАПЕВТИЧЕСКОЙ ТАКТИКИ ПРИ ИСХОДНОМ УРОВНЕ НBА1С 7,6–9,0%
На рис. 4. представлена схема выбора стартовой сахароснижающей терапии (1-й этап) и ее интенсификация (2-й и 3-й этапы) при исходном уровне НbА1с 7,6–9,0%.
1-Й ЭТАП – СТАРТ ТЕРАПИИ
Прежде всего, необходимо определить индивидуальное целевое значение уровня НbА1с конкретного пациента (рис. 1). В том случае, если индивидуальная цель соответствует значению указанного диапазона (например, 8,0%, что может быть у пожилых лиц с тяжелыми сосудистыми осложнениями), то следует обучить пациента правилам здорового питания, определить график наблюдения за пациентом на фоне предложенной диетотерапии. Для поддержания целевого значения НbА1с рекомендуется к диетотерапии добавить монотерапию препаратом с низким риском развития гипогликемии (метформин или иДПП-4) в минимальных (начальных) дозах.
Для пациентов с НbА1с в пределах 7,6–9,0 %, имеющих более жесткие индивидуальные целевые значения контроля гликемии, достижение этих целей назначением монотерапии не представляется возможным. В этой ситуации сразу с момента диагностики СД2 наиболее целесообразным является назначение комбинации 2 сахароснижающих препаратов, воздействующих на разные механизмы развития болезни: инсулинорезистентность и секрецию инсулина. К наиболее рациональным комбинациям относятся сочетания метформина (базового препарата, снижающего инсулинорезистентность) и препаратов, стимулирующих секрецию инсулина: иДПП-4, аГПП-1 или СМ (глиниды).
Назначение комбинаций метформина с иДПП-4 или аГПП-1 предпочтительно у лиц, входящих в группу высокого риска развития гипогликемических состояний, поскольку именно такие комбинации характеризуются минимальным риском гипогликемий. Эти же комбинации наиболее оправданы у лиц, имеющих избыточную массу тела или ожирение.
У больных с выраженной декомпенсацией углеводного обмена (при значениях НbА1с более 8,5%) предпочтение отдается комбинации метформина с препаратами СМ или с инсулином.
В зависимости от конкретной ситуации (индивидуального профиля переносимости препаратов, их побочных действий или противопоказаний) возможны и другие разрешенные комбинации сахароснижающих препаратов, указанные на рис. 3.
Назначение нерациональных комбинаций недопустимо (см. приложение 3).
2-Й ЭТАП – ИНТЕНСИФИКАЦИЯ ТЕРАПИИ
(комбинация 3 препаратов)
Принятие решения об активном действии (усилении либо принципиальном изменении терапии при ее недостаточной эффективности) следует осуществить не позже, чем через 6 мес. Однако, в случае ухудшения самочувствия пациента либо отсутствия признаков эффективности лечения решение по изменению лечения может быть принято раньше.
В случае достижения индивидуальных целей метаболического контроля или снижении уровня НbА1с более чем на 1,0% от исходного за 6 мес наблюдения, используемую ранее комбинированную терапию следует продолжить.
При отсутствии достижения индивидуальных целей гликемического контроля или при снижении уровня НbА1с менее чем на 1,0% от исходного за 6 мес наблюдения, на 2-м этапе необходимо назначение комбинации 3 препаратов, одним из которых может быть инсулин.
В любой комбинации 3 препаратов рекомендуется использование метформина (при отсутствии противопоказаний).
Назначение нерациональных комбинаций недопустимо (см. приложение 3).
3-Й ЭТАП – ДАЛЬНЕЙШАЯ ИНТЕНСИФИКАЦИЯ ТЕРАПИИ
(комбинированная инсулинотерапия)
Решение о дальнейшей интенсификации терапии должно быть принято не позднее, чем через 6 мес после 2-го этапа (контроль НbА1с при этом рекомендуется проводить 1 раз в 3 мес).
В случае достижения индивидуальных целей гликемического контроля применявшуюся ранее комбинацию 3 сахароснижающих препаратов следует продолжить.
Если комбинированная терапия оказалась недостаточно эффективной, даже при использовании 3 препаратов, то рекомендуется инициировать или интенсифицировать инсулинотерапию. Тактика назначения инсулинотерапии изложена в Российских клинических рекомендациях «Оптимизация и интенсификация инсулинотерапии при СД2 типа» 2010 г. [8].
СТРАТИФИКАЦИЯ ТЕРАПЕВТИЧЕСКОЙ ТАКТИКИ ПРИ ИСХОДНОМ УРОВНЕ НBА1С>9,0 %
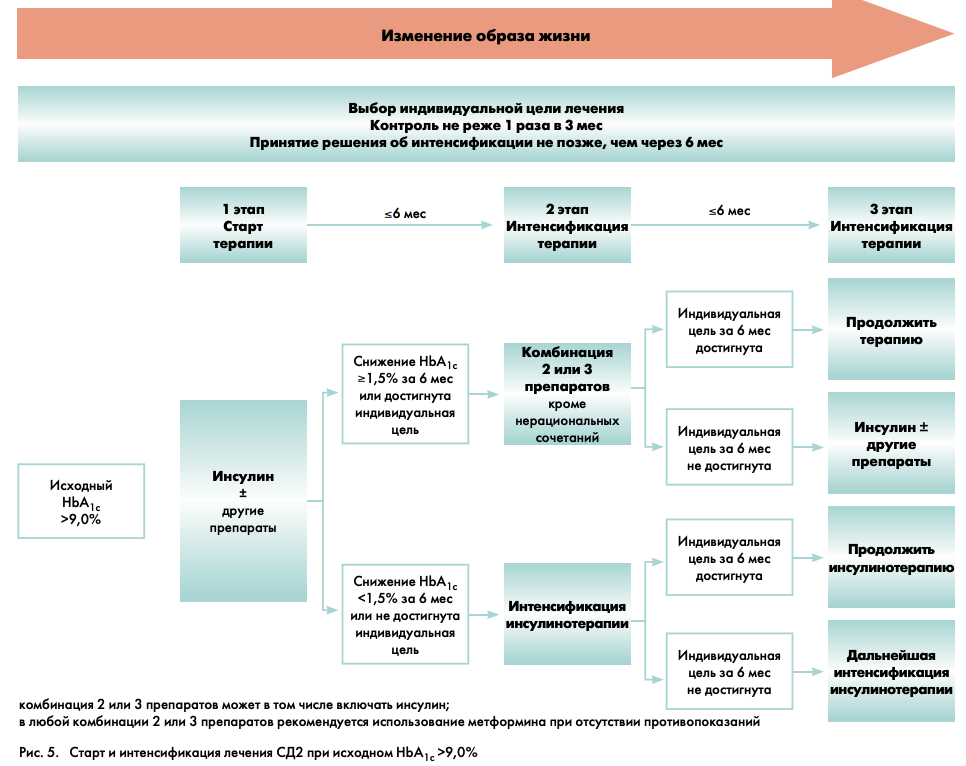
На рис. 5 представлена схема выбора стартовой сахароснижающей терапии (1-й этап) и ее интенсификация (2-й и 3-й этапы) при исходном уровне НbА1с >9%.
1-Й ЭТАП – СТАРТ ТЕРАПИИ
На старте лечения необходимо определить индивидуальное целевое значение НbА1с.
Исходный уровень НbА1с >9% в «дебюте» заболевания подразумевает необходимость срочного устранения глюкозотоксичности (т.е. токсичного воздействия глюкозы на органы и ткани, в том числе на β-клетки поджелудочной железы). Такое интенсивное снижение гликемии возможно только при назначении инсулинотерапии.
Режимы назначения инсулина могут быть различными:
- базальный инсулин в режиме одной инъекции (предпочтительно беспиковый аналог инсулина длительного действия, как наименее опасный с точки зрения развития гипогликемии) в комбинации с пероральными сахароснижающими средствами (метформином, СМ, иДПП-4);
- смешанный инсулин (в режиме одной или двух инъекций);
- базис-болюсная терапия инсулином.
Эта инсулинотерапия может носить временный характер. Если в течение короткого времени удается устранить токсическое воздействие глюкозы на поджелудочную железу, то β-клетки вновь начинают секретировать инсулин в достаточных количествах.
2-й и 3-й этапы – интенсификация терапии
Если в течение 6 мес инсулинотерапии достигнуты индивидуальные цели гликемического контроля или уровень НbА1с снизился более чем на 1,5%, то в этом случае возможен переход на комбинацию 2 или 3 сахароснижающих препаратов с отменой инсулинотерапии. Если целевой уровень гликемии сохраняется и на протяжении последующих 6 мес наблюдения, то комбинированную терапию можно продолжить. В любой комбинации 2 или 3 препаратов рекомендуется использование метформина (при отсутствии противопоказаний). Назначение нерациональных комбинаций недопустимо (см. приложение 3).
Если же за 6 мес терапии цель не достигнута или уровень НbА1с снизился менее чем на 1,5%, то терапию инсулином необходимо интенсифицировать (в соответствии с Российскими клиническими рекомендациями «Оптимизация и интенсификация инсулинотерапии при сахарном диабете 2 типа» от 2010 г.) [8].
Заключение
Настоящий консенсус призван установить приоритет индивидуального подхода к каждому пациенту. Выбор сахароснижающей терапии должны определять эффективность и безопасность. Необходимо определение индивидуальных целей лечения с учетом возраста, наличия осложнений, риска гипогликемий и стратификация терапевтической тактики в зависимости от исходного уровня метаболического контроля.
СПИСОК ЛИТЕРАТУРЫ
- Дедов И.И. Сахарный диабет: развитие технологий в диагностике, лечении и профилактике (пленарная лекция) // Сахарный диабет. - 2010. - № 3 (48). - С. 6-13.
- Nathan D.M., Buse J.B., Davidson M.B., Heine R.J., Holman R.R., Sherwin R., Zinman B. Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. - 2006. - № 29. - Р. 1963-1972.
- Nathan D.M., Buse J.B., Davidson M.B., Ferranini E., Holman R.R., Sherwin R., Zinman B. American Diabetes Association; European Association for the Study of Diabetes. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy. A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. - 2009. - № 32. - Р. 193-203.
- Miller M.E., Byington R.P., Goff D.C.Jr. et al. (Action to Control Cardiovascular Risk in Diabetes Study Group). Effects of intensive glucose lowering in type 2 diabetes // N. Engl. J. Med. - 2008. - № 358. - Р. 2545-2559.
- Patel A., MacMahon S., Chalmers J. et al. (ADVANCE Collaborative Group). Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N Engl J Med. - 2008. - № 358. - Р. 2560-2572.
- Duckworth W., Abraira C., Moritz T. et al (VADT Investigators). Glucose control and vascular complications in veterans with type 2 diabetes [published correction appears. in N Engl J Med. 2009;361:1024-1025, 1028]. N Engl J Med. 2009;360:129-139.
- Rodbard H.W., Jellinger P.S., Davidson J.A. еt al. Statement by an American Association of Clinical Endocrinologists / American College of Endocrinology Consensus Panel on Type 2 Diabetes Mellitus: An Algorithm for Glycemic Control // Endocr Pract. - 2009. - № 15(6). - Р. 540-559.
- Дедов И.И., Шестакова М.В. Оптимизация и интенсификация инсу- линотерапии при СД 2 типа (клинические рекомендации) // Сахар- ный диабет- 2010. - .Спецвыпуск. С. 9-16.
- Pospisilik J.A., Martin J., Doty T. et al. Dipeptidyl peptidase IV inhibitor treatment stimulates beta-cell survival and islet neogenesis in streptozotocin- induced diabetic rats // Diabetes. - 2003. - № 52 (3). - Р. 741-750.
- Mu J., Woods J., Zhou Y.P., Roy R.S., Li Z., Zycband E., Feng Y., Zhu L., Li C., Howard A.D., Moller D.E., Thornberry N.A., Zhang B.B. Chronic inhibition of dipeptidyl peptidase-4 with a sitagliptin analog preserves pancreatic -cell mass and function in a rodent model of type 2 diabetes // Diabetes. - 2006. - № 55. - Р. 1695-1704.
- Sturis J., Gotfredsden C.F., Romer J. et al. GLP-1 derivative liraglutide in rats with beta-cell deficiencies: influence of metabolic state on beta-cell mass dynamics // Br. J. Pharmacol. - 2003. - № 140. - Р. 123-132.
- Xu G., Stoffers D.A., Habener J.F., Bonner-Weir S. Exendin-4 stimulates both beta-cell replication and neogenesis, resulting in increasing betacell mass and improved glucose tolerance in diabetic rats // Diabetes. - 1999. - № 8. - Р. 2270-2276.
- Gangji A.S., Cukierman T., Gerstein H.C. et al. A systematic review and meta-analysis of hypoglycemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin // Diabetes Care. - 2007. - № 30. - Р. 389 -394.
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. Дедова И.И., Шестаковой М.В. Из- дание четвертое, дополненное. 4-й выпуск. М., 2009.





