Российский консенсус по терапии сахарного диабета у детей и подростков


Опубликована Май 1, 2010
Последнее обновление статьи Ноя. 22, 2022
Аннотация
В Российском консенсусе по терапии сахарного диабета (СД) детей и подростков представлены современные высокие требования к компенсации заболевания как наиболее эффективному и единственно возможному пути профилактики развития специфических сосудистых осложнений, а также пути ее достижения с помощью современных методов инсулинотерапии. Пособие содержит сведения по фармакокинетике современных видов инсулина, схемам их введения, проблемам инсулинотерапии и путям их решения. Особое внимание уделено наиболее современным и эффективным средствам лечения СД ? инсулиновым аналогам быстрого и пролонгированного действия, а также инсулиновым помпам. Подготовленный консенсус отражает современные взгляды на терапию СД у детей и подростков. Он основан на результатах значительных международных исследований и международном опыте, а также на результатах собственных исследований и большом опыте клинической работы, накопленном в отделении СД Института детской эндокринологии ФГУ Эндокринологический научный центр, где концентрируется наиболее сложный контингент больных из различных регионов нашей страны, с учетом стандартов экспертов Всемирной Организации Здравоохранения. консенсус? предназначается для специалистов, занимающихся проблемами диабета в органах здравоохранения, эндокринологов, диабетологов, педиатров и врачей общей практики.
Ключевые слова
Сахарный диабет, консенсус, алгоритмы лечения, сахароснижающая терапия, педиатрия
ВВЕДЕНИЕ
Распространенность диабета увеличивается в эпидемических масштабах во всем мире. В настоящее время в России насчитывается более 18 тыс. детей и более 9,5 тыс. подростков, страдающих сахарным диабетом 1 типа (СД1). Нарастающее увеличение заболеваемости диабетом, как ожидается, будет сопровождаться увеличением распространенности специфических осложнений - ретинопатии, нефропатии, нейропатии и заболеваний сердечно-сосудистой системы. В свою очередь, это приведет к увеличению временной нетрудоспособности, повышенной инвалидизации и смертности больных, что, в конечном счете, явится дополнительным финансовым бременем для больных и государства.
В настоящее время доказано, что развитие осложнений в наибольшей степени связано с декомпенсацией углеводного обмена. Как показали наши и зарубежные эпидемиологические исследования, в детском и подростковом возрасте распространенность специфических осложнений уже достаточно высока. Она составляет в зависимости от степени компенсации метаболических процессов и длительности СД от 5-10 до 40-50%. Патогенетические основы для развития этих осложнений у взрослых пациентов, заболевших с детства, также закладываются уже в детском возрасте.
Течение СД в детском и подростковом возрасте отличается наибольшей нестабильностью показателей углеводного обмена, что требует разработки и применения у данной категории пациентов наиболее совершенных методов терапии. Человеческие генно-инженерные инсулины и их аналоги стали золотым стандартом проводимой заместительной инсулинотерапии. В настоящее время в РФ у детей и подростков применяются только данные виды инсулинов, что является большим достижением Министерства здравоохранения и социального развития нашей страны. При этом в основном используется интенсивная схема инсулинотерапии, в том числе и у маленьких детей, как наиболее прогрессивная и позволяющая максимально имитировать физиологическую секрецию инсулина. В лечении детей всех возрастных групп последние 5 лет в нашей стране с успехом начали применяться инсулиновые помпы.
Однако для проведения успешной интенсивной терапии необходимо повышение качества и уровня медицинской помощи. Согласованные международные руководства (консенсусы) по СД у детей и подростков, подготовленные Международным обществом по диабету у детей и подростков (ISPAD), опубликованы в 1995, 2000 и 2009 гг. В 2003-2009 гг. вышел в свет ряд национальных руководств: в Австралии, Канаде, США. Настоящий консенсус подготовлен с использованием материалов последнего консенсуса ISPAD, на основании анализа литературных данных и результатов собственных научных исследований, а также большого клинического опыта НИИ детской эндокринологии ФГУ ЭНЦ Росмедтехнологий, накопленного за последние 20 лет перехода на интенсифицированную инсулинотерапию.
При решении вопросов вторичной профилактики определяющее значение имеет совершенствование методов инсулинотерапии для достижения максимальной компенсации углеводного обмена. Высокое качество применяемых инсулинов является одним из наиболее важных условий лечения СД. Помимо инсулинотерапии, лечение СД1 у детей складывается из следующих основных факторов: диета, физические нагрузки, обучение самоконтролю и проведение его в домашних условиях, психологическая помощь. Каждый из этих факторов является необходимым звеном в цепи терапевтических мероприятий.
Все это требует наиболее пристального внимания органов здравоохранения к проблемам лечения СД у детей и подростков. От успешного решения этих проблем зависит состояние здоровья больных СД в популяции в целом.
Цели инсулинотерапии
Непосредственной целью инсулинотерапии является максимально возможная имитация физиологического профиля инсулиновой секреции и достижение, таким образом, близких к норме показателей углеводного обмена.
Конечной целью инсулинотерапии является предотвращение поздних осложнений диабета, или, по крайней мере, снижение риска и сроков их развития наряду с улучшением качества жизни пациентов.
Подходы к оценке компенсации сахарного диабета
Современные стандарты терапии СД у детей и подростков отражают необходимость поддержания контроля гликемии как можно более близкого к нормальным показателям. Согласно последним рекомендациям ISPAD, уровень препрандиальной гликемии у больных СД должен находиться в пределах 5-8 ммоль/л, постпрандиальной – 5-10 ммоль/л, гликированного гемоглобина - < 7,5% (колонка «оптимальный контроль» в табл.1). Однако в детском возрасте существует высокий риск развития гипогликемических реакций, в большинстве случаев препятствующих оптимальной компенсации углеводного обмена. Близкие к норме показатели гликемии в детском возрасте в большинстве случаев достижимы только в начале заболевания, особенно в период ремиссии. При стабильном течении заболевания возможно поддержание углеводного обмена на достаточно близком к нормогликемии уровне, однако такие больные занимают лишь небольшую часть среди детей и подростков с СД.
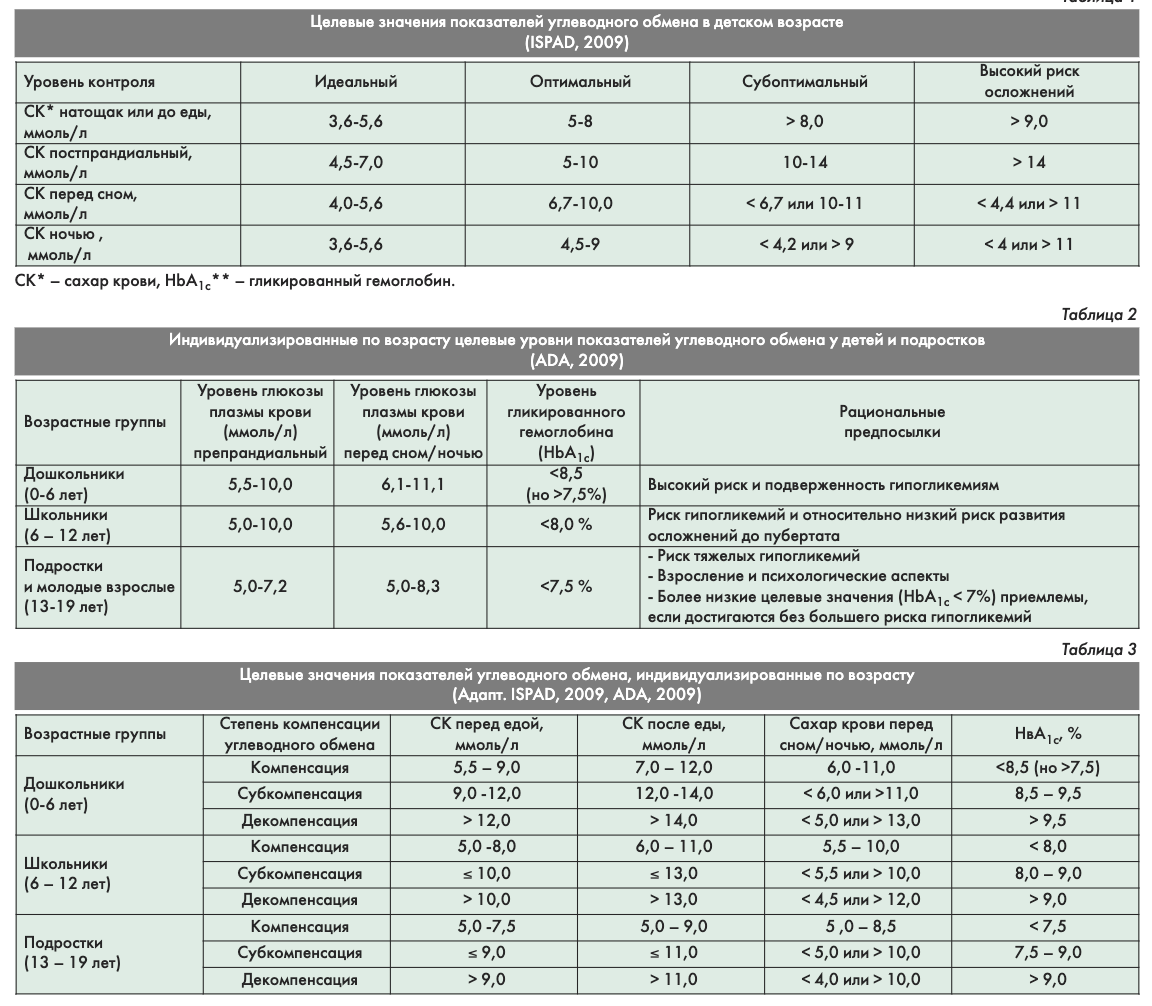
Целевые значения предназначены для ориентации в возникающих ситуациях. Однако каждому ребенку следует установить индивидуальные целевые показатели, которые были бы как можно ближе к нормальным значениям, но не приводили бы ни к тяжелым гипогликемиям, ни к частым эпизодам легкой или умеренной гипогликемии. Представленные целевые параметры, выведенные на основании исследования определенных популяций, должны быть скорректированы с учетом индивидуальных особенностей каждого пациента.
Для разных групп пациентов должны быть разные целевые параметры, например, для маленьких детей, для больных с асимптоматическими или частыми тяжелыми гипогликемиями. В связи с этим в 2009 году Американской Диабетической Ассоциацией (АDА) были предложены новые, индивидуализированные по возрасту цели контроля гликемии для детей и подростков (табл.2).
Учитывая важность использования в клинической практике обоих подходов при оценке целевых уровней гликемии (разделение на 3 фазы по степени компенсации и возрастной подход), нами предложена таблица, объединяющая эти два подхода (табл.3).
Препараты и типы инсулина
На рынке существует множество препаратов инсулина. Однако у больных СД1 особенно в детском и подростковом возрасте, назначают только высококачественные генно-инженерные человеческие инсулины и их аналоги (табл.4). Препараты свиного и говяжьего инсулина, применяемые в прошлые десятилетия, обладают высокой иммуногенностью, что ухудшало компенсацию СД, вызывало образование тяжелых липодистрофий в местах инъекций и аллергические реакции. К счастью, инсулины животного происхождения исчезают с рынка, их производство крупнейшими инсулиновыми компаниями практически прекращено.
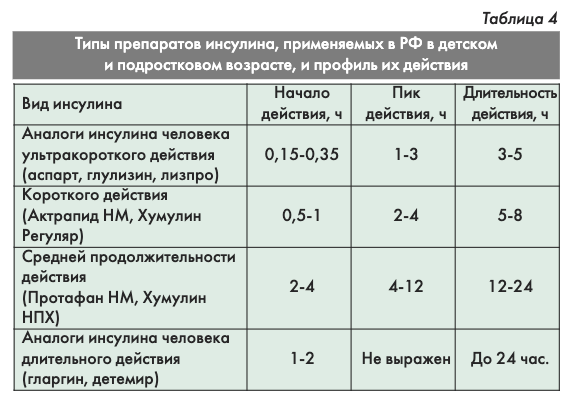
Продолжительность действия большинства инсулинов зависит от дозы, т.е. при более низкой дозе продолжительность действия препарата снижается с одновременным более ранним достижением пика концентрации инсулина.
Инсулины короткого действия используются как болюсные инъекции перед приемами пищи (за 20-30 мин. до еды) в сочетании с инсулином средней продолжительности действия, вводимом 2 раза в сутки, или с аналогом инсулина человека длительного действия, вводимом 1 или 2 раза в сутки. Инсулин короткого действия наиболее подходит для внутривенного введения, которое проводится при диабетическом кетоацидозе и при хирургических вмешательствах.
Инсулины средней продолжительности действия из-за выраженного пика максимальной концентрации нередко вводились 3-4 раза в сутки для создания относительно ровной базальной инсулинемии у больных с трудно компенсирующимся диабетом.
Проблемы заместительной инсулинотерапии
Усилия по оптимизации контроля гликемии по-прежнему остаются сложной задачей в управлении СД у детей и подростков. По итогам скрининга больных СД в различных регионах РФ, средний уровень HbA1c среди детей и подростков составляет 9,8% . При этом лишь 18,4% пациентов имели оптимальную компенсацию углеводного обмена (ср. уровень HbA1c <7,6%).
Еще недавно человеческие генно-инженерные инсулины являлись лучшими инсулинами, а их назначение – оптимальным вариантом лечения СД и ключевым фактором профилактики поздних сосудистых осложнений.
Однако, одной из причин недостаточной эффективности терапии СД1 в настоящее время является несоответствие фармакокинетики экзогенно вводимых человеческих инсулинов физиологическому профилю инсулинемии в здоровом организме: замедленная скорость всасывания и выведения коротких инсулинов заметно отличается от посталиментарной физиологической инсулинемии, а наличие пиков действия прологированных НПХ-инсулинов не позволяет обеспечить ровную базальную инсулинемию даже в случае многократного (трех- или даже четырехразового) введения.
Гипогликемия является одним из основных ограничивающих факторов в стремлении достичь оптимального контроля углеводного обмена у больных, получающих инсулин. На ранних этапах внедрения интенсивной инсулинотерапии диабета резко увеличилась частота случаев гипогликемии у подростков. С накоплением опыта ведения интенсивной терапии и с использованием аналогов инсулина человека число случаев тяжелой гипогликемии снизилось до минимальных значений. Факторами риска тяжелой гипогликемии являются: возраст пациентов (дети первых лет жизни и подростки) и увеличение длительности диабета. Перенесенные гипогликемии, истощение адреналовой и гликогеновой контррегуляции и развивающаяся автономная нейропатия приводят к развитию синдрома нечувствительности гипогликемий, который значительно утяжеляет течение сахарного диабета. Повторные гипогликемии, даже легкие или умеренные, в том числе и бессимптомные, вызывают когнитивные расстройства, снижение способности распознавать гипогликемию, повышение риска повреждений и несчастных случаев, выраженный страх возникновения новых гипогликемий, который проявляется в намеренном занижении доз инсулина, что приводит к ухудшению показателей углеводного обмена.
Гипогликемия является существенным фактором, повышающим смертность больных диабетом, в том числе и в детском возрасте. Особенно опасна ночная гипогликемия, когда во время сна ослабляется реакция системы контррегуляции. Ночная гипогликемия может привести к синдрому внезапной «смерти в постели», которая описывается у молодых людей и даже подростков с СД1.
И, наконец, проблемой в достижении компенсации СД является вариабельность ежедневных профилей действия инсулина, которая до последнего времени недостаточно учитывалась при оценке качества используемых инсулинов. Инсулины короткого действия имеют 20-30% различия в пиковых концентрациях, а пролонгированные - вдвое большие различия. Лабильность течения СД в детском и подростковом возрасте, обусловленная физиологическими, психологическими и поведенческими особенностями детского организма, в значительной степени усугубляется выраженной вариабельностью всасывания традиционных инсулинов и непредсказуемой концентрацией его в кровяном русле у больного в одно и то же время в различные дни. В свою очередь, это приводит к большой амплитуде колебания сахара крови, от гипо- до гипергликемии, и невозможности подобрать адекватную дозу инсулина.
Таким образом, несовершенство фармакокинетических и фармакодинамических свойств человеческих инсулинов, вводимых подкожно, стимулирует активный поиск и внедрение в клиническую практику новых фармакологических форм современных инсулинов.
Аналоги инсулина человека
Получение аналогов инсулинов человека с помощью современных высокотехнологичных генно-инженерных методов ознаменовало новую эру в совершенствовании инсулинотерапии.
Их особенностью является профиль действия, наиболее приближенный к физиологическому в здоровом организме. Различают ультракороткие инсулиновые аналоги, действующие подобно тому, как в здоровом организме секретируется инсулин в ответ на прием пищи, и аналоги пролонгированного, беспикового действия, имитирующие собственную достаточно ровную базальную секрецию инсулина. К первой группе аналогов относятся инсулины лизпро (Хумалог), аспарт (НовоРапид) и глулизин (Апидра). Ко второй группе – инсулины гларгин (Лантус) и детемир (Левемир). Большие международные и наши собственные исследования аналогов инсулина человека, проведенные у детей, показали, что с их помощью удается улучшить показатели углеводного обмена с одновременным снижением риска гипогликемий, что чрезвычайно важно для детей и подростков, а также улучшить качество их жизни, уменьшить ограничения в питании, создать более гибкий режим жизни, успешнее заниматься спортом, получить профессию и адаптироваться к жизни.
Аналоги инсулина человека ультракороткого действия
Для детей используется три вида аналогов инсулина человека ультракороткого действия лизпро, аспарт и глулизин (торговые названия – Хумалог, НовоРапид и Апидра). Их действие начинается раньше и длится короче, чем простого человеческого инсулина (см. табл.4).
Аналоги инсулина человека ультракороткого действия обладают следующими свойствами:
- препараты можно вводить непосредственно перед едой; они не только снижают постпрандиальную гликемию, но и уменьшают частоту возникновения ночной гипогликемии;
- препараты можно вводить и после еды – у детей с непостоянным, меняющимся аппетитом (но не позднее, чем через 15 минут после начала приема пищи);
- оказывают более быстрый (чем простой инсулин) эффект при лечении гипергликемии с наличием или отсутствием кетоза, в том числе при декомпенсации на фоне сопутствующих заболеваний;
- наиболее часто используются в качестве болюсных инъекций при приемах пищи в сочетании с базисными инсулинами (базис-болюсные режимы);
- наиболее часто используются в инсулиновых помпах.
Аналоги инсулина человека ультракороткого действия могут вводиться внутривенно, однако одинаковая эффективность в сравнении с простым инсулином и более высокая стоимость делают нецелесообразным применение их для внутривенного использования. У больных с впервые выявленным СД1 аналоги инсулина человека ультракороткого действия могут применяться сразу при постановке диагноза.
Другим клинически полезным отличием аналогов инсулина человека ультракороткого действия от инсулина короткого действияявляется меньшее влияние на скорость всасывания анатомической локализации инъекции. Кроме того, время пика и общая продолжительность действия инсулина аспарт не зависит от дозы инсулина, как это наблюдается при введении инсулина короткого действия [L.Nosek et al., IDF, 2003].
Еще одним важным свойством аналогов инсулина человека ультракороткого действия явилось снижение частоты ночных гипогликемий. Одной из частых причин гипогликемий в ночное время является шлейф действия короткого инсулина, введенного перед ужином. При замене обычного короткого инсулина быстродействующим аналогом за счет его более короткого действия возникающая в ранние ночные часы гипергликемия предотвращает развитие гипогликемии, обусловленной пиком действия пролонгированного ночного инсулина. Результаты клинических исследований показали, что перевод на аналоги инсулина человека ультракороткого действия снижает риск развития ночных гипогликемий.
Проведены большие клинические испытания, в которых сравнивали аналоги инсулина человека ультракороткого действия с человеческим инсулином короткого действия. В ряде исследований доказано достоверно меньший уровень постпрандиальной гипергликемии и снижение такого показателя компенсации углеводного обмена, как гликированный НbА1. Однако при индивидуальном анализе уровень гликированного гемоглобина снижается не у всех больных, несмотря на улучшение показателей гликемии. Этому могут быть два объяснения. Во-первых, частота легких и тяжелых гипогликемий у больных, получающих инсулин аспарт, ниже, чем у получающих инсулин короткого действия, если они используются в дозах, достаточных, чтобы получить сопоставимые уровни постпрандиальной гликемии. Во-вторых, при использовании аналогов инсулина человека ультракороткого действия в комбинации с традиционными пролонгированными инсулинами (НПХ) не создается устойчивая базисная концентрация инсулина в крови. Являющиеся результатом этого эпизоды повышения препрандиальной гликемии также в состоянии создавать более высокие показатели уровня гликированного гемоглобина, чем это можно было бы ожидать, исходя из более низкого уровня постпрандиальной гликемии. Однако при использовании в качества базисной терапии одного из аналогов инсулина человека длительного действия наблюдается более заметное снижение гликированного гемоглобина у больных, получающих ультракороткие аналоги инсулина.
Аналоги инсулина человека ультракороткого действия, воссоздавая физиологический профиль инсулинемии, позволяют получить целый ряд преимуществ в терапии СД1 у детей и подростков. Особенно ценна возможность постпрандиального назначения: подбор дозы у детей с СД1 при препрандиальном введении инсулина затруднен в связи с непредсказуемым пищевым поведением. В мультицентровом, открытом, перекрестном, 12-недельном исследовании, вовлекшем 26 детей в возрасте от 2,3 до 6,9 лет, сравнивалась эффективность и безопасность препрандиального введения человеческого инсулина короткого действия и постпрандиального введения инсулина аспарт. Уровень HbA1c – 7,7% сохранялся на протяжении всего исследования в обеих группах инсулинотерапии. Гликемический контроль при постпрандиальном введении инсулина аспарт был аналогичным таковому при препрандиальном введении инсулина короткого действия. Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов. Большинство родителей отдали предпочтение терапии инсулином аспарт и хотели бы продолжить терапию и дальше (р = 0.045 в сравнении с терапией с человеческим инсулином короткого действия) [T.Danne et al., 2005]. С марта 2005 г. НовоРапид® разрешен к применению у детей с 2-х летнего возраста.
При решении вопроса о пре- или постпрандиальном введении аналогов инсулина человека ультракороткого действия можно учитывать пищевые привычки пациентов, прием пищи в общественных местах или дома, предпочтения пациентов. В ходе открытого, перекрестного 6 недельного исследования у 76 детей (в возрасте от 6 до 17 лет) в 9 Европейских центрах, гликемический контроль при постпрандиальном введении инсулина аспарт был аналогичным таковому при препрандиальных инъекциях. Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов [T.Danne et al., 2003]. У большинства пациентов доза инсулина короткого действия при переходе на аспарт сопоставима, хотя в некоторых случаях требуется незначительная ее коррекция. В зависимости от уровня препрандиальной гликемии инсулин аспарт вводится либо непосредственно перед едой, либо не более чем за 15 минут до еды. При низких показателях гликемии, гипогликемии, а также у маленьких детей, которые много времени тратят на прием пищи, инсулин НовоРапид вводится после еды.
Большинство больных предпочитают лечение аналогами инсулина человека ультракороткого действия, мотивируя это большим удобством в употреблении (возможность делать инъекции непосредственно перед едой), быстрым сахароснижающим эффектом при случайной гипергликемии, более легким управлением диабетом в нестандартных ситуациях, уменьшением количества гипогликемических состояний, а также возможностью при желании несколько расширить диету в отношении легкоусвояемых углеводов.
Все пациенты с СД1 должны быть обеспечены препаратами аналогов инсулина человека ультракороткого действия и человеческим инсулином короткого действия для срочного лечения в случае возникновения критических ситуаций.
Аналоги инсулина человека длительного действия
Инсулин гларгин и инсулин детемир являются новыми современными аналогами инсулина человека длительного действия. Они имеют более ровный профиль и большую длительность действия, чем традиционные пролонгированные инсулины. Аналоги инсулина человека длительного действия вызывают более предсказуемый эффект с менее выраженной вариабельностью действия, чем НПХ инсулин при введении в разные дни одному и тому же больному. В нашей стране (как пока и в большинстве других стран) эти два аналога не получили формального разрешения на использовании у детей моложе 6 лет. Однако, наш собственный опыт и зарубежные публикации свидетельствуют об их успешном применении в младшей возрастной группе.
Инсулин гларгин. Продолжительность действия достигает 24 часов, однако примерно через 20 часов после введения отмечается снижение его концентрации в крови. Тем не менее, почти у всех больных инсулин гларгин вводится однократно с хорошим результатом. В единичных случаях наблюдается жжение в местах инъекции, что связано с кислым pH препарата.
Анализ литературных данных 8-летнего использования инсулина гларгин демонстрирует его эффективность при диабете как 1-го, так и 2-го типа, в том числе при лабильных формах СД1 и при инсулинорезистентности, а также у больных в послеоперационном периоде (S.Goykhman, A.Drincic, J.C.Desmangles, M.Rendell, 2009). Многочисленные исследования посвящены эффективности и безопасности применения инсулина гларгин у детей и подростков. В 24-недельном рандомизированном открытом исследовании 175 детей и подростков, разделенных на 2 группы (получавших гларгин – 76 чел. и инсулин НПХ или Ленте – 81 чел. в качестве базисного и инсулин лизпро в качестве болюса) было показано более эффективное снижение уровня гликированного гемоглобина в группе получавшей гларгин, и отсутствие различий в частоте тяжелых гипогликемиях в двух группах (H.P.Chase, S.Arslsnian, N.H.White, W.V.Tambirlane, 2008). При использовании инсулина гларгин у 90 подростков с СД1 доказано также значимое снижение вариабельности гликемии, исследованное в условиях суточного мониторирования гликемии (CGMS) (N.H.White, H.P.Chase, S.Arslsnian, W.V.Tambirlane, 2009). При CGMS-исследовании 30 пациентов в возрасте от 4 до 18 лет, проведенном через 6-8 нед после перевода на инсулин гларгин с НПХ или Ленте, отмечалось значимое снижение частоты асимптоматических гипогликемий без увеличения уровня HbA1c.
Инсулин детемир. Обладает дозозависимой длительностью действия [T.Heise et al., 2004]. При дозе 0.4 ЕД/кг, длительность действия инсулина составляла 20 ч, при дозе более 0.4 ЕД/кг - 22-24 часа. В нашей практике большинство детей и подростков вводят препарат два раза в сутки. Дети первых лет жизни нередко могут быть компенсированы однократным утренним введением инсулина в связи с низкой потребностью в базальном инсулине в ночные часы.
Преимущество использования инсулина детемир в терапии детей и подростков с СД1 было продемонстрировано в 6-месячном, мультинациональном, открытом, рандомизированном параллельном исследовании, которое проводилось в 44 центрах 16 стран Европы (K Robertson, E Shnonle, Z Gusev, L Mordhorst et al, EASD 2004). Целью исследования было сравнение эффективности инсулина детемир и НПХ у детей и подростков с СД1. Инсулины детемир или НПХ вводились 1 или 2 раза в день (в соответствии с режимом терапии до исследования); перед основными приемами пищи вводился аналог инсулина ультракороткого действия аспарт. В исследовании приняли участие 347 детей и подростков. В результате исследования были продемонстрированы следующие преимущества инсулина детемир в сравнении с инсулином НПХ:
Лучший контроль гликемии натощак
Меньшая вариабельность показателей гликемии натощак у одного и того же пациента, т.е., большая предсказуемость гликемии натощак
Значительно меньший риск ночных гипогликемий
Меньший ИМТ
В другом рандомизированном, двойном перекрестном слепом исследовании (T.Danne, N.Datz, L.Endahl et al, 2008) у 32 детей и подростков проводилось сравнение концентрации инсулина в крови в течение 16 часов после двух последовательных инъекций инсулина детемир и инсулина гларгин с интервалом в 24 часа. Доза инсулинов составляла 0,4 ед/кг массы. Получено достоверное различие коэффициента вариабельности при использовании двух инсулинов, что указывает на меньшую вариабельность всасывания инсулина детемир и ассоциировано с более предсказуемым терапевтическим эффектом
Т.о., инсулин детемир обладает меньшей вариабельностью действия по сравнению с другими базальными инсулинами. Есть две возможных причины снижения вариабельности действия препарата: так как это растворимый инсулин, не требуется ресуспензирование препарата, а также в месте инъекции не образуются преципитаты [D.Russell-Jones et al., 2004]. Кроме того, связывание с сывороточным альбумином обеспечивает очень важный буферный эффект, при котором любые изменения скорости всасывания в депо не приводят к немедленному изменению фармакодинамического ответа.
В течение многих лет проблема вариабельности инсулинов признавалась, но ее клиническая значимость не вызывала широкого интереса. Вариабельность действия инсулина приводит к непредсказуемым колебаниям уровня глюкозы в крови, повышает риск гипогликемий, ограничивает возможность достижения целевых показателей гликемии, и, в целом, может приводить к снижению мотивации у пациентов [C.L.Brand et al., 2006].
Фармакодинамические исследования показали, что инсулин детемир обладает более предсказуемым сахароснижающим эффектом, чем другие базальные инсулины [T.Pieber et al., 2002]. Предсказуемость действия препаратов инсулина во многом определяет успех аналоговой инсулинотерапии.
Важным вопросом является исследование долгосрочной эффективности применения инсулиновых аналогов. Ретроспективный анализ результатов применения инсулина детемир у 105 детей и подростков продемонстрировал значительное достоверное снижение уровня HbA1c, сохранявшееся на протяжении 30 и более мес. наблюдения. При этом отмечено снижение частоты гипогликемий с 7,6/100 пациенто-лет, наблюдавшееся в 10-летний период до использования инсулина детемир, до 4,8/100 пациенто-лет в течение 30 мес. терапии инсулином детемир (D.Braun, D.Konrad, M.Lang-Muritano, E.Schoenle, 2008).
РЕЖИМЫ ВВЕДЕНИЯ ИНСУЛИНА
Выбор режима инсулинотерапии зависит от многих факторов: возраст ребенка, длительность диабета, образ жизни (особенности питания, физические нагрузки, предпочтения семьи и пр.). Наилучшую возможность имитации физиологического профиля инсулина в крови дает базально-болюсная (базис-болюсная) концепция: инсулин продленного действия или базальный аналог 1-2 раза в сутки в сочетании с быстродействующим аналогом перед основными (иногда промежуточными) приемами пищи или постоянная базисная инфузия инсулина с помощью инсулиновой помпы. У некоторых детей в период частичной ремиссии удовлетворительный метаболический контроль может поддерживаться только введением пролонгированного инсулина 1-2 раза в сутки или только введением короткого или ультракороткого инсулина перед основными приемами пищи. Традиционная инсулинотерапия с введением пролонгированного и инсулина короткого действия 2 раза в сутки в настоящее время в РФ практически не используется в связи с худшими результатами контроля диабета и качеством жизни пациентов.
При использовании базально-болюсной схемы введения 40-60% суточной потребности в инсулине должен составлять базальный инсулин, а остальное – ультракороткий инсулин или инсулин короткого действия. При этом доза инсулина средней длительности действия, вводимого перед сном, может колебаться между 30% от суточной дозы инсулина (при использовании в качестве болюса инсулина короткого действия) и 50% (при использовании аналога инсулина человека ультракороткого действия). При использовании в качестве болюса аналога инсулина человека ультракороткого действия доля пролонгированного инсулина обычно больше, чем при использовании человеческого инсулина короткого действия, так как вследствие более продолжительного действия последний в определенной степени оказывает еще и базальный эффект.
Базис-болюсная аналоговая терапия: результаты клинических исследований
Многочисленные исследования продемонстрировали клинически значимые преимущества базис-болюсной аналоговой терапии в сравнении с интенсифицированной инсулинотерапией традиционными препаратами инсулина у взрослых, а затем подтверждены и у детей.
В 26-недельном, мультинациональном, открытом, рандомизированном, параллельном исследовании сравнивалась эффективность инсулина детемир и НПХ у 347 детей и подростков с СД1 (K.Robertson et al., 2007). Инсулин детемир или НПХ вводился 1 или 2 раза в день (в соответствии с режимом терапии до исследования); перед основными приемами пищи вводился аналог инсулина человека ультракороткого действия аспарт. В исследовании приняли участие 140 пациентов препубертатного возраста и 207 – в период пубертата, с исходными показателями HbA1c 8,8 ± 1,2%, в возрасте 11,9 ± 2,8 года, с ИМТ 19,2 ± 2,8кг/м2, длительностью диабета от 1 до 15 лет.
Показатели HbA1c снизились на 0,8% и достигли 8,0% у всех пациентов, при этом, средняя групповая разница составила (детемир-НПХ)=0,09 [95% ДИ: -0,12, 0,29]. Уровень глюкозы в плазме натощак был достоверно ниже на фоне терапии инсулином детемир, - 8,44ммоль/л, в сравнении с инсулином НПХ 9,58 ммоль/л, р=0,022. Интра-индивидуальная вариабельность глюкозы плазмы натощак также была значимо ниже в группе терапии инсулином детемир (3,32ммоль/л) в сравнении с НПХ (4,29 ммоль/л) соответственно, р<0,001. Профили глюкозы плазмы (8 точек измерений) и значения глюкозы плазмы ночью были схожими в обеих группах терапии (р=0,302 и р=0,194, соответственно). Общий риск гипогликемий был одинаковым для инсулина детемир и НПХ (р=0,351), в то время как риск ночных гипогликемий (22:00 – 07:00) был значимо, на 36%, ниже в группе базальной терапии инсулином детемир, чем на НПХ (р=0,011). В конце исследования ИМТ был меньше на инсулине детемир (19,3кг/м2 в ср. с 19,8 кг/м2 на НПХ, р=0,001). Общая безопасность терапии инсулином детемир была такая же, как у НПХ.
Таким образом, исследование у детей и подростков с СД1 показало, что сочетание инсулина детемир и инсулина аспарт в базис-болюсной терапии позволяет реализовать преимущества каждого препарата и получить более выраженный клинический эффект в сравнении с инсулином НПХ в качестве базальной терапии: достоверно лучшие показатели гликемии натощак, значительно меньшую интра-индивидуальную вариабельность глюкозы натощак, снижение риска ночных гипогликемий и отсутствие увеличения массы тела [K.Robertson et al., 2004].
Важным аспектом гибкости терапии у детей и подростков является возможность однократного или двукратного дозирования инсулина детемир, в зависимости от индивидуальных потребностей пациента. Результаты исследований показывают, что потребность в базальном инсулине в течение суток может варьировать у разных возрастных групп в значительной степени. В частности, у молодых пациентов, в возрасте до 20 лет, потребность в базальном инсулине относительно выше в ночные часы, снижается в поздние утренние часы, и постепенно повышается во второй половине дня [G.Scheiner, B.A.Boyer,2005]. В связи с этим, возможность индивидуального дозирования инсулина Левемир позволяет подбирать базальную терапию в зависимости от потребности данного конкретного пациента в базальном инсулине.
Несомненную значимость представляет подтверждение результатов мультицентровых рандомизированных клинических испытаний в условиях повседневной клинической практики. С этой точки зрения актуальность представляют результаты PREDICTIVE™ - многоцентрового, наблюдательного исследования в повседневной клинической практике, в которое вошли 241 ребенок в возрасте от 0 до 11 лет и 532 подростка в возрасте от 11 до 18 лет. Основная предпосылка исследования PREDICTIVE™ у детей и подростков с СД – возможность достижения целевого контроля без повышения риска гипогликемий. В результате было доказано значительное улучшение контроля гликемии и снижение риска гипогликемий в обеих возрастных группах. Это исследование позволило сделать вывод, что в отличие от инсулина НПХ инсулин детемир обеспечивает предсказуемый, эффективный контроль гликемии и низкий риск ночных гипогликемий (A.Robinson et al. ISPAD, 2007).
Чтобы не допустить перерывов в лечении СД1, чрезвычайно важно у детей и подростков иметь постоянно небольшой запас инсулина в домашних условиях. Поэтому запас инсулина у пациента с диабетом должен составлять не меньше месяца его потребности, в отдельных случаях, при необходимости - до 3-месячной потребности. При выписке очередного рецепта на инсулин обязательно присутствие пациента.
КОРРЕКЦИЯ ИНСУЛИНОТЕРАПИИ
Суточная доза инсулина. В течение фазы частичной ремиссии суточная потребность в инсулине обычно не превышает 0,5 ед/кг/сут. В дальнейшем в допубертатном возрасте потребность в инсулине составляет в большинстве случаев 0,7-1,0 ед/кг/сут. В период полового созревания потребность может увеличиться выше 1 ед/кг/сут, достигая 1,5 и даже 2 ед/кг/сут.
Адекватная доза инсулина – та, при которой удается достичь наилучшего гликемического контроля у данного пациента без риска выраженных гипогликемий, гармоничного физического и полового развития.
Инсулин гларгин чаще назначается один раз в день, он может вводиться перед завтраком, обедом или в вечерние часы. Два раза в сутки он вводится иногда при лабильном течении диабета. По нашему опыту, у подростков наиболее эффективным является введение его на ночь, у детей допубертатного возраста часто хороший эффект дает утреннее введение препарата. По имеющимся данным, ночные гипогликемии встречаются намного реже при назначении инсулина гларгин перед завтраком. При переводе на инсулин гларгин во избежание гипогликемий требуется снижение суммарной дозы используемого базального инсулина примерно на 20% с последующей ее титрацией.
Инсулин детемир чаще назначается два раза в день – перед завтраком и перед ужином или пред сном. Маленьким детям с их невысокой потребностью в ночном базисном инсулине иногда бывает достаточным только утреннее введение инсулина детемир. При переводе с инсулина НПХ начальная доза инсулина детемир не меняется.
Титрация дозы инсулина проводится до достижения целевых уровней гликемии без риска значимых гипогликемий.
При повышенном уровне гликемии перед завтраком проводится увеличение дозы вечернего базального инсулина, с учетом гликемии в вечерние и ночные часы. При утренней постгипогликемической гипергликемии дозу базального инсулина требуется снизить. В процессе подбора дозы вечернего базального инсулина необходим контроль гликемии в ночные часы.
При повышенном уровне гликемии после еды соответственно увеличивается доза короткого инсулина или аналога инсулина человека ультракороткого действия перед данным приемом пищи.
При повышенном уровне гликемии перед обедом или ужином требуется увеличить дозу утреннего базального инсулина (либо дозу прандиального инсулина, если позволяет уровень постпраниальной гликемии). Постоянно повышенный уровень гликемии может потребовать изменение соотношения инсулин/хлебные единицы (ХЕ).
При переходе на аналог инсулина человека ультракороткого действия в базисно-болюсном режиме, возможно, потребуется изменение дозы и/или типа базального инсулина.
При коррекции дозы прандиального инсулина на определенный уровень препрандиальной гликемии можно использовать «правило 100». Для этого необходимо 100 разделить на общую суточную дозу инсулина, получаемое число означает количество ммоль/л, на которое снизится гликемия при введении 1 ед. аналога инсулина человека ультракороткого действия (то есть чувствительность к инсулину). При этом необходимо учитывать, что чувствительность к инсулину – очень вариабельный показатель: она может снижаться при постгипогликемической гипергликемии, стрессе, декомпенсации диабета и пр. Значительно повышают чувствительность к инсулину физические нагрузки, низкий уровень гликемии.
РЕКОМЕНДАЦИИ ПО МОНИТОРИНГУ ГЛИКЕМИИ
Самоконтроль гликемии является важнейшим условием оптимального ведения детей и подростков и должен быть доступен для всех больных диабетом детей. Исследование уровня гликемии следует проводить достаточно часто, поскольку частота определений гликемии коррелирует с эффективностью гликемического контроля. Желательно ежедневное определение гликемического профиля в 4 точках (перед завтраком, обедом, ужином и на ночь). Количество определений возрастает при декомпенсации СД, интеркуррентных заболеваниях, нестандартных ситуациях, физических нагрузках и пр. Специалисты диабетологических центров должны объяснять представителям органов здравоохранения необходимость помощи пациентам детского возраста в снабжении средствами самоконтроля в достаточном количестве. Следует признать, что без строгого контроля значительно возрастает риск развития острых и хронических осложнений СД, приводящих к инвалидизации больных, что требует больших затрат системы здравоохранения.
Острые осложнения сахарного диабета
Диабетический кетоацидоз (ДКА) развивается вследствие абсолютного или относительного дефицита инсулина в сочетании с влиянием контринсулярных гормонов. В дебюте СД ДКА чаще развивается у детей первых 5 лет жизни, а также в случаях недостаточного доступа к медицинской помощи по социальным причинам. У детей с длительным диабетом ДКА развивается в случаях плохого метаболического контроля, у девочек пубертатного возраста, у детей из «неблагополучных» семей, у детей, пропускающих инъекции инсулина, при ограниченном доступе медицинской помощи, а также при использовании инсулиновых помп, когда по какой-либо причине прекращается поступление инсулина, и вследствие использования ультракороткого или короткого инсулина быстро развивается его абсолютный дефицит.
Тяжелый ДКА — это угрожающее жизни осложнение, требующее неотложных мер, включающих в первую очередь борьбу с дегидратацией, устранение инсулиновой недостаточности, коррекцию ацидоза и рецидивирующего кетоза, восстановление оптимального уровня гликемии. Помощь детям и подросткам с тяжелым ДКА должна оказываться в специализированных центрах, обладающих штатом и средствами для частого мониторинга жизненно важных функций, неврологического статуса и лабораторных показателей, позволяющих проводить не только борьбу с ДКА, но и предотвращать осложнения проводимой терапии, диагностировать и проводить лечение различных явлений, ухудшающих состояние больного.
Гипогликемия и гипогликемическая кома.
Гипогликемия — это такой низкий уровень глюкозы в крови, при котором создаются условия, причиняющие ущерб здоровью ребенка. Общепризнано, что при концентрации глюкозы в крови ниже 3,3-3,9 ммоль/л больного относят к группе высокого риска тяжелой гипогликемии. В связи с этим целесообразно уровень гликемии 4 ммоль/л считать предельным для ребенка с СД, как мы указывали ранее в целевых значениях оптимального контроля. Различают ле гкую/у мере иную гипогликемию (в том числе асимптоматическую) и тяжелую. Легкая/умеренная гипогликемия хорошо купируются пероральным приемом легкоусвояемых углеводов. Тяжелая гипогликемия сопровождается частичным или полным нарушением сознания, с судорогами, вплоть до развития коматозного состояния, и требует неотложного парентерального лечения (глюкоза в/в или глюкагон в/м или п/к). Тяжелая гипогликемия является угрожающим для жизни состоянием!
Факторы риска развития гипогликемий: нарушения режима терапии (повышение доз инсулина, недостаточное потребление пищи, физические нагрузки), маленький возраст ребенка, низкий уровень НЬА1с, частые гипогликемии, асимптоматические гипогликемии, ночное время, употребление алкоголя.
Для профилактики гипогликемий каждый ребенок (подросток) с СД должен всегда иметь при себе источник быстро действующей глюкозы и глюкогон (Гликоген Гипокит). Каждый случай гипогликемии требует обязательного анализа ее причин и принятия мер по ее предотвращению в будущем.
Применение аналого инсулина человека ультра-, короткого и длительного действия или инсулиновой помпы может снизить риск развития гипогликемии, особенно в ночные часы.
Устройства для введения инсулина
Инсулиновые шприц-ручки. Подавляющее большинство детей и подростков в нашей стране вводят инсулин с помощью специальных шприц-ручек с заполненными инсулинами картриджами. При этом отпадает необходимость набирать препарат из флакона, а доза выставляется поворотом шкалы. Они наиболее удобны в обращении, в том числе и для введения инсулина вне дома, обеспечивают наиболее точное дозирование инсулина по сравнению с одноразовыми шприцами.
Инсулиновые помпы
В последние годы значительно возросло использование инсулиновых помп в терапии СД у детей и подростков. Этот рост в первую очередь связан с использованием в них аналогов инсулина человека ультракороткого действия. В отличие от подкожного введения, при внутривенных вливаниях не отмечено никакого преимущества мономерных аналогов по сравнению с человеческим инсулином короткого действия. При подкожном введении в настоящее время в помпах используется в основном аналоги инсулина человека ультракороткого действия. По данным мета-анализа, уровень НЬА1с при их использовании в помповой терапии на 0,26% ниже, чем при использовании человеческого инсулина короткого действия. При этом было доказано, что инсулин аспарт хорошо переносится при введении с помощью помпы, хорошо с ней совместим, имеет меньшую частоту кристаллизации, чем растворимый человеческий инсулин.
Применение инсулиновых помп позволяет улучшить контроль гликемии, особенно у детей с плохим контролем в анамнезе, с одновременным снижением риска тяжелых гипогликемий. Последние исследования свидетельствуют не только об улучшении метаболического контроля, подтвержденного данными CGMS, но и об улуч шении качества жизни пациентов на терапии помпой. В краткосрочном исследовании у детей и подростков терапия инсулиновым аналогом НовоРа- пид® в инсулиновой помпе обеспечила лучший контроль НЬА1с и меньший прирост гликемии в сравнении с базис-болюсной терапией инсулиновыми аналогами.
Заключение
Проводимая в последние годы терапия СД с помощью инсулиновых аналогов является новым, эффективным и безопасным методом лечения, позволяющим у многих больных добиваться целевых уровней углеводного обмена при одновременном снижении риска гипогликемий. Современная инсулиновая помпа является новым средством введения экзогенного инсулина, позволяющая больному СД улучшить течение заболевания и компенсацию углеводного обмена без повышения риска гипогликемий, а также избавиться от многократных ежедневных инъекций. В итоге конечной целью перевода больных на инсулиновые аналоги, а также применения инсулиновых помп является профилактика специфических осложнений и повышение качества жизни детей и подростков с СД.
Аналоги инсулина человека ультракороткого и длительного действия в настоящее время признаны всем мировым медицинским сообществом как лучшие инсулиновые препараты, том числе и для применения в педиатрическое практике.
Они рекомендованы к применению Американской Диабетической Ассоциацией в 2005 г.: «Комбинация быстродействующего инсулинового аналога и длительно действующего инсулина с отсутствием пика действия является отличным выбором для базис-болюсной инсулинотерапии у детей и подростков» (ADA statement, Diabetes Care, V 28, N 1, 2005). Применение инсулиновых аналогов ультракороткого действия и беспиковых пролонгированных аналогов в детской практике также рекомендуется ISPAD Clinical Practice Consensus Guidelines 2006-2007 (Pediatric Diabetes, V 8, 88-102,2007).
В России у детей и подростков в последние годы рекомендованы к применению только человеческие генно-инженерные инсулины и аналоги инсулина человека, обеспечивающие лучший контроль гликемии и повышение качества жизни пациентов. Около 90% детей и подростков с СД в РФ получают аналоги. Повышается количество детей, получающих терапию с помощью инсулиновых помп. В результате оптимизации инсулинотерапии происходит постепенное улучшение основного показателя компенсации СД - уровня гликированного гемоглобина в целом в популяциях детей и подростков. Широкое внедрение инсулиновых аналогов в практическое здравоохранение позволяет предотвращать либо значительно замедлять сроки развития тяжелых сосудистых осложнений, снижать инвалидизацию и значительно продлевать жизнь пациентов с СД.
В обсуждении основных положений консенсуса принимал и участие ведущие детские эндокринологи России: Алексеева А.Д. (Кемерово), Алексюшина Л.А. (Омск), Башнина Е.Б. (Санкт-Петербург), Безлепкина О.Б. (Москва), Безрукова Ж.Г. (Вологда), Галкина ГА. (Ростов-на Дону), Гогадзе И.В. (Астрахань), Данилова Г.И. (Якутск), Дианов О А. (Тверь), Духарева О.В. (Москва), Егорова С.В. (Хабаровск), Емельянов А.О. (Москва), Знаменская Т.Е. (Чита), Иванова НЕ. (Москва), Исаева У.С. (Грозный), Квашнина-Самарина Т.Б. (Москва), КияевА.В. (Екатеринбург), Коваленко Т.В. (Ижевск), Коваренко МА. (Новосибирск), Кострова ИБ. (Махачкала), Кузнецова НА. (Сыктывкар), Кузнецова Т.О. (Курск), Кулагина Е.П. (Оренбург), Мали- евский ОА. (Уфа), Матяж И.В. (Москва), Михайлова Е.Е (Самара), Михайлова НЕ (Москва), Нагаева Е.В. (Москва), Новицкая А.И. (Москва), Нурмухаметова Д.С. (Уфа), Полянская В.Б. (Москва), Попова Т.М. (Челябинск), Свинарев М.Ю. (Саратов), Сибилева Е.Н. (Архангельск), Солдатова Ю.Е (Псков), Степанова ИМ. (Тольятти), Султанова Л.М. (Казань), Тарану- шенко Т.Е. (Красноярск), Тверитнева О.Ю. (Тамбов), Туз В.В. (Ярославль), Федотова Ю.В. (Москва), Филимонова А.Ю. (Рязань), Фролова И.В. (Владимир), Храмова Е.Б. (Тюмень), Черняк И.Ю. (Краснодар), Чикулаева О А. (Москва), Чистоусова Г.И. (Пермь), Шапкина Л.А. (Владивосток).
СПИСОК ЛИТЕРАТУРЫ
1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под редакцией И.И. Дедова, М.В. Шестаковой. Издание 4-е. Москва, 2009. - 103 с.
2. Дедов И.И., Шестакова М.В. Сахарный диабет. М.: Универсум Паблишинг. - 2003.455 с.
3. American Association of Clinical Endocrinologists. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the management of diabetes mellitus. Endocr Pract. 2007; 13 (suppl 1):1-68.
4. American Diabetes Association. Standards of medical care in diabetes. Diabetes Care. 2009; 32 (Suppl 1):S13-S61.
5. A Position Statement of the American Diabetes Association and a Scientific Statement of the American College of Cardiology Foundation and the American Heart Association Journal of the American College of Cardiology Vol. 53, No. 3, 2009
6. Canadian Diabetes Association. 2008 Clinical Practice Guidelines for the prevention and management of diabetes in Canada. Can О Diabetes 2008, 32 (1): S1-S201.
7. Guidelines on diabetes, prediabetes and cardiovascular disease. The Task Force on diabetes and cardiovascular disease of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Eur Heart Journal Supplements 2007; 9 (Suppl C):C3-C74.
8. International Diabetes Federation. Guideline for management of postmeal glucose. 2007.
9. Cefalu W.T. Glycemic Targets and Cardiovascular Disease. N Engl J Med. June 12, 2008;.358:2633-5
10. Brunton S.A., Davis S.N., Renda S.M. Early intervention to achieve optimal outcomes in type 2 diabetes: a case presentation. Clin Cornerstone. 2006; 8 (suppl 2):S6-S18.
11. Gerstein H.C., Miller M.E., Byington R.P., et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008; 358:2545-2559.
12. Hermansen K. et al. A 26-Week, Randomized, Parallel, Treat-to-Target Trial Comparing Insulin Detemir With NPH Insulin as Add-On Therapy to Oral Glucose-Lowering Drugs in Insulin-Na•ve People With Type 2 Diabetes. Diabetes Care 2006; 29:1269-1274.
13. Holman R.R., Thorne K.I., Farmer A.J. et al. 4-T Study Group. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N Engl J Med. 2007; 357:1716-30.
14. Holman R.R., Paul S.K., Bethel M.A. et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008; 359:1577- 89.
15. How to initiate, titrate, and intensify insulin treatment in type 2 diabetes. US Pharm. October 2007; 32(10):10-16.
16. Hoogwerf B.J. Does intensive therapy of type 2 diabetes help or harm? Seeking accord on ACCORD. Cleveland Clinical Journal of Medicine. October 2008; 75(10): 729-737.
17. Medical Platform, Top-level Titration Guidelines Final version 3; 2008.
18. Mooradian A.D., Bernbaum M., Albert S.G. Narrative Review: A Rational Approach to Starting Insulin Therapy. Ann Intern Med. 2006; 145:125-134.
19. Nathan D.M. Finding new treatments for diabetes-how many, how fast … how good? N Engl J Med. 2007; 356:437-440.
20. Nathan D.M., Ferrannini E., Holman R.R. et al. Medical management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy. Diabetologia. 2009; 52:17-30.
21. Philis-Tsimikas A. et al. Study 1632. A comparison of once-daily insulin detemir with NPH insulin when added to oral antidiabetic drags in poorly controlled type 2 diabetes. Clin Ther 2006; 28:1569-1581.
22. Raskin P. et al. Initiating insulin therapy in type 2 diabetes. Diabetes Care 2005; 28:260-265.
23. Raskin P.R., Hollander P.A., Lewin A., Gabbay R.A., Bode B., Garber A.J., on behalf of the INITIATE Study Group. Basal insulin or premix analogue therapy in type 2 diabetes patients. Eur J Intern Med. 2007;18:56-62.
24. Ret J. et al. Patients with type 2 diabetes can achieve A1C targets with once-daily biphasic insulin aspart 70/30 (NovoLog Mix 70/30) before supper. Diabetes 2004; 53(suppl.2):A130.
25. Robertson C. Physiologic insulin replacement in type 2 diabetes: optimizing postprandial glucose control. Diabetes Educ. 2006; 32:423-432.
26. Rodbard H.W., Jellinger P.S., Davidson J.A. et al. Statement by an American Association of Clinical Endocrinologists / American College of Endocrinology Consensus Panel on Type 2 Diabetes Mellitus: An Algorithm for Glycemic Control. Endocr Pract. 2009;15 (No. 6): 541-559.
27. Rosenstock J. et al. A randomised, 52-week, treat-to-target trial comparing insulin detemir with insulin glargine when administered as add-on to glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetologia 2008; 51:408-416.
28. Skyler J.S, Bergenstal R., Bonow R.O. et al. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA Diabetes Trials. Diabetes Care. 2009; 32: 187-192.
29. Tamas et al. Diabetes Res Clin Pract 2001; 54:105-14.
30. The Action to Control Cardiovascular Risk in Diabetes Study Group, Gerstein H.C., Miller M.E., Byington R.P. et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. June 12, 2008; 358:2545-59.
31. The ADVANCE Collaborative Group, Patel A., MacMahon S., Chalmers J. et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. June 12, 2008; 358:2560 -72.





