Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021


Published: March 1, 2021
Latest article update: Nov. 25, 2022
Abstract
ОБОСНОВАНИЕ. Одним из приоритетных направлений развития системы здравоохранения является снижение медико-социального ущерба, обусловленного ростом распространенности сахарного диабета (СД), что обосновывает актуальность развития регистра СД в качестве основной информационно-аналитической платформы клинико-эпидемиологического мониторинга СД в Российской Федерации (РФ).
ЦЕЛЬ. Провести динамический (2016–2020 гг.) анализ эпидемиологических характеристик СД в РФ (распространенности, заболеваемости, смертности), распространенности осложнений, состояния углеводного обмена (по уровню гликированного гемоглобина (HbA1c)) и динамики структуры сахароснижающей терапии (ССТ) по данным Федерального регистра СД (ФРСД).
МАТЕРИАЛЫ И МЕТОДЫ. Объект исследования: база данных регистра СД (http://diaregistry.ru), включающая 84 региона РФ. Данные представлены в динамике 2016–2020 гг.
РЕЗУЛЬТАТЫ. Общая численность пациентов с СД в РФ, состоящих на диспансерном учете, на 01.01.2021 г., по данным регистра, составила 4 799 552 (3,23% населения РФ), из них: СД1 — 5,5% (265,4 тыс.), СД2 — 92,5% (4,43 млн), другие типы СД — 2,0% (99,3 тыс.). Динамика распространенности составила при СД1 168,7→180,9/100 тыс. населения, при СД2 2709→3022/100 тыс. населения; заболеваемости — при СД1 10,5→7,7/100 тыс. населения, при СД2 219,6→154,2/100 тыс. населения. Половозрастные характеристики: доля мужчин при СД1 54%, при СД2 30%; наибольшая доля пациентов с СД1 в возрасте 30–39 лет, с СД2 — 65–69 лет. Смертность: СД1 3,0→2,7/100 тыс. населения, СД2 87,7→93,9/100. тыс. населения, основная доля приходится на сердечно-сосудистые причины: при СД1 38,1%, при СД2 52,0%. Средний возраст смерти при СД1 составил 53,2 года, в динамике у мужчин 50,7→ 50,5 года, у женщин 58,7→ 55,2 года; при СД2 73,5 года, у мужчин 70,2→70,1 лет, у женщин 75,7→75,4 года. Средняя длительность СД до момента смерти пациентов: при СД1 17,4→19,0 года; при СД2 11→11,4 года. Частота диабетических осложнений при СД1 и СД2: нейропатии 43,3% и 24,4%, нефропатии 25,9% и 18,4%, ретинопатии 31,7% и 13,5% соответственно. Доля пациентов с HbA1c <7%: при СД1 32,3%→36,9%, при СД2 51,9%→52,1%, с HbA1c ≥9,0%: при СД1 23,1%→18,7%, при СД2 8,9%→8,0%. Структура терапии при СД2: пероральные сахароснижающие препараты (ССП) — 76,2% пациентов (монотерапия — 44,1%; комбинация 2-х ССП — 28,9%, 3-х препаратов — 3,2%), инсулинотерапия — 18,8%, без медикаментозной терапии — 4,9%.
ЗАКЛЮЧЕНИЕ. Выполненный анализ демонстрирует важность динамической оценки эпидемиологических характеристик и мониторинга клинических данных о пациентах с СД посредством регистра для оценки качества оказания диабетологической помощи и перспектив ее развития.
Keywords
Заболеваемость, распространенность, смертность, сахароснижающая терапия, регистр сахарного диабета (ФРСД), сахарный диабет (СД)
Сахарный диабет (СД) относится к категории социально значимых неинфекционных заболеваний с эпидемическими темпами роста распространенности. По последним данным Международной федерации диабета (International Diabetes Federation, IDF), количество пациентов с СД в мире достигло 463 млн, что опередило ранее прогнозируемые темпы прироста на 10–12 лет, а к 2045 г. ожидается увеличение на 51%, до 700 млн человек [1]. В Российской Федерации (РФ), как и во многих странах мира, продолжается рост распространенности СД — с 2000 г. численность пациентов с СД увеличилась более чем в 2 раза [2].
В РФ в 1996 г. в рамках Федеральной целевой программы «Сахарный диабет» был организован общенациональный Федеральный регистр пациентов с СД (ФРСД) [3]. С 2014 г. ФРСД был переведен в онлайн-формат ввода данных, что позволило осуществлять клинико-эпидемиологический мониторинг ключевых показателей заболевания в режиме реального времени в масштабах всей страны. За прошедшие 25 лет работа регистра сыграла ключевую роль в оценке распространенности СД и диабетических осложнений. Потенциал практического применения регистра связан с его использованием не только в качестве статистической системы эпидемиологических характеристик СД, но именно ключевых клинико-практических аспектов: анализа сахароснижающей терапии (ССТ), ее соответствия клиническим рекомендациям, внедрения инновационных препаратов и других клинических и организационных показателей диабетологической службы.
Опыт работы в течение 2020 г. в условиях пандемии новой коронавирусной инфекции (COVID-19) показал преимущества регистра как системы непрерывного мониторинга с СД в режиме реального времени в плане наиболее эффективной стратегии ведения пациентов для снижения риска неблагоприятных исходов [4].
Задачи регистра СД в рамках основных направлений деятельности НМИЦ включают:
- оценку распространенности СД и диабетических осложнений в России в целом и в субъектах РФ;
- анализ заболеваемости СД;
- анализ уровня и причин смертности пациентов с СД;
- оценку потребности в лекарственных препаратах и средствах самоконтроля;
- анализ соответствия ССТ в реальной клинической практике существующим клиническим рекомендациям и стандартам оказания медицинской помощи;
- анализ эффективности внедрения и доступности новых диагностических и лечебных методов.
Регистр позволяет увидеть фактическое состояние диабетологической помощи (уровень HbA1c, частоту осложнений, структуру терапии, структуру смертности); оценить соответствие реальной клинической помощи стандартам ведения пациентов с СД; провести анализ причин, препятствующих достижению целевых показателей контроля СД; провести выбор приоритетных направлений развития диабетологической службы в масштабах отдельного лечебно-профилактического учреждения (ЛПУ), региона, РФ; осуществлять контроль за льготным лекарственным обеспечением на региональном и федеральном уровне.
ЦЕЛЬ
Провести динамический анализ эпидемиологических характеристик СД в РФ (распространенности, заболеваемости, смертности), распространенности осложнений, состояния углеводного обмена (по уровню гликированного гемоглобина (HbA1c)) и динамики структуры ССТ по данным ФРСД.
МЕТОДЫ
Объектом исследования являлась база данных ФРСД, включающая 84 региона РФ, на 01.01.2021 г.
При расчете показателей распространенности и заболеваемости СД использовались данные численности населения субъектов РФ Федеральной службы государственной статистики (Росстат) [5]. По данным Росстат также указана численность пациентов с СД в Чукотском автономном округе, не включенном в регистр.
Показатели распространенности и заболеваемости СД 1 и 2 типа (СД1 и СД2) представлены в динамике за период 2016–2020 гг.
Анализ половозрастных характеристик представлен за 2020 г.; в него включались пациенты с наличием всех необходимых параметров (пол, возраст, тип СД) и исключались пациенты с ошибочными демографическими характеристиками.
Динамика причин смерти, контроля углеводного обмена и структуры ССТ представлена по данным ФРСД (84 региона) за 2020 г. и в динамике 2016–2020 гг. Из динамического анализа ССТ исключались пациенты, у которых не заполнен раздел терапии.
Терминология
Распространенность — показатель, оценивающий количество всех случаев заболевания, зарегистрированных в текущем календарном году, рассчитывается на 100 тыс. населения соответствующей возрастной группы.
Заболеваемость (первичная, по обращаемости) — показатель, оценивающий количество новых случаев заболевания, впервые зарегистрированных в текущем календарном году, рассчитывается на 100 тыс. населения соответствующей возрастной группы.
Смертность — показатель, оценивающий количество смертей у лиц с данным заболеванием, рассчитывается на 100 тыс. населения соответствующей возрастной группы.
Дети — лица в возрасте до 15 лет (0–<15).
Подростки — лица в возрасте от 15 лет до 18 лет (15–<18).
Взрослые — лица старше 18 лет.
Этическая экспертиза
Протокол исследования №20 от 14 декабря 2016 г. был рассмотрен локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России, принято положительное решение.
РЕЗУЛЬТАТЫ
Анализ распространенности сахарного диабета в Российской Федерации
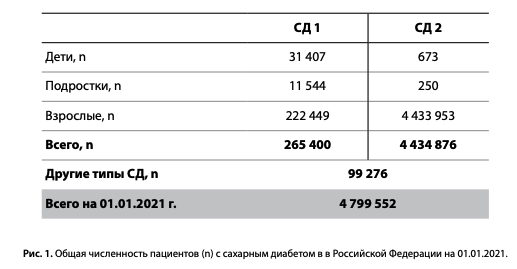
На 01.01.2021 г. в онлайн-регистр СД включено 84 региона РФ, 4658 ЛПУ. Общая численность пациентов с СД в РФ, состоящих на диспансерном учете, на 01.01.2021 г., по данным регистра, составила 4 799 552 (3,23% населения РФ), из них: СД1 — 5,5% (265,4 тыс.), СД2 — 92,5% (4,43 млн), другие типы СД — 2,0% (99,3 тыс.) (рис. 1). Группа «другие типы СД» включала пациентов с нарушением толерантности к глюкозе (НТГ) — 67,3 тыс., нарушением гликемии натощак (НГН) — 12,1 тыс., гестационным СД (9,4 тыс.) и другими типами СД (10,4 тыс.).
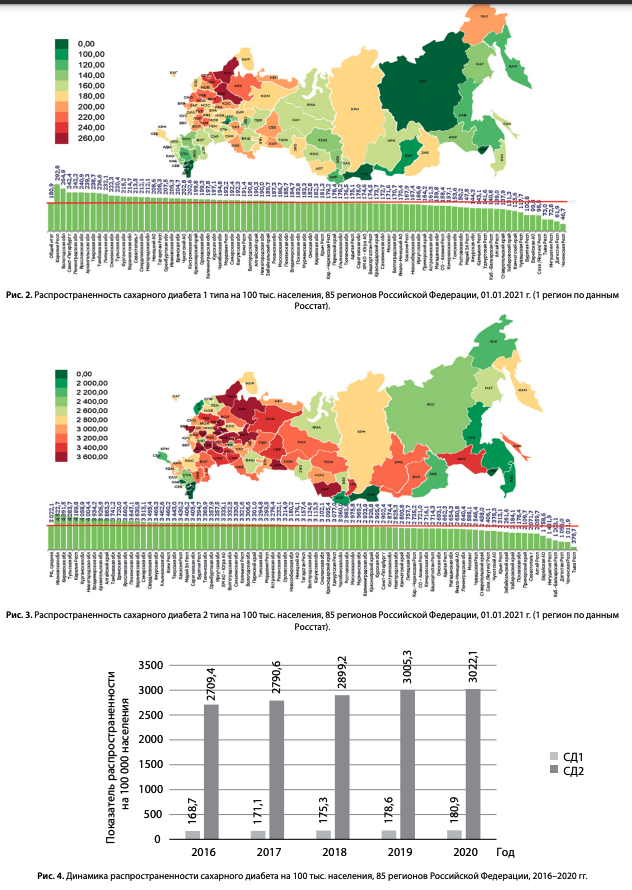
Показатели распространенности СД1 и СД2 в РФ по данным каждого региона на 01.01.2021 г. представлены на рис. 2 и 3. Показатели распространенности СД в каждом из 85 регионов в различных возрастных группах (Чукотсткий АО по данным Росстат) представлены в приложении 1, табл. 1–4: все возрастные группы, дети, подростки и взрослые соответственно.
Распространенность СД1 в 2020 г. в среднем в РФ составила 180,9/100 тыс. населения (рис. 2), наблюдались различия между регионами с присутствием «географического градиента»: бóльшей распространенностью СД1 в северо-западных регионах нашей страны.
Распространенность СД2 в 2020 г. в среднем в РФ составила 3022,1/100 тыс. населения (рис. 3). Выраженную вариабельность между регионами при СД2 сложно трактовать этническими и генетическими различиями. Учитывая общепопуляционные факторы развития СД2, на показатель распространенности могут влиять организационные факторы, такие как различия в скрининге СД и эффективности его выявления в группах риска.
Показатели распространенности СД1 и СД2 в динамике за период 2016–2020 гг. представлены на рис. 4 — отмечается увеличение распространенности обоих типов СД, преимущественно за счет СД2.
Анализ заболеваемости сахарным диабетом в Российской Федерации
Динамика заболеваемости СД в 2016–2020 гг. составила при СД1 10,5–7,7/100 тыс. населения, при СД2 — 219,6–154,2/100 тыс. населения, абсолютные значения представлены на рис. 5. С 2016 г. отмечался прирост более 300 тыс. новых пациентов с СД2 и 10–15 тыс. пациентов с СД1 ежегодно (рис. 5). В 2020 г. впервые выявлено 11 256 новых случаев СД1 и 226 266 СД2, что по сравнению с 2016 г. составляет снижение на –-20,9% при СД1 и –35,3% при СД2. В 2020 г. наблюдалось значительное снижение числа новых случаев впервые выявленного СД, что связано с изменением стандартной поликлинической работы на уровне первичного звена в условиях пандемии новой коронавирусной инфекции и самоизоляции пациентов. Снижение регистрации впервые выявленного СД может стать фактором ухудшения гликемического контроля, вероятности несвоевременного обучения пациента и, как следствие, — повышения риска развития осложнений в перспективе.
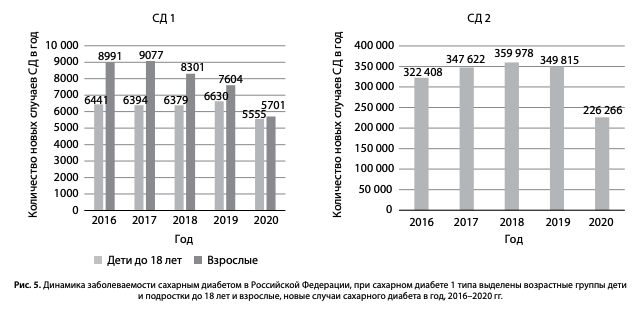
В последние 5 лет отмечается снижение количества новых «регистрируемых» случаев СД1 среди взрослых пациентов (рис. 5), возможно, обусловленное изменением кодирования. С одной стороны, это может быть связано со снижением заболеваемости среди взрослых пациентов при стабильных показателях у детей и подростков до 18 лет. Среди возможных причин — уменьшение неправильной регистрации СД2 на инсулинотерапии, которых относили в группу пациентов с СД1 с кодами Е10, что зачастую отмечалось в более ранние периоды.
Данные по отдельным регионам представлены в приложении 2, табл. 1. Широкая вариабельность показателей заболеваемости СД в регионах свидетельствует о влиянии организационных факторов: работы по активному скринингу и выявлению СД в группах риска.
Клиническая характеристика пациентов с СД в Российской Федерации
Половозрастные характеристики
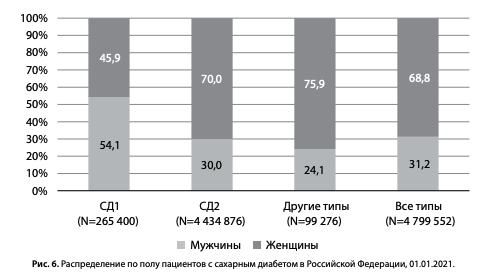
Распределение по полу среди пациентов с СД в РФ представлено на рис. 6. При СД1: 54% мужчин (143,6 тыс.) и 46% женщин (121,8 тыс.), при СД2: 30% мужчин (1 млн 331 тыс.) и 70,0% женщин (3 млн 103 тыс.).
В распределении по возрасту при СД1 (рис. 7) отмечено постепенное возрастание доли пациентов с возраста 0–4 года с пиком распространенности в возрасте 30–39 лет (24,5% мужчин и 21,8% женщин) и наибольшим количеством пациентов в возрастных группах от 26 до 50 лет как у мужчин, так и у женщин (52,7%/75,6 тыс. и 45,8%/ 55,7 тыс. соответственно). При СД2 отмечено постепенное увеличение количества пациентов с возраста 30 лет с пиком распространенности в возрасте 65–69 лет у мужчин (19,4%) и женщин (20,5%) (рис. 7).
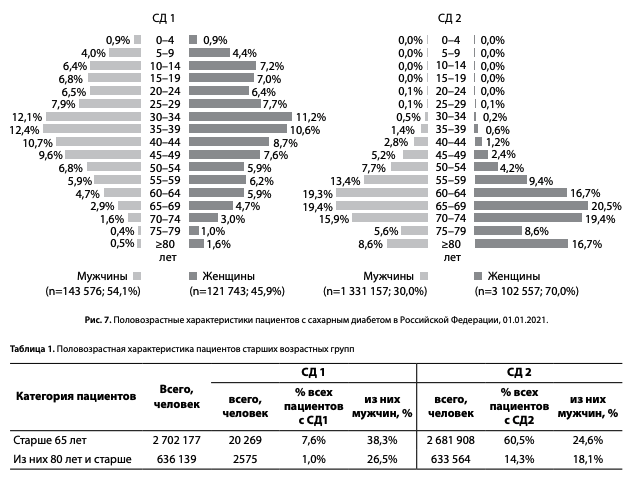
Характеристика пациентов старшей возрастной группы, включая когорту пациентов старше 80 лет, представлена в табл. 1. Общее количество пациентов старше 65 лет, по данным ФРСД на 01.01.2021, составило 2,7 млн, что составляет 7,6% от общего количества пациентов с СД1 и 60,5% —пациентов с СД2. Общее количество пациентов старше 80 лет — 636,1 тыс., что составляет 1,0% от общего количества пациентов с СД1 и 14,3% — пациентов с СД2 (табл. 1).
Анализ смертности при сахарном диабете в Российской Федерации
В 2020 г. зарегистрировано 143 323 случаев смерти пациентов с СД, из них:
- СД1: 2,7/100 тыс. населения, 3932 пациента (2,7%), динамика с 2016 г. 3,0–2,7/100 тыс. населения, что составляет -9,1%;
- СД2: 93,9/100 тыс. населения, 137 859 пациентов (96,2%), динамика с 2016 г. 87,7–93,9/100. тыс. населения, что составляет +0,7%;
- другие типы СД: 1,0/100 тыс. населения, 1532 пациента (1,1%).
Показатели смертности при СД в различных возрастных группах, по данным ФРСД по каждому из 85 регионов, представлены в Приложении 3, табл. 1.
Структура причин смерти пациентов с СД по данным ФРСД представлена на рис. 8. Среди причин смерти пациентов с СД ведущие позиции продолжают занимать болезни системы кровообращения (БСК) [6][7]. Основной причиной смерти пациентов с СД являлись: инфаркт миокарда (ИМ), нарушения мозгового кровообращения (НМК), хроническая сердечно-сосудистая недостаточность и острые сердечно-сосудистые события (нарушения ритма, тромбоэмболия легочной артерии, тромбозы, внезапная сердечно-сосудистая смерть, кардиогенный шок, отек мозга), которые стали причиной смерти 38,1% пациентов с СД1 и 52,0% пациентов с СД2. Среди причин смерти, не связанных с СД, онкологическая патология сохраняет второе место после БСК в структуре смертности пациентов с СД 2 (10,1%).
При этом доля пациентов, умерших от непосредственно диабетических причин, связанных с острыми и хроническими диабетическими осложнениями (комы, гангрены, терминальная стадия диабетического поражения почек), значительно ниже — суммарно 9,4% при СД1 и 2,5% при СД2.
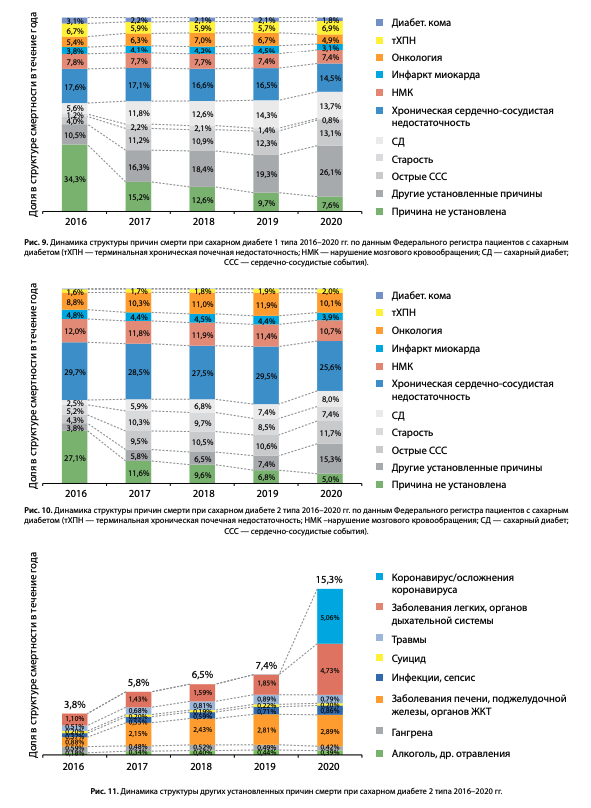
Динамика структуры причин смертности при обоих типах СД в 2016–2020 гг. представлена на диаграммах (рис. 9 и 10).
Отмечаются снижение доли умерших вследствие «истинных диабетических» причин: (диабетической комы (с 3,1 до 1,8% при СД1, с 0,4 до 0,2% при СД2) и относительно стабильный уровень смертности вследствие терминальной хронической почечной недостаточности (тХПН) (6,7–6,9% при СД1 и 1,6–2,0% при СД2). Отмечается увеличение доли умерших от старости при СД2 с 5,2 до 7,4%, что отражает улучшение качества оказания медицинской помощи пациентам с СД, позволяющее дожить до естественной смерти.
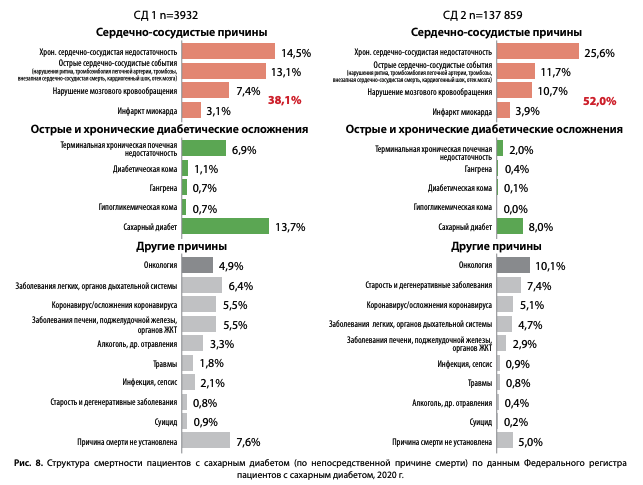
В 2020 г. отмечается значительное увеличение доли умерших от других установленных причин смерти до 26,1% при СД1 и 15,3% при СД2 (рис. 9–10), что во многом обусловлено влиянием пандемии COVID-19. Так, при дополнительном анализе структуры этой графы при СД2 (рис. 11) было 5% умерших от коронавируса/ его осложнений и отмечалось увеличение доли умерших от заболеваний органов дыхания в 2 раза — до 4,73%, при этом доля других причин смерти в данном разделе не изменилась (рис. 11).
К сожалению, также увеличилась доля пациентов, у которых причина смерти указана как «сахарный диабет» без указания непосредственной причины смерти: по сравнению с 2016 г. данный показатель вырос при СД1 с 5,6 до 13,7%, при СД2 — с 2,5 до 8,0%. Данный факт не связан с истинным увеличением смертности пациентов от СД, а объясняется организационно-административными причинами, связанными с исполнением рекомендаций по кодированию смерти пациентов с СД — письмо Минздравсоцразвития РФ от 26.04.2011 N 14-9/10/2-4150 [8]. Согласно данному документу, в случае смерти пациента с СД от ИМ, острых форм цереброваскулярной болезни и сердечной недостаточности, первоначальной причиной смерти стали указывать СД, а острые формы ишемической и цереброваскулярной болезни — только его осложнениями, что значимо повлияло на структуру смертности. Тем не менее, доля БСК в структуре смертности пациентов с СД остается значительной при обоих типах СД, практически без динамики за последние 5 лет (рис. 9 и 10).
Показатели среднего возраста смерти и длительность СД до момента смерти в 2016–2020 гг. у мужчин и женщин представлены в табл. 2. Отмечено увеличение длительности СД до момента смерти как у мужчин, так и у женщин: при СД1 с 17,4 до 19,1 года, при СД2 — с 11,0 до 11,4 года.
Учитывая факт неизбежности смерти по той или иной причине, возраст смерти становится ключевым критерием, отражающим успешность мер, направленных на снижение смертности.
При анализе возраста смерти становится очевидной выраженная диссоциация в зависимости от причины смерти при обоих типах СД.
Так, средний возраст смерти при СД1 без учета пола составляет 53,2 года (табл. 2, рис. 12). В более старшем возрасте фиксируется смерть от таких причин, как старость и дегенеративные заболевания (средний возраст смерти 70,0 года), хронической сердечно-сосудистой недостаточности (60,8 года), ИМ (59,3 года), онкологии (57,9 года) и НМК (56,4 года). Ниже черты среднего возраста смерти при СД1 находятся причины, связанные с неудовлетворительным контролем СД: диабетические комы (40,6 года), гипогликемические комы (41,0 года), а также инфекции, сепсис (42,1 года). И наиболее «молодой возраст смерти» отмечался по причинам, которые можно классифицировать как следствие социальных факторов: алкоголь (42,2 года), суицид (43,3 года) и травмы (45,5 года).
При СД2 (рис. 13) старше среднего возраста смерти в 73,5 года находились такие причины, как старость и дегенеративные заболевания (83,5 года), хроническая сердечно-сосудистая недостаточность (74,8 года) и НМК (74,7 года). Возраст смерти от ИМ — 72,2 года, от гангрены — 72,1 года. Возраст смерти от диабетических причин вследствие острых (комы) и хронических осложнений (тХПН), как и при СД1, был ниже среднего возраста смерти, наиболее «молодой возраст смерти» — в группе социальных причин.
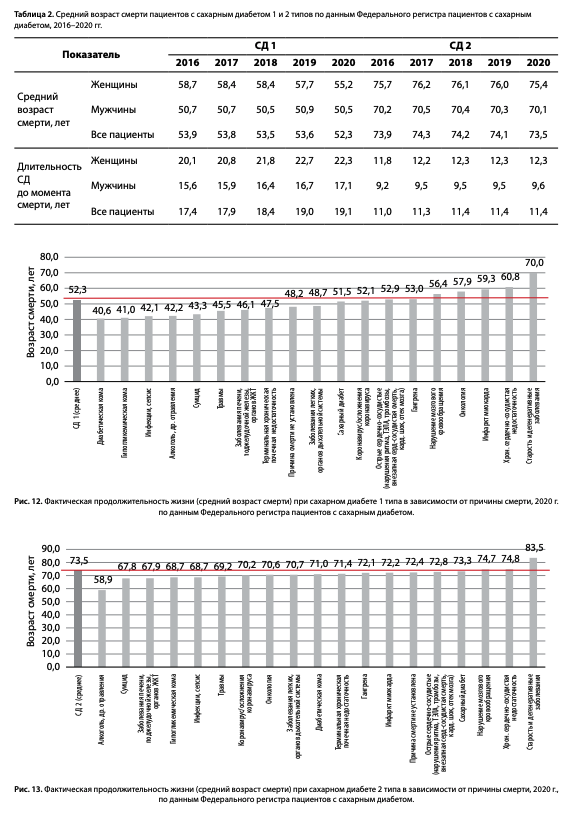
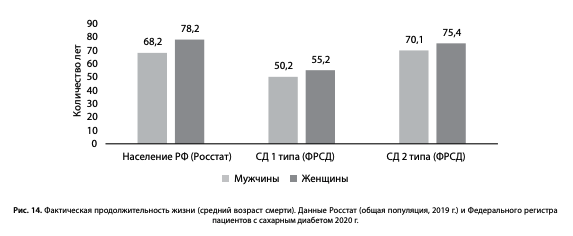
По последним имеющимся данным Росстат, средняя продолжительность жизни в общей популяции составляет у мужчин 68,2 года, у женщин — 78,2 года (рис. 14) [9]. Таким образом, фактическая продолжительность жизни пациентов с СД2 сопоставима со средними показателями общей популяции без СД2 (рис.14).
Анализ распространенности осложнений при сахарном диабете в Российской Федерации
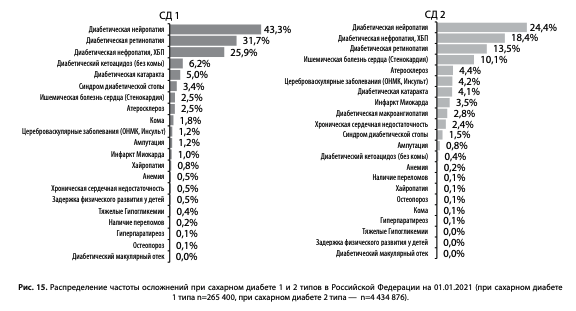
Регистр позволяет оценивать распространенность осложнений СД и их стадию. Наибольшая частота отмечается у микрососудистых осложнений: диабетическая нейропатия (ДН) — 43,3% и 24,4% при СД1 и СД2, диабетическая нефропатия, хроническая болезнь почек (ХБП) — 25,9% и 18,4%, диабетическая ретинопатия (ДР) — 31,7% и 13,5% соответственно (рис. 15).
В отношении макрососудистых осложнений, для которых характерно многофакторное развитие, отмечена относительно меньшая частота: при СД1/СД2 частота ИБС 2,5%/10,1%, ИМ — 1,0%/3,5%. Однако учитывая общую численность пациентов с СД2 более 4,4 млн, количество пациентов с сердечной недостаточностью, атеросклеротическими сердечно-сосудистыми заболеваними (ССЗ) и ХБП превышает 1,7 млн. Стоит учитывать, что в регистре фиксируются только верифицированные диагнозы, поэтому в отсутствие специализированного обследования истинная частота может недооцениваться [10]. Так, при активном скрининге по данным Диамодуля, частота ССЗ в 1,5–2 раза выше, несмотря на тенденции к положительной динамике по сравнению с периодом выездов в 2000-х гг. в рамках Федеральной целевой программы (ФЦП) [10].
Основную угрозу представляют терминальные стадии диабетических осложнений. За последние годы отмечается положительная динамика уменьшения частоты терминальных стадий ДР (слепоты) и ХБП (диализ), а также доли высоких ампутаций [11]. В анализируемый период 2016–2020 гг. данные тенденции сохраняются: отмечается снижение
- слепоты при СД1 с 105,9 до 94,0/10 000 взрослых пациентов; при СД2 — с 17,6 до 15,3/10 000 взрослых пациентов;
- частоты ампутаций нижних конечностей при СД1 с 140,6 до 134,3/10 000 взрослых пациентов; при СД2 — с 79,0 до 76,7/10 000 взрослых пациентов;
- тХПН при СД1 с 147,05 до 137,65/10 000 взрослых пациентов; при СД2 — с 25,83 до 20,16/10 000 взрослых пациентов.
Анализ состояния компенсации углеводного обмена (уровня HbA1c)
Для клинической практики уровень гликированного гемоглобина (HbA1c) является показателем, определяющим оценку ССТ, абсолютно необходимым для принятия решения о ее эффективности или необходимости интенсификации.
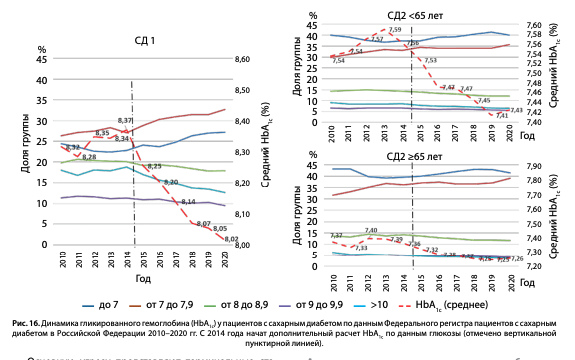
Мы провели анализ динамики контроля углеводного обмена по среднему уровню HbA1c при СД1 и СД2 в период 2010–2020 гг. (рис. 16). Отмечена положительная динамика средних значений при обоих типах СД: при СД1 — с 8,51% до 8,05%, при СД2 в возрасте <65 лет — с 7,54% до 7,43%, и при СД2 в возрасте >65 лет — 7,37%–7,26%.
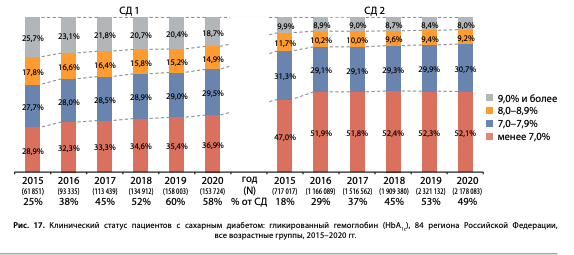

Распределение пациентов по диапазонам HbA1c на 01.01.2021 составило:
- при СД1: уровень HbA1c<7% — 36,9% пациентов, в диапазоне 7–7,9% — 29,5% пациентов, 8–8,9% — 14,9% пациентов, ≥9,0% — 18,7% пациентов;
- при СД2: уровень HbA1c<7% — 52,1% пациентов, в диапазоне 7–7,9% — 30,7% пациентов, 8–8,9% — 9,2% пациентов, ≥9,0% — 8,0% пациентов (рис. 17).
Следует отметить несомненно положительную динамику охвата пациентов исследованием HbA1c в период 2015–2020 гг.: при СД1 — с 25% до 58%, при СД2 — с 18% до более 49% (рис. 17). Тем не менее, согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом», уровень HbA1c необходимо оценивать у всех пациентов с СД [12], при этом в настоящий момент, согласно ФРСД, HbA1c регистрируется только у половины пациентов. Создается впечатление, что оценка HbA1c по обращаемости происходит у более активной, а соответственно, и более сохранной части пациентов. Так, по данным обследования в Диамодуле, когда исследование HbA1c проводится у 100% пациентов, показатели соответствуют целевому уровню лишь у 25–28% пациентов с СД2 и 11,7–13,7% пациентов при СД1, что почти в 3 раза меньше по сравнению с данными регистра [13].
Выбор индивидуальных целей лечения зависит от множества факторов (возраста пациента, ожидаемой продолжительности жизни, наличия ССЗ и факторов риска тяжелых гипогликемий) [12]. В настоящее время в ФРСД введены элементы системы поддержки принятия решений, а именно — автоматический калькулятор расчета недостижения цели HbA1c (рис. 18). Для большинства взрослых пациентов с СД целевым является уровень HbA1c <7,0% [12], но можно установить более жесткие критерии. Изменилась возможность кратности ввода показателя: не 1 раз в год, а ежеквартально, как требуют клинические рекомендации. Существует и автоматический отчет, включающий не только средний уровень HbA1c, но и соотношение по диапазонам и поквартальную динамику данного показателя, который может сделать каждый врач, руководитель ЛПУ и главный специалист региона на конкретной когорте пациентов. Таким образом, регистр является не только системой внесения данных, но и руководством к выбору индивидуальных целевых параметров гликемического контроля в зависимости от клинического статуса пациента.
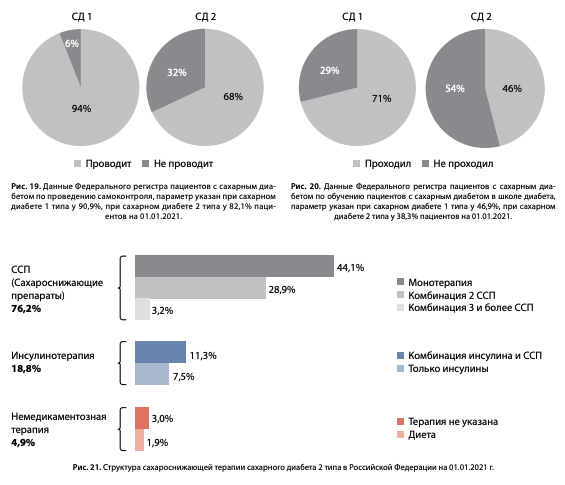
Обучение пациентов является неотъемлемой частью комплекса терапевтических мероприятий, направленных на достижение целевого гликемического контроля. Клинические рекомендации позиционируют необходимость обучения в дебюте СД и его продолжения на всем протяжении заболевания [14][15]. Однако данные анализа ФРСД свидетельствуют, что самоконтроль не проводят около трети пациентов с СД2 (32%) и 6% с СД1, а обучение в «Школе для пациентов с СД» проходят только 46% пациентов с СД2 и 71% — с СД1 (рис. 19 и 20), что, несомненно, является лимитирующим фактором достижения целевого контроля.
Анализ структуры медикаментозной терапии сахарного диабета
После перехода регистра в онлайн-формат стала возможна оценка структуры ССТ в РФ, что является важнейшим инструментом для анализа назначения антидиабетических препаратов. Эти данные можно рассматривать в качестве основы для оптимизации алгоритмов терапии в реальной клинической практике.
Структура CCТ при СД2 в РФ на 01.01.2021 г. представлена на рис. 21. Установлено, что в структуре медикаментозной терапии СД2 преобладает назначение пероральных сахароснижающих препаратов (ССП) — у 76,2% пациентов, преимущественно в монотерапии — 44,1% пациентов; комбинацию 2 ССП получают 28,9% пациентов, 3 препаратов — 3,2% пациентов (рис. 21). Количество пациентов с СД2 на инсулинотерапии составило 18,8%, из которых 11,3% пациентов получали комбинированную терапию инсулинами в сочетании с различными ССП и 7,5% — только инсулинами, 1,9% пациентов находились на монотерапии диетой, у 3,0% пациентов терапия в ФРСД была не указана.
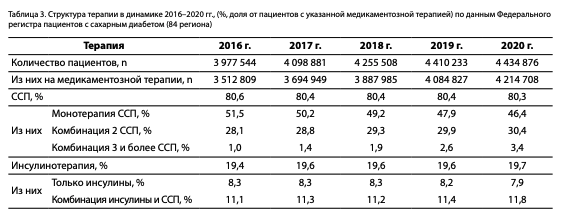
Данные структуры терапии в динамике в период 2016–2020 гг. представлены в таблице 3. Отмечено уменьшение доли пациентов на ССП в монотерапии с 51,5 до 46,4% с перераспределением в комбинированную терапию из 2 и более ССП, что является положительным моментом среди основных тенденций в назначении ССТ в РФ. Доля пациентов на инсулинотерапии при СД2 стабильна (19–20%).
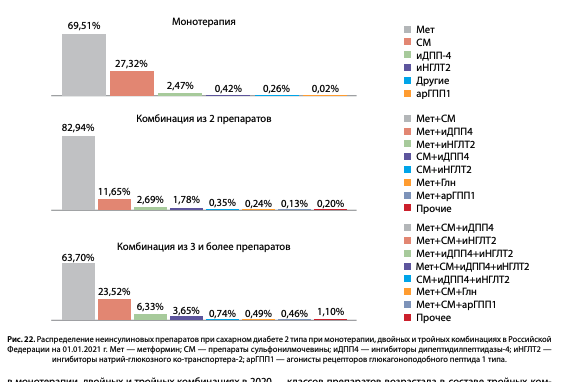
Структура распределения различных классов ССП и инъекционных неинсулиновых препаратов в монотерапии, двойных и тройных комбинациях в 2020 г. представлена на рис. 22. В монотерапии наиболее часто назначаемыми препаратами были — метформин (Мет) (69,5%), сульфонилмочевина (СМ) (27,3%), ингибиторы дипептидилпептидазы-4 (иДПП-4) (2,5%), другие классы препаратов составили суммарно менее 1% монотерапии. Наиболее частыми двойными комбинациями были Мет+СМ 82,9%, Мет+иДПП-4–11,7%, Мет + ингибиторы натрий-глюкозного ко-транспортера 2 (иНГЛТ-2) — 2,7%, СМ+иДПП-4 — 1,8%, менее 1% двойных комбинаций составляли: Мет + агонисты рецепторов глюкагоноподобного пептида 1 типа (арГПП-1) — 0,1%. Доля новых классов препаратов возрастала в составе тройных комбинаций: Мет+СМ+иДПП-4 — 63,7%, Мет+СМ+иНГЛТ-2 — 23,5%, Мет+иДПП-4+иНГЛТ-2 — 6,3%. Таким образом, наиболее часто назначаемыми препаратами как в монотерапии, так и в комбинациях остаются традиционные препараты Мет и СМ. Доля новых препаратов (иДПП-4, иНГЛТ-2) возрастает преимущественно в составе 3 комбинаций, в то время как назначение арГПП-1 остается без существенной динамики.
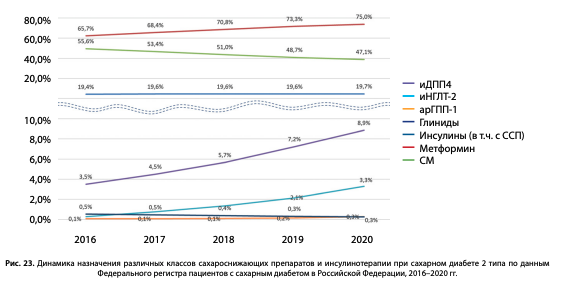
Нами также выполнен анализ динамики назначения различных классов препаратов при СД2, включая инсулины, в период 2016–2020 гг. (рис. 23). Выявлено, что в динамике за период 2016–2020 гг. уменьшилось использование препаратов СМ с 55,6 до 47,1% (–8,5%), назначение метформина возросло с 65,7 до 75,0% (+9,3%), количество пациентов с СД2 на инсулинотерапии в динамике достаточно стабильно 19,4–19,7%. Среди новых классов ССП наиболее заметно увеличилась доля иДПП-4, более чем в 2 раза, с 3,5 до 8,9% и иНГЛТ-2 — с 0,1% до 3,3%. Доля пациентов на терапии арГПП-1 осталась без существенной динамики — 0,1–0,3%.
Выбор грамотной ССТ, направленной на достижение индивидуальных целей гликемического контроля и профилактику рисков развития диабетических осложнений, определяет долгосрочный прогноз пациента.
При этом важнейшим аспектом является ранняя интенсификация терапии на самых начальных этапах течения СД с целью первичной профилактики развития осложнений. При уровне HbA1c >1% индивидуальных целевых значений уже в дебюте заболевания или в кратчайшие сроки после его развития (не более 6 месяцев) рекомендуется назначение комбинированной терапии. Учитывая гетерогенность и многофакторность механизмов повышения гликемии при СД2, предпочтительно использование ССП с различными механизмами действия. В настоящее время, согласно современным клиническим рекомендациям, основанным на результатах масштабных клинических исследований, происходит изменение парадигмы подходов к ССТ: мы уходим от глюкозо-центрической модели терапии, учитывающей только сахароснижающую эффективность, ключевым приоритетом выбора становится применение препаратов с доказанными преимуществами снижения рисков развития сердечно-сосудистых и почечных исходов [12][15].
К сожалению, на данном этапе, несмотря на положительную динамику уменьшения доли пациентов на монотерапии, согласно анализу ФРСД, становится очевиден факт недостаточной интенсификации ССТ в целом, в том числе с использованием инновационных препаратов, что требует изменения подходов к выбору терапии в условиях реальной клинической практики.
Аспекты безопасности ССТ, в том числе риски развития гипогликемий, имеют приоритетное значение при выборе препарата. Ранее по данным регистра нами было показано, что при уменьшении общего количества ком в последние годы отмечается перераспределение соотношения кетоацидотических и гипогликемических ком с увеличением доли гипогликемических состояний, особенно выраженное при СД2 [16]. Этот факт требует внимания со стороны практического здравоохранения и заставляет задуматься о том, что при выборе ССТ мы, безусловно, должны отдавать предпочтение тем препаратам, которые обладают меньшим риском развития гипогликемий.
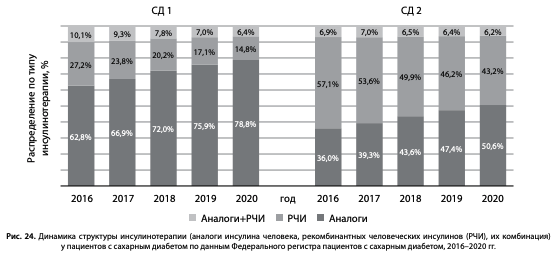
На рис. 24 показана структура инсулинотерапии — применение различных видов инсулинов в динамике 2016–2020 гг. у пациентов с СД1 и СД2: рекомбинантных человеческих инсулинов (РЧИ), аналогов инсулина или их сочетанное использование. Отмечено увеличение доли аналогов инсулина человека с 62,8 до 78,8% при СД1 и с 36,0 до 50,6% при СД2, уменьшение доли РЧИ с 27,2 до 14,8% при СД1 и с 57,1 до 43,2% при СД2.
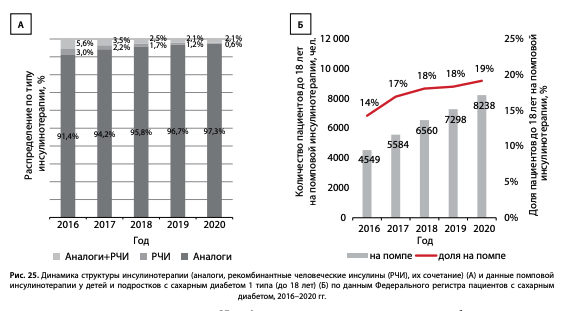
При анализе данных регистра важнейшее значение имеет оценка эффективности внедрения новых диагностических и терапевтических методов, в том числе использования помповой инсулинотерапии. Мы проанализировали частоту использования аналогов инсулина и помп в группе детей и подростков (возраст до 18 лет) при СД1. Доля назначения аналогов инсулина в этой группе увеличилась за последние 5 лет с 91,4 до 97,3% (рис. 25); отмечена положительная динамика применения помповой инсулинотерапии: с 2016 г. прирост составил 5% (с 14 до 19%), что в абсолютных значениях означает увеличение с 4549 до 8238 человек, таким образом, продолжается позитивная тенденция по увеличению охвата детей и подростов самыми современными видами инсулинотерапии [17].
ЗАКЛЮЧЕНИЕ
ФРСД является уникальной информационно-аналитической платформой для осуществления клинико-эпидемиологического мониторинга СД, анализа и развития службы диабетологической помощи в РФ на основе данных реальной клинической практики, ключевым инструментом в структуре систематизации эпидемиологических и клинических характеристик пациентов с СД на федеральном и региональном уровнях.
В статье представлены динамический анализ эпидемиологических показателей СД в РФ, распространенности осложнений, состояния углеводного обмена и динамика структуры ССТ – данных, необходимых для оценки качества оказания медицинской помощи и планирования развития диабетологической службы в РФ, в том числе с целью мониторинга регионов в рамках деятельности НМИЦ для решения задач, поставленных Национальным проектом «Здравоохранение».
Анализ ФРСД дает возможность оценивать параметры и динамику уровня HbA1c, который, согласно Приказу №203н от 10 мая 2017 г. «Об утверждении критериев оценки качества медицинской помощи», регламентируется как обязательный показатель для включения в обследование пациентов с СД с целью оптимизации ССТ. В ключевые параметры документа входят также расчет индивидуального целевого уровня HbA1c и целевые значения гликемии. Усилия по обеспечению исследованием HbA1c 100% пациентов с СД должны стать приоритетным направлением работы службы в каждом регионе. С 2020 г. показатель HbA1c внедрен во второй этап диспансеризации групп риска.
В последние два года в систему ФРСД были введены элементы автоматизированного контроля, обеспечивающего правильность установления типа СД и своевременной диагностики ряда осложнений. Создана система поддержки принятия решений и оценки качества оказания медицинской помощи для обеспечения рациональной, соответствующей клиническим рекомендациям терапии и тактики ведения этого социально значимого заболевания. Возможности онлайн-регистра по оценке терапии:
- пофамильные списки пациентов по виду терапии (ССП, арГПП1, инсулины, помповая терапия);
- списки пациентов по федеральной и региональной льготам;
- автоматический расчет индивидуальной потребности в упаковках препарата на квартал и на год (раздел автоматически заполняется в таблице при внесении дозы препарата);
- отчет о потребности в лекарственных препаратах по ТН и МНН;
- формирование «Протокола врачебной комиссии» назначаемой лекарственной терапии (подтверждение дозы и конкретного наименования препарата);
- формирование карты диспансерного учета;
- формирование пофамильных списков пациентов, имеющих показания для изменения терапии, — резерв лекарственной заявки.
В условиях нового времени ФРСД представляет собой яркий пример информатизации на уровне первичного звена, обеспечивающего дистанционный контроль клинических данных пациентов с СД на федеральном и региональном уровнях. Расширение и совершенствование автоматизированной поддержки принятия клинических решений в перспективе должно обеспечить реализацию нового подхода к функциям ФРСД как системе контроля стратегических рисков заболевания.
СПИСОК ЛИТЕРАТУРЫ
- IDF Diabetes Atlas, 9th edition. Brussels: International Diabetes Federation; 2019; Available from: https://www.diabetesatlas.org/en
- Дедов И.И., Шестакова М.В., Викулова О.К., и др. Атлас регистра сахарного диабета Российской Федерации. Статус 2018 г. // Сахарный диабет. - 2019. - № 22(2S). - С. 4-61. https://doi.org/10.14341/DM12208
- Дедов И.И., Шестакова М.В., Викулова О.К. Государственный регистр сахарного диабета в Российской Федерации: статус 2014 г. и перспективы развития // Сахарный диабет. - 2015. - T. 18. - №3. - С. 5-22. https://doi.org/10.14341/DM201535-22
- Шестакова М.В., Викулова О.К., Исаков М.А., Дедов И.И. Сахарный диабет и COVID-19: анализ клинических исходов по данным регистра сахарного диабета Российской Федерации // Проблемы эндокринологии. - 2020. - Т. 66. - № 1. - С. 35-46. https://doi.org/10.14341/probl12458
- Федеральная служба государственной статистики. Доступно по: gks.ru.
- Дедов И.И., Шестакова М.В., Викулова О.К. Эпидемиология сахарного диабета в Российской Федерации: клинико-статистический анализ по данным Федерального регистра сахарного диабета // Сахарный диабет. - 2017. - T. 20. - №1. - C. 13-41. https://doi.org/10.14341/DM8664
- Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: распространенность, заболеваемость, смертность, параметры углеводного обмена и структура сахароснижающей терапии по данным Федерального регистра сахарного диабета, статус 2017 г. // Сахарный диабет. - 2018. - Т. 21. - №3. - С. 144-159. https://doi.org/10.14341/DM9686
- Письмо Минздравсоцразвития РФ от 26.04.2011 №14-9/10/2-4150 Доступно по: http://base.garant.ru/4192897
- Данные Росстата, Демографический ежегодник России. 2019. Доступно по: https://gks.ru/folder/210/document/13207.
- Железнякова А.В., Викулова О.К., Серков А.А., и др. Динамический мониторинг сердечно-сосудистых заболеваний у пациентов с сахарным диабетом по данным обследования в мобильном медицинском центре (Диамодуль) в регионах России // Consilium Medicum. - 2020. - Т. 22. - №10. - С. 39-44. https://doi.org/10.26442/20751753.2020.10.200323
- Шестакова М.В., Викулова О.К., Железнякова А.В., и др. Эпидемиология сахарного диабета в Российской Федерации: что изменилось за последнее десятилетие? // Терапевтический архив. - 2019. - Т. 91. - №10. - С. 4-13. https://doi.org/10.26442/00403660.2019.10.000364
- Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. - 2019. - Т. 22. - №S1. - С. 1-144. https://doi.org/10.14341/DM221S1
- Викулова О.К., Железнякова А.В., Исаков М.А., и др. Динамический анализ состояния углеводного обмена в субъектах Российской Федерации по данным мобильного медицинского центра (Диамодуль) и регистра сахарного диабета Российской Федерации // Сахарный диабет. - 2020. - Т. 23. - №2. - С. 104-112. https://doi.org/https:https://doi.org/doi.org/10.14341/DM12327
- Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Сахарный диабет 1 типа у взрослых. Клинические рекомендации // Сахарный диабет. - 2020. - Т. 23. - №1S. - С. 42-114. https://doi.org/10.14341/DM12505
- Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Сахарный диабет 2 типа у взрослых. Клинические рекомендации // Сахарный диабет. - 2020. - Т. 23. - №2S. - С. 4-102. https://doi.org/10.14341/DM12507
- Майоров А.Ю., Викулова О.К., Железнякова А.В., и др. Эпидемиология острых осложнений (комы) по данным Федерального регистра больных сахарным диабетом Российской Федерации (2013-2016 гг.) // Сахарный диабет. - 2018. - Т. 21. - №6. - С. 444-454. https://doi.org/10.14341/DM10028
- Дедов И.И., Шестакова М.В., Петеркова В.А., и др. Сахарный диабет у детей и подростков по данным Федерального регистра Российской Федерации: динамика основных эпидемиологических характеристик за 2013-2016 гг. // Сахарный диабет. - 2017. - Т. 20. - №6. - С. 392-402.https://doi.org/10.14341/DM9460





