Клинические рекомендации по диагностике и лечению легочной гипертонии


Published: Sept. 1, 2014
Latest article update: Nov. 22, 2022
Abstract
Легочная гипертония (ЛГ) - это группа заболеваний, характеризующихся прогрессирующим повышением легочного сосудистого сопротивления и давления в легочной артерии, которое приводит к развитию правожелудочковой сердечной недостаточности и преждевременной смерти пациентов. На основании современной версии рекомендаций по диагностике и лечению ЛГ, принятой экспертами Европейского общества кардиологов и Европейского респираторного общества в 2009 г., клинических данных национальных и зарубежных исследований в 2013 г. российскими экспертами разработаны клинические рекомендации по ЛГ. В них рассматриваются современные классификации ЛГ, особенности патогенеза, алгоритма диагностики ЛГ. В разделе, посвященном средствам поддерживающей терапии, обсуждаются данные о применении пероральных антикоагулянтов, диуретиков, сердечных гликозидов, оксигенотерапии. Специфическая терапия легочной артериальной гипертонии (ЛАГ) включает антагонисты кальция, простаноиды, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы 5-го типа. Среди методов хирургического лечения ЛГ представлены предсердная септостомия, тромбэндартерэктомия и трансплантация легких или комплекса сердце-легкие. Предлагается алгоритм лечения больных ЛАГ. Современные медикаментозные подходы с использованием препаратов специфической терапии и их комбинаций открывают новые перспективы эффективного лечения больных ЛАГ, улучшают их прогноз.
Keywords
Легочная гипертония, клинические рекомендации
АД — артериальное давление AK — антагонисты кальция АПГ — ангиопульмонография АРЭ — антагонисты рецепторов эндотелина АСК — ацетилсалициловая кислота ВПС — врожденные пороки сердца ГМК — гладкие мышечные клетки
ДЗЛА — давление заклинивания в легочной артерии ДЛА — давление в легочной артерии
ДЛАср. — среднее давление в легочной артерии ДМЖП — дефект межжелудочковой перегородки ДМПП — дефект межпредсердной перегородки ДПП — давление в правом предсердии ИЛГ — идиопатическая ЛГ
ИФДЭ-5 — ингибитор фосфодиэстеразы 5-го типа КЖ — качество жизни
КЛОС — катетеризация правых отделов сердца КТ — компьютерная томография
ЛА — легочная артерия
ЛАГ — легочная артериальная гипертония
ЛВОБ — легочная веноокклюзионная болезнь
ЛГ — легочная гипертония
ЛЖ — левый желудочек
ЛСС — легочное сосудистое сопротивление
МНО — международное нормализованное отношение МРТ — магнитно-резонансная томография
НПВ — нижняя полая вена
ОАП — открытый артериальный проток
ОФП — острые фармакологические пробы
ОЦК — объем циркулирующей крови
ПГ — простагландины nrEj — простагландин Et ПЖ — правый желудочек ПЛГ — первичная ЛГ
ПОЛК — пероральные антикоагулянты
ПП — правое предсердие
ПСС — предсердная септостомия
СВ — сердечный выброс еДЛА — систолическое ДЛА СИ — сердечный индекс
СЛШ — системно-легочные шунты
СН — сердечная недостаточность
ТШХ — тест с 6-минутной ходьбой
ТЭЛА — тромбоэмболия легочной артерии
ФВД — функция внешнего дыхания
ФК — функциональный класс
ФР — фактор риска
ХОБЛ — хроническая обструктивная болезнь легких
ХСН — хроническая сердечная недостаточность
ХТЭЛГ — хроническая тромбоэмболическая легочная гипертония
ЦВД — центральное венозное давление цГМФ — циклический гуанозинмонофосфат ЧСС — частота сердечных сокращений
ЭКГ — электрокардиограмма
ЭТ -1 — эндотелии-1
ЭТА — рецептор ЭТ-1 типа А
ЭТВ — рецептор ЭТ-1 типа В
ЭхоКГ — эхокардиография
BMPR2 — bone morphogenic protein receptor-2 — рецептор 2-го типа белка костного морфогенеза
Легочная гипертензия (ЛГ) — группа заболеваний, характеризующихся прогрессирующим повышением легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ЦЛА), которое приводит к развитию правожелудочковой сердечной недостаточности (СН) и преждевременной смерти пациентов [1, 2].
В соответствии с Российскими рекомендациями по диагностике и лечению ЛГ (2007) диагноз ЛГ устанавливается при уровне среднего давления в легочной артерии (ДЛАср) >25 мм рт.ст. в покое и >30 мм рт.ст. при физической нагрузке [1]. В норме ДЛАср в покое составляет в среднем 14±3 мм рт.ст. и не превышает 20 мм рт.ст. В последние годы международные рекомендации рассматривают в качестве диагностического критерия уровень ДЛАср более 25 мм рт.ст. в покое по данным катетеризации правых отделов сердца [2]. Для оценки прироста ДЛА на высоте физической нагрузки необходимо проведение специальных исследований с целью стандартизации протоколов нагрузочного теста и установления диапазона нормальных значений.
Классификация ЛГ
Клиническая классификация ЛГ необходима для стандартизации диагностических подходов и лечебных мероприятий. На протяжении полувека она претерпела значительные изменения, начиная с 1973 г., когда в соответствии с согласительным документом экспертом выделено 2 категории: первичная Л Г (ПЛГ), или Л Г неустановленной этиологии, и вторичная ЛГ при выявлении причин или факторов риска (ФР) [1, 3]. В 1998 г. на II Мировом симпозиуме, посвященном проблеме ЛГ в Эвиане (Франция), впервые выделены категории Л Г на основании сходства патогенетических особенностей, клинической картины и подходов к лечению. С того времени выделяется 5 гомогенных групп ЛГ.
Клиническая классификация ЛГ
- Легочная артериальная гипертония (ЛАГ):
1.1. Идиопатическая ЛГ (ИЛГ)
1.2. Наследуемая ЛГ (мутации генов BMPR2, ALKI, эндоглин с или без наследственной геморрагической телеангиэктазии)
1.3.Индуцированная приемом лекарственных препаратов и токсинов
1.4. Ассоциированная с:
- диффузными заболеваниями соединительной ткани (ДЗСТ)
- ВИЧ-инфекцией
- портальной гипертензией
- врожденными пороками сердца — ВПС (системнолегочные шунты — СЛШ)
1.5. Персистирующая ЛАГ новорожденных
- Легочная веноокклюзионная болезнь (ЛВОБ)/легочный капиллярный гемангиоматоз
- ЛГ вследствие патологии левых отделов сердца:
- систолическая дисфункция
- диастолическая дисфункция
- клапанные пороки
- ЛГ, ассоциированная с патологией дыхательной системы и/или гипоксемией:
- хроническая обструктивная болезнь легких (ХОБЛ)
- интерстициальные заболевания легких
- другие заболевания легких со смешанными рестриктивными и обструктивными нарушениями
- синдром альвеолярной гиповентиляции
- высокогорная ЛГ
- нарушения дыхания во время сна
- Хроническая тромбоэмболическая Л Г
- Смешанные формы
- гематологические заболевания
- системные нарушения
- метаболические нарушения
- другие
Различают прекапиллярную и посткапиллярную формы ЛГ.
Критериями прекапиллярной ЛГ являются:
- ДЛАср >25 мм рт.ст. (по данным катетеризации правых отделов сердца — КПОС);
- давление заклинивания в легочной артерии (ДЗЛА) <15 мм рт.ст.;
- сердечный выброс (СВ) в норме или снижен.
Все указанные параметры должны измеряться в покое.
Такой гемодинамический вариант можно выявить при ЛАГ, ЛГ вследствие патологии легких, хронической тромбоэмболической легочной гипертонии (ХТЭЛГ), смешанных формах ЛГ.
Посткапиллярная ЛГ с ДЛАср >25 мм рт.ст. и ДЗЛА, превышающим 15 мм рт.ст., характерна для ЛГ вследствие патологии левых отделов сердца.
Группа 1 — ЛАГ. Это клиническое состояние, характеризующееся наличием прекапиллярной ЛГ в отсутствие других причин повышения ДЛА, таких как заболевания легких, хронической тромбоэмболии легочной артерии (ТЭЛА) и т.д., в том числе редких болезней (группа 5) [1,2, 4, 5]. ЛАГ представлена идиопатической ЛГ (ИЛГ), наследуемыми формами ЛАГ; ЛАГ, индуцированной приемом лекарственных препаратов и токсинов, а также ассоциированными формами вследствие наличия ДЗСТ, портальной гипертензии, ВИЧ-инфекции, ВПС (СЛШ) и персистирующей ЛАГ новорожденных.
С 1951 г. под термином «первичная ЛГ» (ПЛГ) подразумевалась ЛГ неизвестной этиологии в отсутствие патологии сердца и легких: как семейные (до 6% от числа больных с ПЛГ), так и спорадические случаи [3]. В 2003 г. на III Всемирном симпозиуме, посвященном проблеме ЛГ, вместо термина «первичная» предложено использовать термин ИЛГ для обозначения спорадических случаев заболевания. Использование термина ПЛГ предполагало наличие термина «вторичная ЛГ», который отменен в классификации 1998 г., поскольку описывал гетерогенную группу заболеваний [4]. Для установления диагноза ИЛГ необходимо выявить критерии ЛАГ и исключить возможные ассоциированные формы, которые имеют сходную клиническую картину и пато морфологические изменения мелких легочных сосудов. ЛАГ характеризуется наличием прекапиллярной ЛГ в отсутствие заболеваний легких, хронической ТЭЛА, других болезней как возможной причины повышения ЛСС и ДЛАср. В настоящее время диагноз ИЛГ указывает на спорадическую форму заболевания, когда у пациента отсутствуют как наследственный анамнез, так и ФР. Наследуемая ЛАГ диагностируется при наличии семейного анамнеза и/или выявлении мутаций генов, кодирующих рецепторы 2-го типа белка костного морфогенеза — BMPR2 или активинпо- добной киназы — ALK1.
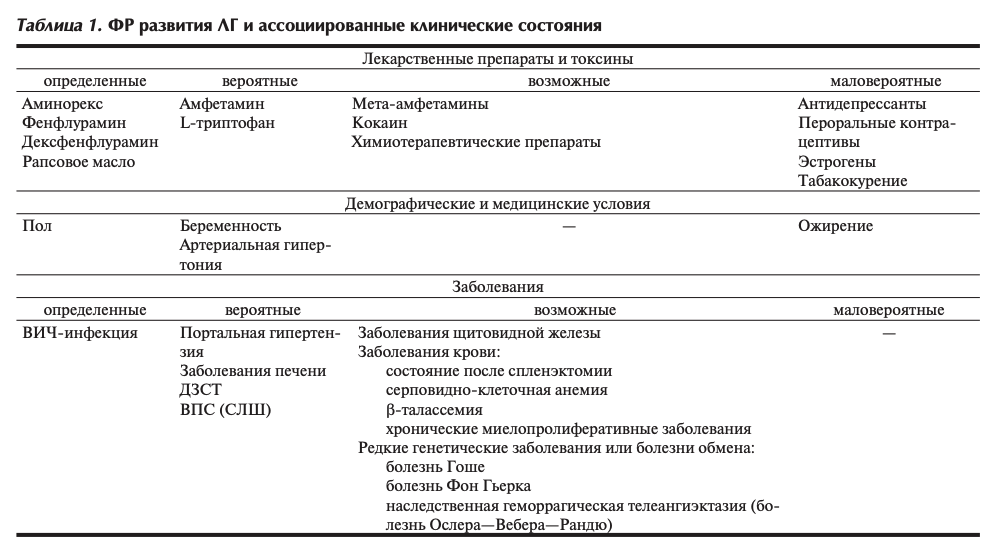
При ЛАГ, индуцированной приемом лекарственных препаратов и токсинов, в качестве ФР выступают лекарственные препараты и токсины, представленные в табл. 1
ЛАГ, ассоциированная с ДЗСТ — важная клиническая подгруппа ЛАГ, она может возникать при системной склеродермии, системной красной волчанке, смешанном заболевании соединительной ткани, более редко — при ревматоидном артрите, дерматомиозите или синдроме Шегрена.
ЛАГ является редким, но установленным осложнением ВИЧ. При портолегочной гипертонии ЛАГ сопровождает повышение давления в системе воротной вены.
При ЛАГ вследствие ВПС классификация врожденных СЛШ тип и размеры дефекта, наличие или отсутствие экстракардиальных аномалий и статус коррекции ВПС. Все эти факторы вносят вклад в развитие ЛАГ, синдрома Эйзенменгера и определяют прогноз у больных.
Синдром Эйзенменгера может быть обусловлен как простым, так и сложным (около 30% больных) пороком сердца. Среди простых пороков следует отметить наиболее частые — дефекты межжелудочковой перегородки
(ДМЖП), дефекты межпредсердной перегородки (ДМПП) и открытый артериальный проток (ОАП). Синдром Эйзенменгера развивается у 10% кооперированных больных старше 2 лет с ДМЖП любого размера, при ДМПП — примерно у 4—6% больных.
ЛАГ развивается почти у всех больных с ОАП, у 50% больных с ДМЖП при диаметре дефекта более 1 см и у 10% больных с ДМПП при диаметре дефекта более 2 см. У больных с малыми и средними размерами дефекта ЛГ развивается только в 3% случаев [1,2].
Обычно ранняя хирургическая коррекция порока сердца предотвращает развитие ЛГ. Однако у ряда больных тяжелая резидуальная ЛАГ развивается после хирургической коррекции порока. В таких клинических ситуациях часто неясно, имелось ли необратимое поражение легочных сосудов до хирургического лечения порока сердца или легочное сосудистое заболевание прогрессирует, несмотря на успешно проведенную операцию.
Классификация врожденных СЛШ сердца:
- Тип
Простой: ДМПП, ДМЖП, ОАП, аномалия легочных вен
Комбинированный: единственный желудочек; ДМПП + ДМЖП
- Размеры
Малый (при ДМПП менее 2 см и ДМЖП менее 1 см) Большой (при ДМПП более 2 см и ДМЖП более 1 см)
- Ассоциированные экстракардиальные аномалии
- Статус коррекции порока сердца:
- неоперированный порок
- частично скорректированный порок (дата)
- спонтанно или оперативно скорректированный порок (дата)
Л В ОБ и легочный капиллярный гемангиоматоз имеют сходную с ИЛГ морфологическую картину, подобные клинические проявления и гемодинамические характеристики, а также ФР, что позволяет причислить их к группе 1.
Группа 2 — ЛГ вследствие патологии левых отделов сердца. Поражения левого желудочка (ЛЖ) или клапанного аппарата левых отделов сердца приводят к повышению давления в левом предсердии, пассивное повышение ДЛА является следствием обратной передачи давления [2, 6].
Іфуппа 3 — ЛГ вследствие заболеваний легких и/или гипоксии. Основной причиной развития этой формы ЛГ является альвеолярная гипоксия вследствие хронических болезней легких, наличия нарушения дыхания во время сна, пребывания в высокогорье [1,7].
Іфуппа 4 — ХТЭЛГ. Ранее в эту группу включались различные формы обструкции легочных сосудов: эмболы, опухоли, инородные тела [8].
Группа 5 — ЛГ неизвестного или смешанного генеза включает 4 рубрики:
- Гематологические заболевания (миелопролиферативные заболевания, гемолитическая анемия, спленэктомия).
- Системные нарушения (васкулиты, саркоидоз, гистиоцитоз, лимфангиолейомиоматоз, нейрофиброматоз).
- Метаболические нарушения (болезнь Гоше, патология щитовидной железы).
- Другие состояния с сочетанным генезом Л Г (ши- стомоз, компрессия легочных сосудов, фиброзирующий медиастинит, хроническая почечная недостаточность с проведением гемодиализа).
ФР и ассоциированные клинические состояния при ЛГ
ФР развития ЛГ— любой экзогенный либо эндогенный фактор, состояние или заболевание, которое может играть предрасполагающую роль или способствовать развитию ЛГ. ФР могут быть фенотипические признаки (возраст, пол), лекарственные препараты, химические вещества, возбудители инфекции и т.д. [1, 4]. Термин «ассоциированные состояния» используется для обозначения таких клинических состояний, наличие которых связано со статически значимым увеличением вероятности развития ЛГ.
Абсолютный риск развития ЛГ при наличии известных ФР достаточно низкий, поэтому индивидуальная чувствительность или генетическая предрасположенность, по-видимому, играют приоритетную роль. Все ФР и ассоциированные состояния можно классифицировать в соответствии со степенью связи с ЛГ и наличия ее причины (см. табл. 1).
Различают «определенные» ФР развития ЛГ и ассоциированные состояния, что означает наличие взаимосвязей, подтвержденных несколькими независимыми наблюдениями, включая контролируемые исследования; «вероятные», о которых свидетельствует ряд не противоречащих друг другу наблюдений, в том числе серии случаев, однако им не приписывается роль установленной причины; «возможные», когда причинно-следственная связь предполагается на основании серии клинических наблюдений, регистров, мнении экспертов; «маловероятные», с наличием которых связывались случаи ЛГ, но в контролируемых исследованиях причинно-следственная связь не доказана.
Эпидемиология ЛГ
Эпидемиологические данные о распространенности ЛГ как в нашей стране, так и мире в настоящее время отсутствуют. По данным зарубежных наблюдений, при эхокардиографическом скрининге из 4579 больных признаки ЛГ (систолическое ДЛА — СДЛА — выше 40 мм рт.ст.) выявлялись у 10,5% больных [9]. Из них только у 4,2% пациентов имелась ЛАГ, у 78,7% — ЛГ вследствие патологии левых отделов сердца, у 9,7% — ЛГ на фоне патологии легких, у 0,6% — ХТЭЛГ, в 6,8% случаев установить диагноз не представлялось возможным [9].
Группа 1. ЛАГ относится к числу редких заболеваний. По эпидемиологическим данным, в общей популяции распространенность ЛАГ составляет 15 случаев на 1 млн населения, ИЛГ— 6 случаев на 1 млн населения, а заболеваемость ИЛГ достигает не более 1—2 случаев на 1 млн населения в год [1, 5, 9]. ИЛГ может возникнуть в любом возрасте независимо от пола и расы. Наиболее часто дебют заболевания отмечается в 20—30 лет у женщин, в 30— 40 лет у мужчин. Согласно данным регистра NIH (США), включавшем в 1981—1985 гг. 187 больных в среднем возрасте 36 лет, соотношение женщины/мужчины составило 1,7:1, при этом 9% пациентов были старше 60 лет, 8% — моложе 20 лет [10]. Средний период от дебюта заболевания до момента установления диагноза составлял около 2 лет. Регистры, выполненные в последние годы, указы ва-
ют на изменение демографических характеристик. Так, в европейских странах средний возраст больных ИЛГ на момент установления диагноза составил 52 года, соотношение женщины/мужчины — 1,6:1. По российским данным за последнее 10-летие наблюдения отмечается возрастание отношения женщины/мужчины до 6,5:1. Возраст на момент установления диагноза составляет у больных ИЛГ 31,2 года [11]. Период от дебюта заболевания до момента установления диагноза по-прежнему сохраняется около 2 лет.
В структуре ЛАГ по данным регистров на долю пациентов с ИЛГ приходится 39,2% больных, у 3,9% больных имеется семейный анамнез заболевания [2, 12]. При семейных формах ЛАГ в 70% случаев выявляются мутации гена, кодирующего рецептора 2-го типа белка костного морфогенеза (bone morphogenic protein receptor-2 — BMPR2). Он принадлежит к семейству трансформирующих факторов роста (transforming growth factor ß — TGF-ß) и наследуется по аутосомно-доминантному типу с неполной пенетрацией (20%). У больных с ЛАГ на фоне болезни Ослера—Рандю выявляются мутации генов, кодирующих рецепторы активинподобной киназы — ALK1 или эндоглина.
Среди ассоциированных форм преобладают случаи ЛАГ вследствие ДЗСТ (15,3%), у 11,3% — на фоне ВПС, у 10,4% — портальной гипертензии, у 9,5% — приема лекарственных препаратов/токсинов, у 6,2% — ВИЧ- инфекции [9].
Группа 2. У больных ЛГ на фоне заболеваний левых отделов сердца не обнаруживается генетического субстрата заболевания [6, 9]. Распространенность Л Г при хронической сердечной недостаточности (ХСН) возрастает по мере нарастания функционального класса (ФК). Признаки ЛГ выявляются у 60% больных с ХСН вследствие систолической дисфункции ЛЖ и почти у 70% пациентов с изолированной диастолической дисфункцией ЛЖ. Распространенность ЛГ при клапанных пороках левых отделов сердца зависит от выраженности дефектов и клинической симптоматики. ЛГ развивается практически во всех случаях поражений митрального клапана и почти в 65% случаев при стенозе устья аорты.
Группа 3. При ЛГ вследствие патологии легких и/или гипоксемии только в одном исследовании у больных ХОБЛ описан полиморфизм гена серотонина [12]. Распространенность ЛГ при ХОБЛ при наличии, по меньшей мере, одной госпитализации вследствие усугубления дыхательной недостаточности составляет почти 20% случаев. В развернутой стадии ХОБЛ частота развития ЛГ возрастает (>50%), однако степень повышения ДЛА обычно небольшая. При интерстициальных заболеваниях легких распространенность ЛГ составляет 32—39%. Сочетание фиброза и эмфиземы легких способствует более частому возникновению ЛГ.
Группа 4. При ХТЭЛГ генетический субстрат заболевания не обнаруживается [8,13]. Частота развития ХТЭОГ после перенесенной острой ТЭЛА варьируется от 0,5 до 3,8%. Считается, что у 50% больных с этой формой ЛГ в анамнезе может не быть острой ТЭЛА или тромбоза глубоких вен нижних конечностей.
Группа 5. В эту группу включены различные формы ЛГ неизвестного или смешанного генеза. Ввиду ее гетерогенности не представляется возможным оценить распространенность и наличие генетического субстрата болезни [9].
Патогенез ЛГ
В патогенезе заболевания выделяют 4 основных патофизиологических звена: 1) вазоконстрикция; 2) редукция легочного сосудистого русла; 3) снижение эластичности легочных сосудов; 4) облитерация легочных сосудов (тромбоз in situ, пролиферация гладких мышечных клеток - ГМК).
До настоящего времени точно не установлены процессы, играющие пусковую роль в развитии патологических изменений в легочных сосудах при ЛГ. Современные теории патогенеза ЛГ фокусируются на дисфункции или повреждении эндотелия, приводящих к нарушению баланса между сосудосуживающими и сосудорасширяющими веществами и развитию сужения сосудов [1,9,14]. Освобождение неидентифицированных хемотаксических веществ из поврежденных клеток эндотелия вызывает миграцию ГМК в интиму легочных артериол. Секреция локально активных медиаторов выраженного сосудосуживающего действия способствует развитию тромбоза in situ, трансформируя состояние легочного сосудистого русла из обычного антикоагулянтного (вследствие высвобождения простациклина и ингибитора тканевого активатора плазминогена) в прокоагулянтное. В результате образуется порочный круг: повреждение эндотелия неуклонно прогрессирует и приводит к ремоделированию легочных сосудов, нарастанию обструкции и облитерации сосудов. При этом патологические процессы затрагивают все слои сосудистой стенки, различные типы клеток — эндотелиальные, ГМК, фибробласты. В адвентиции отмечается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Воспалительные клетки и тромбоциты также играют существенную роль в развитии ЛГ. В плазме крови больных ЛГ повышены уровни провоспалительных цитокинов, в тромбоцитах нарушается метаболизм серотонина [15,16].
При исследовании вазоактивных веществ показаны повышенная продукция тромбоксана и мощного сосудосуживающего пептида эндотелиального происхождения с митогенными свойствами в отношении ГМК — эндотели- на-1 (ЭТ-1), дефицит вазодилататора простациклина и оксида азота (II), или NO [14,17].
У большинства больных с семейной ЛГ, а также у ряда больных со спорадическими случаями ЛГ (ИЛГ) выявляется ассоциация с мутациями гена BMPR2. Однако до сих пор не установлена патобиологическая взаимосвязь генетических нарушений и развития Л Г [1, 18]. Обращают внимание высокая частота ИЛГ и низкая пенетрация при семейной ЛГ (примерно 20% мутаций приводит к манифестации заболевания), которые указывают на то, что для развития заболевания необходимы дополнительные пусковые факторы. Это может быть полиморфизм генов, кодирующих NO-синтазу, карбимилфосфатсинтазу, синтез переносчиков серотонина, или другие стимулы, ответственные за контроль роста легочных сосудистых клеток. У отдельных пациентов, а также в семьях с наследственной геморрагической телеангиэктазией (болезнь Ослера—Вебера—Рандю) описаны мутации генов рецепторов ß-фактора некроза опухоли, активинподобной киназы-1, эндоглина [19].
Таким образом, отдельные патобиологические процессы в клетках и тканях больных ЛГ установлены, однако взаимодействие этих механизмов в развитии и прогрессировании заболевания точно неизвестно. Можно предположить, что наследственная предрасположенность реализуется под воздействием ФР, что приводит к изменениям клеток различных типов (тромбоциты, ГМК, эндотелиальные, воспалительные клетки), а также в экстрацеллюлярном матриксе микроциркуляторного русла легких [1,9].
Дисбаланс между тромботическими, митогенными, провоспалительными, сосудосуживающими факторами и механизмами обратного действия — антикоагулянтными, антимитогенными, сосудорасширяющими, способствует сужению сосудов и тромбозам, пролиферативным и воспалительным изменениям в легочном микроциркулятор- ном русле. Именно эти механизмы ответственны за развитие и прогрессирование патологических обструктивных процессов в легочных сосудах при ЛГ, которое приводит к увеличению ЛСС, перегрузке и декомпенсации правого желудочка (ПЖ), смерти больных.
Диагностика ЛГ
Стратегия диагностики при ЛГ предполагает проведение комплексного обследования с целью установления диагноза, оценки клинического класса и типа ЛГ, а также функционального и гемодинамического статуса пациентов. Целесообразно выделить следующие этапы диагностического и дифференциально-диагностического процесса [1]:
Этапы диагностики ЛГ
I. Подозрение на наличие у больного ЛГ
- клинические симптомы
- физическое обследование
- процедуры скрининга
- случайные находки
II. Верификация диагноза ЛГ
- электрокардиография
- рентгенография органов грудной клетки
- трансторакальная эхокардиография (ЭхоКГ)
- катетеризация правых отделов сердца, тесты на вазореактивность
III. Установление клинического класса ЛГ
- оценка функции внешнего дыхания (ФВД)
- анализ газового состава артериальной крови
- вентиляционно-перфузионная сцинтиграфия легких
- компьютерная томография (КТ)
- ангио пульмонография (АПГ)
- оценка ЛАГ:
- тип: анализы крови, иммунология, тест на ВИЧ, УЗИ внутренних органов;
- функциональная способность больных: тест с 6-минутной ходьбой (ТШХ), кардиопульмональный тест (максимальное потребление кислорода, анаэробный порог)
Этап I. Подозрение на наличие ЛГ (ЛГ—предварительный диагноз)
Клинические признаки и симптомы, указывающие на наличие ЛГ. Все клинические симптомы ЛГ, выявляемые при расспросе и осмотре больных, непатогномоничны, что часто затрудняет раннюю диагностику заболевания [ 1, 14]. Спектр клинических симптомов (одышка, слабость, повышенная утомляемость, боли в области сердца, головокружения и синкопальные состояния) обусловлен главным образом двумя основными причинами — нарушением транспорта кислорода и снижением СВ. Кроме того, характерными симптомами ЛГ являются кашель и кровохарканье.
На начальном этапе заболевание может протекать бессимптомно, тем не менее одышка при физических нагрузках — наиболее частый симптом дебюта заболевания.
Одышка инспираторного характера выражена в различной степени: от минимальной, возникающей лишь при значительной нагрузке, до возникающей даже в покое и при незначительных усилиях. Как правило, с течением болезни одышка прогрессивно нарастает. При этом приступы удушья обычно не наблюдаются.
Боли в грудной клетке обычно имеют неопределенный характер: давящие, ноющие, колющие, сжимающие; без четкого начала, продолжительностью от нескольких минут до суток, усиливаются при физических нагрузках, обычно не купируются приемом нитроглицерина. У ряда пациентов с ЛГ отмечаются типичные приступы стенокардии — интенсивные приступообразные боли сжимающего характера, локализующиеся за грудиной, иногда иррадиирующие в левую лопатку и левую руку, что может маскировать ишемическую болезнь сердца и даже острый инфаркт миокарда.
Более чем у 50% больных ЛГ отмечаются головокружения и обмороки, провоцируемые физической нагрузкой. Обычная продолжительность обмороков до 2—5 мин, иногда до 20—25 мин. Большинство больных жалуются на сердцебиения и перебои в работе сердца, при этом на электрокардиограмме (ЭКГ) злокачественные нарушения ритма, как правило, не регистрируются, чаще имеется синусовая тахикардия.
Кашель отмечается у */ больных ЛГ, связан, повидимому, с застойными явлениями и присоединением воспалительных изменений в легких и бронхах.
Кровохарканье (до 10% больных с ЛГ) обычно возникает однократно, но может продолжаться несколько дней, обусловлено как тромбоэмболиями в мелкие ветви легочной артерии (ЛА), так и разрывом мелких легочных сосудов в связи с высокой ЛГ.
При физическом осмотре пациентов с ЛГ наиболее часто выявляется акроцианоз, при длительном течении болезни — изменение фаланг пальцев по типу «барабанных палочек» и ногтей в виде «часовых стекол», изменение формы грудной клетки у больных с эмфиземой легких («бочкообразная» грудная клетка). При развитии правожелудочковой СН у больных отмечаются набухшие шейные вены, гепатомегалия, периферические отеки, асцит. При аускультации с большой долей вероятности можно выявить патологию легких и сердца, а также определить выраженность ЛГ. Характерными аускультативными признаками ЛГ служат акцент II тона над ЛА, пансистолический шум трикуспидальной недостаточности, шум Грехема-Стилла.
Симптомы, связанные с сопутствующими заболеваниями. Ортопноэ и пароксизмальное нарастание одышки в ночные часы указывает на повышение венозного давления и застойные явления в малом круге кровообращения вследствие поражения левых отделов сердца [1, 9]. Артралгии, кожные проявления, лихорадка и другие симптомы заболеваний соединительной ткани указывают на связь одышки с ДЗСТ. Храп и ночное апноэ, связь одышки с нарушениями дыхания во время сна обусловливают необходимость проведения АПГ.
Симптомы прогрессирования заболевания. Отеки нижних конечностей, асцит, снижение аппетита, выраженная слабость свидетельствуют о дисфункции ПЖ, нарастании трикуспидальной недостаточности. Для оценки динамики заболевания и эффективности терапии необходимо количественно оценивать толерантность к физическим нагрузкам (функциональный класс, ТШХ).
Анамнестические данные. Учитывая установленный генетический аспект ЛАГ, необходимо исключить характерную клиническую симптоматику у родственников больного. Следует учитывать потенциальный риск развития ЛАГ при применении лекарственных препаратов, токсинов (анорексики, рапсовое масло), химиотерапии (циклофосфан, блеомицин и др.) [2]. Диагноз высоко вероятен у больных с симптомами ЛАГ, возникающими на фоне ДЗСТ, портальной гипертензии, ВИЧ-инфекции, ВПЧ со сбросом крови слева направо, венозных тромбозов.
Этап II. Верификация диагноза ЛГ
При обнаружении тех или иных патологических изменений, указывающих на наличие ЛГ, необходимо провести ряд инструментальных исследований.
Электрокардиография выявляет признаки гипертрофии и перегрузки ПЖ, дилатации и гипертрофии правого предсердия — ПП (p-pulmonale), отклонение электрической оси сердца вправо. Гипертрофия ПЖ выявляется у 87%, отклонение электрической оси сердца вправо — у 79% больных ИЛГ. Учитывая, что чувствительность электрокардиографии при ЛАГ составляет лишь 55%, а специфичность — 70%, метод не всегда применим для скрининга в диагностике ЛАГ. У больных с тяжелой ЛАГ может обнаруживаться неизмененная ЭКГ [1, 20].
Если изменения на ЭКГ возникают лишь при достаточно выраженной гипертрофии правых отделов сердца, то с помощью векторкардиографии можно диагностировать эти изменения в более ранних стадиях [1]. Фонокардиография позволяет не только диагностировать гипертонию или гиперволемию в малом круге кровообращения, но и относительную недостаточность трикуспидального клапана и клапана ЛА, но и обнаруживать приобретенные и ВПС, вызывающие ЛГ [14].
Рентгенография органов грудной клетки позволяет уточнить этиологию ЛГ: выявить интерстициальные заболевания легких, приобретенные и врожденные пороки сердца, а также судить о тяжести ЛГ. Основными рентгенологическими признаками ЛГ служат выбухание ствола и левой ветви ЛА, которые формируют в прямой проекции II дугу по левому контуру сердца, расширение корней легких, увеличение правых отделов сердца [1,9,14]. У 90% больных ИЛГ на момент установления диагноза, у больных с мягкой ЛГ вследствие заболеваний левых отделов, при ЛВОБ рентгенологическая картина легких и сердца может быть не изменена. У большинства больных ИЛГ отмечается повышение прозрачности легочных полей на периферии за счет обеднения легочного рисунка.
Трансторакальная ЭхоКГ считается наиболее ценным неинвазивным методом диагностики ЛГ, так как не только позволяет оценить уровень ДЛА, но и дает важную информацию о причине и осложнениях ЛГ. С помощью этого метода можно исключить поражения митрального, аортального клапанов, болезни миокарда, ВПС с шунтированием крови слева направо, приводящие к развитию ЛГ [1, 9, 21].
У пациентов с ЛГ выявляется расширение полостей ПП и ПЖ, утолщение передней стенки ПЖ, изменяется характер движения межжелудочковой перегородки: в систолу она смещается парадоксально в сторону ПЖ.
Допплерография позволяет измерить скорость кровотока в сердце, что дает возможность неинвазивно определить ДЛА [22]. Наиболее тесная корреляция между расчетным и «прямым» измерением СДЛА получена при определении СДЛА по степени трикуспидальной регургитации с помощью непрерывно волнового метода. В отсутствие обструкции выносящего тракта ПЖ по степени трикуспидальной регургитации можно расчетным путем определить СДЛА с помощью модифицированного уравнения Бернулли: АР=4Р2, где АР — градиент давления через трехстворчатый клапан, V — скорость трикуспидальной регургитации. Для подсчета СДЛА методом определения градиента давления через трикуспидальный клапан к градиенту должно быть добавлено давление в ПП (ДПП). По современным рекомендациям СДЛА определяют с учетом давления в нижней полой вене (НПВ) и ее колла- бирования на вдохе. Исследование НПВ позволяет объективизировать явления застоя крови в большом круге кровообращения, а также косвенно оценить уровень систолического ДПП, т.е. центрального венозного давления (ЦВД). Исследование проводят из субкостального доступа, датчик устанавливают под мечевидным отростком и ориентируют в позиции длинной оси НПВ. Диаметр НПВ уменьшается на глубоком вдохе, когда отрицательное давление в грудной клетке ведет к увеличению наполнения ПЖ из системных вен. Диаметр НПВ и процент уменьшения диаметра во время вдоха коррелируют с ДПП. У здорового человека при нормальном ДПП, равном обычно 5 мм рт.ст., диаметр НПВ меньше 1,7 см, и она спадается после глубокого вдоха более чем на 50%. При правожелудочковой недостаточности, повышении конечного диастолического давления в ПЖ и ДПП наблюдается затруднение притока крови к сердцу. Поэтому коллабирование НПВ во время вдоха существенно уменьшается, что служит показателем застоя крови в венах большого круга кровообращения и свидетельствует о повышении ДПП (ЦВД). Дилатация НПВ более 1,7см при нормальном респираторном коллапсе более 50% предполагает среднее увеличение давления в ПП (6—10 мм рт.ст.). Если респираторный коллапс менее 50%, давление в ПП составляет от 10 до 15 мм рт.ст. Наконец, дилатация НПВ без коллапса на вдохе предполагает значительное увеличение давления в ПП более 15 мм рт.ст. Напротив, уменьшение диаметра НПВ (обычно менее 1,2 см) со спонтанным колла- бированием часто наблюдается при уменьшении объема циркулирующей крови (ОЦК) [9].
При определении воспроизводимости результатов следует обратить внимание на выраженную ошибку при расчете СДЛА (4,9—8 мм рт.ст.) методом определения градиента давления через трикуспидальный клапан. Такие
погрешности могут только отчасти приписываться несинхроннаированности инвазивных и допплеровских исследований или субъективности скоростных измерений. Воспроизводимость результатов измерения СДЛА через трикуспидальный клапан зависит в основном от качества записи допплеровского спектра.
Систолическое давление в ПЖ у здоровых людей в возрасте 1—89 лет составляет 28±5 мм рт.ст. (15—57 мм рт.ст.) и увеличивается с увеличением возраста и индекса массы тела. Трикуспидальная регургитация определяется у большинства больных ЛГ (74%). В исследованиях установлена корреляция (г=0,57—0,93) между давлением, измеренным при ЭхоКГ и во время катетеризации правых отделов сердца и ЛА.
Внутривенное введение изотонического раствора натрия хлорида позволяет определить открытое овальное окно, ДМПП типа венозного синуса [14]. Для подтверждения открытого овального окна или небольшого ДМПП, оценки его точного размера требуется проведение чреспищеводной ЭхоКГ.
Оценка гемодинамики. КПОС должна проводиться всем больным ЛАГ для подтверждения диагноза, оценки тяжести, решения вопроса о выборе патогенетической терапии и оценки ее эффективности [1,9,14]. Рекомендуется повторять КПОС для подтверждения клинического ухудшения, решения вопроса о необходимости назначения комбинированной терапии.
На этапе верификации диагноза КПОС проводится для оценки тяжести гемодинамических нарушений и проведения тестов на вазореактивность [11]. Необходимо оценивать следующие параметры: ДПП, ДЛА (систолическое, диастолическое, среднее), ДЗЛА, СВ (методом термодилюции или по Фику при СЛШ), артериальное давление (АД), легочное и системное сосудистое сопротивление, насыщение кислородом артериальной и венозной крови (а также крови из верхней полой вены при СЛШ).
ЛАГ определяется при ДЛАср более 25 мм рт.ст. в покое и более 30 мм рт.ст. при нагрузке, ДЗЛА менее 15 мм рт.ст., ЛСС более 3 мм рт.ст/л/мин (единицы Вуда). Катетеризация левых отделов сердца необходима в редких случаях, когда не удается измерить ДЗЛА.
Верификация диагноза ЛГ с помощью катетеризации правых отделов сердца необходима у больных с мягкой Л Г по данным допплеровского исследования, имеющих II и III ФК (ВОЗ) для определения тактики лечения. У больных с умеренной и тяжелой ЛГ проведение КПОС с определением гемодинамических показателей необходимо для оценки прогноза.
Повышенное среднее ДПП и ДЛАср, низкий СВ и насыщение венозной крови кислородом свидетельствуют о худшем прогнозе у больных ИЛГ.
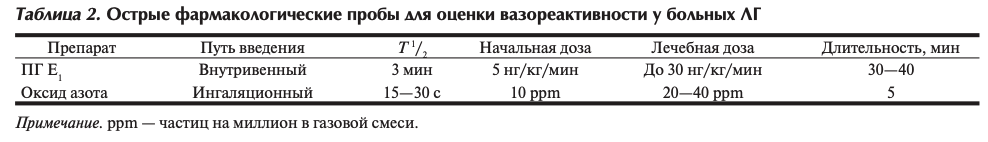
С помощью острых фармакологических проб (ОФП) во время КПОС и ЛА можно определить потенциальный эффект лечения антагонистами кальция (АК). Для проведения ОФП используются короткодействующие вазодилататоры, воздействующие на малый круг кровообращения: простагландин Е, (ПГЕ,) и ингаляционный оксид азота (табл. 2).
Положительная ОФП определяется при снижении ДЛАср более чем на 10 мм рт.ст., достижении абсолютной величины ДЛАср менее 40 мм рт.ст. при увеличении или в отсутствие динамики СВ. Только 25% больных ИЛГ с положительной ОФП можно с успехом длительно лечить АК. Из-за возможных выраженных осложнений не следует назначать АК эмпирически без проведения ОФП [1, 14].
У больных хронической ТЭЛА, ВПС необходимо также оценивать ОФП для определения потенциального эффекта терапии АК.
Традиционно АПГ считается наилучшим методом, позволяющим установить показания к эндартерэктомии. У больных с подозрением на хроническую ТЭЛА, не подтвержденную при сцинтиграфии легких, для диагностики дистальных обструкций легочного сосудистого русла целесообразно проведение АПГ с селективным контрастированием правой и левой основных ветвей ЛА и анализом в множественных проекциях. При этом риск развития осложнений минимален (<1%) в случае выполнения высококвалифицированным персоналом, применения современных контрастных веществ [23].
Этап III. Установление клинического класса ЛГ
Следующий этап диагностики направлен на определение клинического класса ЛГ с учетом клинической классификации.
На этом этапе необходимо провести трансторакальную ЭхоКГ, легочные функциональные тесты (газовый состав артериальной крови), вентилляционно перфузионную сцинтиграфию легких, КТ, АПГ.
Исследование ФВД позволяет оценить вклад поражения дыхательных путей или паренхиматозного заболевания легких в развитие ЛГ: выявить обструктивные или рестриктивные изменения с целью дифференциальной диагностики ЛГ и уточнения тяжести поражения легких [1,7]. Для больных ЛГ характерны уменьшение диффузионной способности монооксида углерода (40—80% от нормы), небольшое или умеренное снижение легочных объемов, нормальное или незначительно сниженное РаО2 и обычно сниженное из-за альвеолярной гипервентиляции РаСО2. При необратимой обструкции дыхательных путей свидетельствует в пользу ХОБЛ как причины гипоксической ЛГ. Сниженные легочные объемы и диффузионная способность легких могут указывать на интерстициальное заболевание легких. Полисомнография позволяет исключить обструктивные нарушения во время сна и эпизоды десатурации.
Вентиляционно-перфузионная сцинтиграфия легких. У больных ЛГ можно обнаружить как абсол ютно неизмененную картину, так и небольшие периферические субсегментарные дефекты перфузии без нарушенной вентиляции [24]. Этот метод является наиболее информативным в диагностике клинического класса 4 — хронической ТЭЛАи ее ветвей. При этом дефекты перфузии обнаруживаются в долевых и сегментарных зонах. В дифференциальной диагностике ИЛГ и хронической тромбоэмболии чувствительность вентиляционно-перфузионной сцинтиграфии легких составляет 90—100%, а специфичность — 94—100% [1]. У больных с паренхиматозной болезнью легких перфузионные дефекты совпадают с дефектами вентиляции.
КТ играет важную роль в дифференциальной диагностике ЛГ. Обеспечивая детальное изображение легочной паренхимы, КТ позволяет диагностировать интерстициальные заболевания легких и эмфизему [25]. При застойной левожелудочковой недостаточности могут обнаруживаться феномен «матового стекла» и утолщение интерлобулярных септ. Диффузное двустороннее утолщение интерлобулярных септ, наличие мелких, плохо очерченных очаговых теней указывает на легочный капиллярный гемангиоматоз. КТ позволяет оценить состояние легочных полей, а также сердца и сосудов с помощью контрастирования полостей сердца и просвета сосудов при внутривенном введении 80—120 мл контрастного вещества. Картина КТ при хронической тромбоэмболии — полная оккл юзия ЛА или ее ветвей, наличие эксцентрических дефектов вследствие тромбозов или реканализованные тромбы [1, 13]. При выявлении признаков хронической ТЭЛА больным показана АПГ в дополнение к катетеризации правых отделов сердца.
Магнитно-резонансная томография (МВТ) используется у больных ЛГ для оценки патологических и функциональных изменений серд ца и легочного кровообращения и обычно не применяется в повседневной практике. Главное преимущество метода — трехмерный (объемный) способ получения изображений без артефактов от костей и легочных полей, высокое пространственное разрешение, а также отсутствие лучевой нагрузки, неинвазивность, естественный контраст от движущейся крови [14, 26]. Чаще всего МРТ используют при обследовании пациентов с ИЛГ, ТЭЛА, ВПС со сбросом крови слева направо.
Этап IV. Оценка ЛГ (тип, толерантность к физическим нагрузкам, гемодинамические параметры)
Больным ЛГ необходимо проводить общепринятые лабораторные тесты: биохимический и общий анализы крови, исследовать коагулограмму, уровни D-димера, антитромбина III, протеина С для исключения тромбофилии, оценивать гормональную функцию щитовидной железы, определять титр антител к фосфолипидам (волчаночный антикоагулянт, антитела к кардиолипину) [27, 28]. Примерно у */3 больных ИЛГ повышен титр анти нуклеарных антител (менее 1:80). Больные ЛГ с существенно повышенным титром антител или подозрением на ДЗСТ нуждаются в консультации ревматолога. Всем больным в обязательном порядке следует проводить тест на ВИЧ-инфекцию.
Анализы крови и иммунологические показатели
Анализы крови: общий (уровень гемоглобина, эритроцитов, гематокрита, лейкоцитов, тромбоцитов); биохимический (оценка функции почек, печени, содержания белка); иммунологический (антитела к кардиолипину, волчаночный антикоагулянт); коагулограмма крови; гормоны щитовидной железы, тиреотропный гормон; серологический тест на ВИЧ.
УЗИ внутренних органов позволяет надежно исключить цирроз печени и/или портальную гипертензию [29]. Использование цветовой допплерографии позволяет дифференцировать пассивную портальную гипертензию вследствие правожелудочковой СН или вследствие возникновения транспеченочного венозного градиента при циррозе печени.
Функциональная способность. Объективная оценка функциональной способности больных ЛГ необходима для оценки тяжести ЛГ и динамики клинического состояния на фоне терапии. При изучении толерантности к физическим нагрузкам наиболее часто используется ТШХ и кардиопульмональный нагрузочный тест с оценкой газообмена.
ТШХ — простой, дешевый, имеющий прогностическое значение. Расстояние, пройденное при ТШХ, обратно коррелирует с функциональным классом (ВОЗ) [1, 9]. Тест обычно дополняется оценкой одышки по Боргу. Снижение насыщения кислородом артериальной крови более чем на 10% во время ТШХ указывает на повышенный риск смерти. Расстояние, пройденное при ТШХ, в большинстве многоцентровых исследований у больных Л Г используется в качестве «первичной конечной точки».
Кардиопульмональный нагрузочный тест дает возможность оценить вентиляцию и газообмен во время дозированной физической нагрузки (индекс максимального потребления кислорода, анаэробный порог) [1]. У больных ЛГ снижены анаэробный порог и максимальное потребление кислорода. Кардиопульмональный нагрузочный тест ранее использовался в многоцентровых исследованиях, но его очевидных преимуществ перед ТШХ не получено, так как технически он сложнее, не позволяет оценивать эффективность терапии, а полученные результаты зависят от опыта медицинского персонала.
Оценка тяжести ЛГ. ФК Для характеристики тяжести ЛГ используется функциональная классификация (ВОЗ) — модифицированный вариант классификации Нью-Йоркской ассоциации сердца (NYHA), предложенной для пациентов с недостаточностью кровообращения [1,9]:
Класс I — больные ЛГ без ограничения физической активности. Обычная физическая активность не вызывает появления одышки, слабости, боли в грудной клетке, головокружения.
Класс II — больные ЛГ, приводящей к некоторому снижению физической активности. В покое они ощущают себя комфортно, однако обычная физическая активность сопровождается появлением одышки, слабости, боли в грудной клетке, головокружения.
Класс III — больные ЛГ, приводящей к выраженному ограничению физической активности. Небольшая физическая активность вызывает появление одышки, слабости, боли в грудной клетке, головокружения.
Класс IV — больные ЛГ, неспособные выполнять любую физическую нагрузку без перечисленных клинических симптомов. Одышка или слабость могут наблюдаться даже в покое, дискомфорт возрастает при минимальной нагрузке.
Биопсия легких. Проведение как открытой, так и торакоскопической биопсии легких сопряжено с повышенным риском развития осложнений, в том числе фатальных. В клинической практике этот метод обычно не используется [9].
Факторы, влияющие на прогноз больных ЛГ:
- ФК (ВОЗ)
- наличие признаков правожелудочковой СН
- толерантность к физическим нагрузкам
- расстояние, пройденное при ТШХ
- уровень пикового потребления кислорода
- эхокардиографические параметры
- наличие перикардиального выпота
- размер ПП, ЛЖ
- гемодинамические параметры (ДПП, ДЛА,р, СВ)
- насыщение венозной крови кислородом
- отрицательная ОФП
- анализы крови
- гиперурикемия
- уровень натрийуретического пептида
- тропонин
- норадреналин -ЭТ-1 [1,9]
Прогноз больных. Рекомендуется оценивать тяжесть ЛАГ у больных с помощью набора данных, включающих параметры клинического, функционального, гемодинамического статуса, уровня биомаркеров, параметров ЭхоКГ [9, 30]. Рекомендуется регулярное наблюдение каждые 3—6 мес в том числе у больных ЛАГ со стабильным течением болезни. Рекомендуется целевая стратегия лечения больных ЛАГ. Так, в результате лечения желательно достигать расстояния в ТШХ более 400 м. Пациенты моложе 50 лет на фоне терапии обычно способны проходить более 500 м, несмотря на наличие тяжелой ЛГ и дисфункции ПЖ. Таким больным рекомендуется проводить кардиопульмональный тест с определением пикового потребления кислорода, вентиляционной эффективности, максимального систолического АД на высоте нагрузки и/или КЛОС для объективной оценки функции ПЖ. Определение уровня биомаркеров, эхокардиографических и гемодинамических параметров позволяет определить стабильность состояния больного. Параметры, позволяющие определить прогноз у больных ЛАГ, стратегия динамического наблюдения представлены в табл. 3,4.
Лечение больных ЛГ
На протяжении многих десятилетий в лечении больных ЛГ наблюдался крайне медленный прогресс. Ситуация существенно изменилась в последние годы, благодаря значительному увеличению числа контролируемых исследований [9, 31]. АК, антикоагулянты, сердечные гликозиды, кислородотерапия в настоящее время, несмотря на отсутствие соответствующих рандомизированных исследований, составляют стандартную терапию, широко применяемую у больных ЛГ [1, 14]. Вместе с тем появились новые группы лекарственных препаратов, эффективность и безопасность которых доказана результатами контролируемых исследований.
Общие рекомендации. Для всех без исключения больных Л Г актуальны общие рекомендации, соблюдение которых позволяет уменьшить риск возможного ухудшения течения заболевания вследствие определенных обстоятельств и внешних факторов [9]. Их роль сложно переоценить. Часто диагноз ЛГ становится причиной социальной изоляции, поэтому мотивация больных участвовать в сообществах больных крайне важна для повышения их уверенности в себе, общего настроения, состояния, общения.
Физическая активность. Больные ЛГ должны подвергаться нагрузкам в пределах той физической активности, которая возможна исходя из клинической симптоматики [9, 32]. В повседневной жизни пациенты с ЛГ должны избегать возникновения таких потенциально опасных симптомов, как выраженная одышка, синкопе, боли в грудной клетке. Запрещаются физические нагрузки после еды, при неблагоприятном температурном режиме. В то же время больным ЛГ следует поддерживать адекватное состояние скелетной мускулатуры, выполняя ежедневные дозированные и регулируемые физические упражнения, не вызывающие указанных симптомов, что способствует улучшению качества жизни (КЖ) и клинической симптоматики. Показана роль специальных про грамм по реабилитации больных для улучшения показателей физического статуса. Необходимым условием является постоянный контроль медицинского персонала за проведением комплекса реабилитации. Ежедневные дозированные и регулируемые физические нагрузки способствуют улучшению КЖ и симптоматики заболевания.
Беременность, роды, заместительная гормонотерапия в постменопаузе связаны с повышенными риском ухудшения течения заболевания и смертности.
В соответствии с мнением экспертов ВОЗ, рекомендациями Европейского общества кардиологов беременность противопоказана больным ЛГ, так как материнская смертность составляет 30—50% [9, 33]. Всем пациенткам с ЛГ репродуктивного возраста должны быть рекомендованы соответствующие методы контрацепции. У больных ЛГ наиболее предпочтительно использование контрацептивов, не содержащих эстроген, барьерных методов контрацепции, проведение хирургической стерилизации. При оценке мер контрацепции важно подчеркнуть, что барьерные методы безопасны, но не обеспечивают надежного контрацептивного эффекта. Препараты прогестерона (медроксипрогестерона ацетат, этоногестрел) эффективны и безопасны в связи с отсутствием потенциального риска, связанного с применением эстрогенов, которые ранее применялись в пероральных контрацептивах. В значительном числе исследований не удалось выявить взаимосвязи использования пероральных контрацептивов и возникновением ЛГ. Бозен- тан может снижать эффективность пероральных контрацептивов [9]. Для достижения надежного эффекта целесообразно сочетать два метода контрацепции. Возможно также применение интравагинальных препаратов. В случае беременности больная должна быть предупреждена о высоком риске смерти и необходимости прерывания беременности.
Заместительная гормональная терапия показана пациенткам с ЛГ в постменопаузе лишь при выраженных климактерических симптомах и обязательно при условии достижения адекватной гипокоагуляции с подбором адекватной антикоагулянтной терапии.
Путешествия. Гипоксия усугубляет вазоконстрикцию при ЛГ, поэтому во время полетов на авиатранспорте для больных ЛГ необходимо обсуждать возможность проведения дополнительной кислородотерапии [9]. До настоящего времени не проводились клинические исследования, которые бы доказали необходимость дополнительной ок- сигенотерапии больным ЛГ во время авиаперелетов. Теоретически, исходя из физиологических аспектов гипоксии, можно предполагать, что она целесообразна у больных с III—IV ФК при парциальном давлении кислорода в артериальной крови менее 8 кПа (60 мм рт.ст.). Скорость 2 л/мин достаточна для повышения давления кислорода до уровня, соответствующего таковому на уровне моря. Таким больным оксигенотерапия необходима при полетах на высоте более 1500—2000 м. Всем пациентам, совершающим авиаперелеты в другие страны, важно рекомендовать иметь при себе медицинские документы о диагнозе, местонахождении ближайшего местного центра ЛГ, контактной информации с ним.
Психологическая поддержка и помощь. Больные ЛГ испытывают существенные ограничения в физической активности по сравнению с тем образом жизни, к которому они привыкли до возникновения болезни. Информация о тяжести заболевания, полученная больными из немедицинских источников, приводит к повышенной тревоге или депрессии, что существенно снижает КЖ таких пациентов. Для их адаптации в жизни и обществе, понимания своей болезни показаны помощь психолога или психиатра, а также под держка других пациентов и их семей.
Профилактика инфекционных заболеваний. Возникновение пневмонии усугубляет течение ЛГ, всегда обусловливает необходимость проведения быстрой диагностики и немедленного начала эффективного лечения. У 7% больных ЛГ пневмонии служат причиной смерти. Следует рекомендовать пациентам вакцинацию от гриппа и пневмококковой инфекции.
Хирургическая помощь. Предпочтительным видом анестезиологического пособия является эпидуральная анестезия, которая переносится больными ЛГ лучше, чем общая анестезия. Необходимо осуществлять перевод больных с пероральной терапии на внутривенное введение препаратов. Хирургические вмешательства связаны с повышенным риском для больных ЛГ, особенно при ФК ГѴ, а также в случае торакальной или абдоминальной операции. Терапию антикоагулянтами следует прекращать на максимально короткое время. В послеоперационном периоде больным ЛГ обязательно проводится профилактика тромбозов глубоких вен голеней.
Контроль уровня гемоглобина. Больные ЛГ высокочувствительны к снижению уровня гемоглобина в крови, поэтому даже невыраженная анемия требует быстрого эффективного лечения. У больных Л Г с выраженной гипоксией, например на фоне легочно-системных шунтов, возникает вторичный эритроцитоз. При уровне гематокрита более 65% и наличии симптомов, указывающих на повышенную вязкость крови (головные боли, нарушение концентрации внимания), показаны кровопускания.
Лекарственная терапия. Следует выделить 2 раздела лекарственной терапии у больных ЛГ: поддерживающая (пероральные антикоагулянты и дезагреганты, диуретики, сердечные гликозиды, оксигенотерапия) и специфическая, включающая АК, простаноиды, антагонисты рецепторов эндотелина (АРЭ), ингибиторы фосфодиэстеразы 5-го типа (ИФДЭ-5) [9].
Поддерживающая терапия
Антикоагулянты и дезагреганты. Показания к назначению пероральных антикоагулянтов (ПОАК) у больных ЛГ связаны с традиционными ФР развития венозных тромбоэмболий, такими как СН, малоподвижный образ жизни, а также предрасположенностью к тромботическим изменениям в легочных сосудах — микроциркуляторном русле и эластических ЛА [34, 35].
Благоприятные эффекты ПОАК у больных ЛГ показаны в одноцентровых ретроспективных исследованиях у больных ИЛГ и ЛАГ вследствие приема аноректиков. В настоящее время их назначение показано больным ИЛГ, наследуемой ЛАГ, ассоциированной ЛАГ на фоне приема аноректиков. Целевой уровень международного нормализованного отношения (МНО) при ИЛГ составляет 1,5—2,5. При других формах ЛГ решение о назначении ПОАК должно в каждом случае приниматься индивидуально на основании оценки соотношения риска и эффективности. В частности, у больных портолегочной ЛГ высок риск развития кровотечения из расширенных вен пищевода [ 1].
При ХТЭЛГ целевые уровни МНО на фоне терапии варфарином составляют 2,5—3,5. В 2013 г. для лечения больных этой категории рекомендована терапия антикоагулянтом прямого действия — прямым ингибитором фактора Ха ривароксабаном в дозе 15 или 20 мг. Проводить мониторинг параметров свертывания крови не требуется.
В качестве альтернативы варфарину у ряда пациентов с ЛГ с повышенным риском кровотечений или не переносящих этот препарат рекомендовано использовать низкомолекулярные гепарины. Наиболее доступными низкомолекулярными гепаринами являются над Опарин и энок- сапарин. В течение 1-го месяца терапии применяются дозы надопарина 15 000 UAXa IC 2 раза в день или энокса- парина 1 мг на 1 кг массы тела 2 раза в день, в последующем — меньшие профилактические дозы: надопарин 7500 UAXa IC 1—2 раза в день и эноксапарин 20—40 мг 1—2 раза в день [1,14].
Назначение дезагрегантов возможно у больных ЛАГ с положительной пробой на реактивность сосудов, при непереносимости — ПОАК [1]. Применение ацетилсалициловой кислоты (АСК) в дозе 75—150 мг не сопряжено с необходимостью лабораторного контроля. Предпочтительно использование специальных форм АСК, что сводит к минимуму риск ульцерогенного эффекта.
Диуретики. Мочегонные препараты позволяют улучшить клиническое состояние больных ЛАГ и рекомендуются во всех случаях развития декомпенсации ПЖ [1,14]. Отсутствие рандомизированных исследований оставляет за клиницистами право выбора конкретного препарата и дозы. Дозы диуретиков должны аккуратно подбираться во избежание резкого снижения ОЦК и АД. Применяются петлевые диуретики: фуросемид 20—120 мг/сут, этакри- новая кислота 50—100 мг/сут, торасемид 5—20 мг/сут. Целесообразно присоединение антагонистов алвдостерона: верошпирон 25—150 мг, эплеренон 20мг. Во всех случаях назначения диуретиков необходимо тщательно контролировать уровни электролитов крови, а также состояние функции почек.
Оксигенотерапия. Низкое насыщение венозной крови кислородом у больных ЛАГ связано с низким СВ при незначительном нарушением вентиляционно-перфузионного соотношения. У большинства пациентов с ЛАГ имеется незначительная артериальная гипоксия в покое [36]. Исключение составляют пациенты с ЛАГ на фоне ВПС, у которых вследствие шунтирования крови справа налево развивается рефрактерная к кислородотерапии гипоксемия. Дополнительная оксигенотерапия в ночные часы не влияет на течение синдрома Эйзенменгера.
Оксигенотерапия рекомендуется больным ЛГ на фоне ХОБЛ, у которых необходимо достижение парциального давления кислорода в артериальной крови более 8 кПА на протяжении не менее 15 ч в сутки. Важно постоянно поддерживать насыщение крови кислородом на уровне 90% и выше. В амбулаторных условиях оксигенотерапия необходима для улучшения клинической симптоматики, коррекции десатурации при физической нагрузке.
Сердечные гликозиды и инотропные препараты. Снижение сократительной способности ПЖ — один из важнейших механизмов прогрессирования СН у больных ЛГ, что определяет показания к назначению сердечных гликозидов [1, 37]. Кратковременное внутривенное назначение дигоксина у больных ИЛГ вызывает некоторое повышение СВ, а также сопровождается существенным уменьшением уровня норадреналина в крови. Данные о результатах длительного лечения больных ЛГ сердечными гликозидами пока отсутствуют. Дигоксин в дозе 0,25 мг/сут может быть рекомендован для урежения желудочкового ритма при наджелудочковых тахиаритмиях.
Добутамин у больных ЛГ используется лишь в терминальной стадии заболевания и в ряде случаев позволяет достичь стабилизации состояния
Специфическая терапия
АК. Вазоконстриктивная теория патогенеза ЛГ базируется на присутствии гипертрофии медли в ЛА и артериолах, а также снижении ЛСС при применении вазодилататоров [38, 39]. Очевидно только у малого числа больных Л Г при применении вазодилататоров, в частности АК, можно достичь клинически значимого снижения ДЛА [14,40].
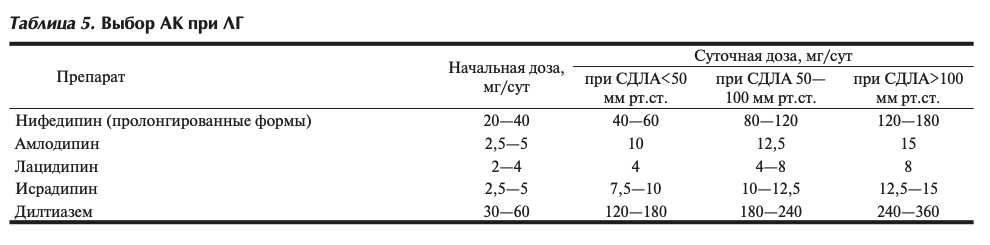
Благоприятные клинические и прогностические эффекты АК, применяемых в высоких дозах у больных ЛГ с положительной острой пробой, показаны в одноцентровых неконтролируемых исследованиях. К числу рекомендованных в настоящее время АК относятся нифедипин и дилтиазем [1,9].
Выбор в пользу одного из них определяется исходной частотой сердечных сокращений (ЧСС). Пациентам с ЧСС в покое менее 80 уд/мин следует рекомендовать нифедипин в пролонгированных формах, а также АК дигидропиридинового ряда третьего поколения. Амлодипин служит препаратом выбора для пациентов ЛГ с явлениями правожелудочковой СН. Суточные дозы препаратов, доказавшие эффективность, достаточно высокие: для нифедипина — 120—240 мг, для амлодипина — до 10—15 мг. При относительной тахикардии (ЧСС в покое более 80 уд/мин) следует отдать предпочтение дилтиазему в дозе 240-720 мг (табл. 5).
Дозы препарата необходимо подбирать постепенно в течение нескольких недель до максимально переносимых.
Иногда системная гипотония, отеки голеней и стоп препятствуют увеличению дозы.
Важно подчеркнуть, что терапия АК должна начинаться под строгим гемодинамическим контролем только больным ЛАГ, отвечающим на применение вазодилататоров в острой пробе. Терапия АК показана пациентам с СИ более 2,1 л/мин/м2 и/или насыщением венозной крови кислородом более 63%, и/или ДПП менее 10 мм рт.ст. и с положительным ответом на острое применение вазодилататора [1, 14]. Пациенты, наилучшим образом реагирующие на назначение АК, как правило, демонстрируют снижение ДЛА и ЛСС до 50% от исходного, часто до нормы.
У пациентов с СИ более 2,1 л/мин/м2 и/или насыщением венозной крови кислородом более 63%, и/или ДПП менее 10 мм рт.ст. и с отрицательной острой пробой успех назначения вазодилататора маловероятен и может вызвать побочные эффекты.
При СИ менее 2,1 л/мин/м2 и/или насыщением венозной крови кислородом менее 63%, и/или ДПП более 10 мм рт.ст. АК абсолютно противопоказаны.
Только 10—20% больных ЛАГ имеют положительную пробу с вазодилататором, из них лишь у 50% удается поддержатъ клинико-гемодинамический эффект при длительном применении АК. Особое внимание следует уделять контролю за стабильностью достигаемого эффекта. У больных с ИЛГ при положительной острой пробе спустя 3—4 мес постоянной терапии АК рекомендуется обязательное проведение контрольной катетеризации правых отделов сердца для оценки эффективности и безопасности терапии. При неадекватном ответе — отсутствие достижения I или II ФК (ВОЗ), существенного улучшения гемодинамических показателей — должна обсуждаться коррекция терапии. Назначение АК без проведения ОФП или отрицательной ОФП чревато развитием тяжелых побочных эффектов — гипотонии, синкопе, правожелудочковой СП.
У больных ЛАГ на фоне ДЗСТ тесты на реактивность сосудов часто не позволяют установить возможную эффективность длительной терапии АК, а высокие дозы последних плохо переносятся. Благоприятные эффекты длительной терапии АК в высоких дозах показаны детям с ИЛГ [9].
Простагландины (ПГ). Препараты этой перспективной группы, помимо вазодилатирующего, оказывают антиагрегационное и антипролиферативное действие. ПГ — группа липидных соединений уникальной структуры, образуемых из единого субстрата арахидоновой кислоты. В физиологических условиях ПГ являются медиаторами многих биологических функций, в том числе участвуют в регуляции сосудистого тонуса [41].
ПГЕ1 — сосудорасширяющий ПГ, обладающий антиагрегационным и анти пролиферативным свойствами. Это первый ПГ, который оказался эффективным при лечении больных ЛГ [1, 14]. Благодаря очень короткому периоду полувыведения (3—5 мин) возможен быстрый подбор дозы до максимальной, и при необходимости — почти моментальная остановка действия препарата. Почти 90% препарата инактивируется в легких, поэтому при внутривенном введении его поступление в большой круг кровообращения крайне незначительно, вследствие чего не отмечается выраженной системной гипотонии.
Антиагрегационный эффект делает ПГЕ, привлекательным с учетом выраженных нарушений в системе гемостаза у больных ЛГ. Наиболее приемлема схема терапии с помощью небольшой дозы 5—10 нг/кг/мин. Препарат водится внутривенно капельно со скоростью 5—30 нг/кг/мин. Курсовое лечение препаратом в суточной дозе 60—80 мкг в течение 2—3 нед следует проводить на фоне длительной терапии АК. Возможные побочные эффекты — гипотония, гиперемия лица, головные боли, боли в области сердца неопределенного характера, боли в животе, тошнота, диарея.
Простациклин (простагландин І2) — мощный эндогенный вазодилататор с целым спектром дополнительных эффектов — антиагрегационным, антипролифера- тивным и цитопротективным, которые направлены на предотвращение ремоделирования легочных сосудов: уменьшение повреждения эндотелиальных клеток и гиперкоагуляции [42,43]. У больных ЛГ различной этиологии доказано нарушение продукции простациклина, о чем свидетельствует снижение экспрессии простаци- клинсинтазы в ЛА, уменьшение экскреции метаболитов простациклина с мочой. Это служит обоснованием для использования простациклина и его аналогов для лечения пациентов с ЛГ, хотя до сих пор не установлено, является ли нарушение продукции простациклина причиной или следствием ЛГ.
В последние годы применение простациклина в клинической практике расширилось за счет создания его стабильных аналогов с различными фармакокинетическими особенностями, но качественно сходными фармакодинамическими свойствами [1, 9,44].
Илопрост — химически стабильный аналог простациклина для внутривенного применения, назначения внутрь в аэрозольной форме для ингаляций. Последняя форма обеспечивает большую селективность препарата в отношении легочной циркуляции. В нашей стране ингаляционный илопрост — единственный аналог простациклина, рекомендованный для лечения среднетяжелой и тяжелой форм ЛГ: ИЛГ, наследуемой ЛАГ, ЛАГ вследствие ДЗСТ, ЛАГ на фоне приема лекарственных препаратов, неоперабельных форм ХТЭЛГ [9, 45].
Эффективность илопроста оценивалась в рандомизированном плацебо-контролируемом исследовании AIR-1 у больных ЛАГ и ХТЭЛГ. Повторные ингаляции в течение дня проводились 6—9 раз по 2,5—5 мкг на ингаляцию (в среднем до 30 мкг/сут). При использовании обычных небулайзеров длительность ингаляции составляет 15 мин, применение ультразвуковых небулайзеров позволяет уменьшить время ингаляции до 5 мин. Илопрост улучшал клиническую симптоматику, толерантность к физическим нагрузкам, влиял на ЛСС, частоту клинических исходов. В исследовании STEP у 60 больных, принимавших бозентан, по сравнению с плацебо добавление илопроста приводило к значимому увеличению расстояния в ТШХ (р<0,051). Илопрост отличается хорошей переносимостью. Наиболее частыми побочными эффектами были приливы и боли в челюсти.
В длительном неконтролируемом исследовании 25 больных ИЛГ лечились ингаляционным илопростом 100—150 мкг/сут на протяжении 1 года. В результате лечения расстояния в ТШХ увеличилось на 85 м, ДЛАср снизилось в среднем на 7 мм рт.ст., СВ увеличился на 0,6 л/мин/м2.
Внутривенная инфузия илопроста считается сопоставимой по эффективности с эпопростенолом, что показано в серии небольших исследований при ЛАГ, ХТЭЛГ. Очевидными преимуществами внутривенного илопроста являются стабильность при комнатной температуре и отсутствие потребности в охлаждении. Однако в нашей стране эта форма препарата для лечения ЛГ не зарегистрирована [1].
АРЭ. ЭТ-1 — пептид эндотелиального происхождения, характеризующийся мощным вазоконстрикторным и митогенным свойствами в отношении ГМК. ЭТ-1 связывается с рецепторами 2 типов — типа А (ЭТА), локализующимися на ГМК, и типа В (ЭТВ), локализующимися на эндотелиоцитах и ГМК [1, 17]. Активация рецепторов ЭТА и ЭТВ на ГМК вызывает вазоконстрикторный и митогенный эффекты. Стимуляция рецепторов ЭТВ способствует выведению ЭТ-1 из легких, увеличению продукции оксида азота и высвобождению простациклина. Исследования экспрессии ЭТ-1 в легочной ткани подтверждают его роль в патогенезе ЛГ, однако не установлено, является ли повышенная продукция ЭТ-1 причиной или следствием ЛГ. Активация системы эндотелина у больных ЛГ служит обоснованием для использования антагонистов рецепторов к эндотелину, блокирующих рецепторы ЭТА или одновременно оба типа рецепторов — ЭТА и ЭТВ.
Бозентан — первый препарат из класса АРЭ неселективного действия, блокирующий рецепторы обоих типов. В рандомизированных исследованиях у больных ЛГ препарат продемонстрировал способность улучшать толерантность к физическим нагрузкам, ФК, гемодинамические и эхокардиографические параметры, увеличивать период до развития клинического ухудшения. В настоящее время эффективность бозентана показана у больных ИЛГ, ЛАГ на фоне ДЗСТ, синдроме Эйзенменгера в 5 рандомизированных исследованиях (пилотное исследование 351, BREATHE-1, BREATHE-2, BREATHE-5, EARLY) [9, 46, 47].
В исследовании BREATHE-1 пациенты с ИЛГ и ЛГ на фоне ДЗСТ рандомизированы в соотношении 1:1:1 для получения 62,5 мг бозентана или плацебо 2 раза в день в течение 4 нед, затем соответственно 125 или 250 мг 2 раза в день в течение 12 нед. При применении бозентана в обеих группах отмечалось существенное улучшение гемодинамических параметров, расстояния в ТШХ, клинических исходов, которое оказалось более выраженным при дозе 250 мг 2 раза в день у больных с ИЛГ (+54 и +35 м соответственно в группах больным, принимавших 250 мг 2 раза и 125 мг 2 раза). Более выраженный эффект наблюдался у больных ИЛГ по сравнению с группой ДЗСТ (+46 и +3 м соответственно). Повышение толерантности к нагрузкам сохранялось у больных при лечении на протяжении более 1 года и ассоциировалось с улучшением гемодинамических параметров и ФК.
На основании результатов 2 завершившихся рандомизированных исследований, в которые включались только больные с II ФК или синдромом Эйзенменгера, препарат в настоящее время рекомендован для больных с ПФК и при ЛАГ на фоне врожденных СЛШ и синдроме Эйзенменгера. Начальная доза бозентана составляет 62,5 мг 2 раза в сутки. Спустя 4 нед доза необходимо увеличить до 125 мг 2 раза в сутки [9].
У детей доза бозентана подбирается в зависимости от массы тела. В открытом неконтролируемом исследовании у детей с ЛАГ в возрасте 4—17 лет (BREATHE-3) улучшение гемодинамических параметров наблюдалось к 12-й неделе лечения бозентаном в виде монотерапии или в комбинации с эпопростенолом.
Повышение уровня трансаминаз отмечается примерно у 10% больных в зависимости от дозы и обратимо после ее уменьшения или отмены препарата. Наиболее вероятным механизмом действия бозентана на уровень печеночных ферментов является зависимая от дозы конкуренция с желчными солями, что приводит к их задержке, оказывая на гепатоциты цитотоксичное действие. Рекомендуется ежемесячный контроль за уровнем трансаминаз в крови на фоне терапии бозентаном.
Рекомендуется назначение препарата в начальной дозе 62,5 мг 2 раза в сутки с последующим увеличением дозы до 125 мг 2 раза в день под тщательным ежемесячным контролем ферментов печени. У больных ЛГ бозентан может вызывать анемию, что требует контроля уровней гемоглобина и гематокрита крови, а также задержку жидкости с появлением периферических отеков. У женщин, принимающих бозентан, необходима адекватная контрацепция с учетом возможного тератогенного эффекта. В нашей стране бозентан рекомендован для лечения больных ИЛГ, ЛАГ вследствие системной склеродермии без существенного легочного фиброза, при синдроме Эйзенменгера.
Амбризентан — несульфонамидный АРЭ, производное пропаноевой кислоты, селективный антагонист рецепторов ЭТА. Препарат исследовали в пилотном и 2 рандомизированных исследованиях ARIES-1 и ARIES-2 [1,9, 48]. У больных с ИЛГ, ЛГ на фоне ДЗСТ и ВИЧ-инфекции показана эффективность в виде улучшения клинической симптоматики, гемодинамических параметров, повышения толерантности к нагрузкам, удлинении времени до развития клинического ухудшения. По меньшей мере, в течение 1 года постоянной терапии эти эффекты сохранялись.
Амбризентан рекомендован для лечения больных ЛАГ для улучшения переносимости физической нагрузки, замедления прогрессирования клинических симптомов. В клинических исследованиях установлена эффективность препарата преимущественно у пациентов ИЛГ, наследуемой ЛАГ, ЛАГ вследствие ДЗСТ с II—III ФК. Рекомендованная доза составляет 5 мг 1 раз в сутки с возможным увеличением до 10 мг. Частота нарушений функции печени составляет от 0,8 до 3%, что обусловливает необходимость ежемесячного контроля. На фоне терапии амбризентаном чаще, чем при использовании других АРЭ возникают периферические отеки.
Оксид азота (II) и ИФДЭ-5
Оксид азота (II) — мощный эндогенный вазодилататор, селективно действующий на сосуды малого круга кровообращения. NO образуется из L-аргинина при помощи зависимой от кальция NO-синтазы. Диффундируя через альвеолярную мембрану, NO попадает в ГМК артерий и артериол, повышая уровень циклического гуанозинмонофосфата (цГМФ). Последний запускает каскад реакций, приводящих к снижению тонуса ГМК сосудов. Затем NO поступает в системный кровоток, где инактивируется путем связывания с оксигемоглобином с образованием метгемоглобина и нитратов [1,9].
При Л Г нарушается синтез NO. В клетках эндотелия больных ИЛГ при иммуногистохимических исследованиях выявлено снижение экспрессии эндотелиальной NO- синтазы. На образование NO влияют многочисленные факторы. Это экспрессия гена NO-синтазы, активность NO-синтазы и фосфодиэстеразы, обеспечивающих регуляцию продукции цГМФ, постсинтетическое окисление NO. Таким образом, для лечения ЛГ возможно использование ингаляционного NO, субстрата для его синтеза — L-аргинина, а также ИФДЭ-5.
В 80-е годы XX века ингаляционный NO использовался с целью проведения ОФП для оценки реактивности легочных сосудов и выявления больных с потенциально позитивным эффектом вазодилататоров. Описаны случаи длительного эффективного и безопасного применения ингаляций NO максимально до 1,5 года у больных ИЛГ. В стационарных условиях больным ЛГ рекомендуются 2—3-недельные курсы ингаляционного NO 20—40 ppm в течение 5—6 ч в сутки [1].
Силденафил — мощный селективный ингибитор зависимой от цГМФ фосфодиэстеразы (5-й тип), предотвращая деградацию цГМФ, вызывает снижение ЛСС и перегрузки ПЖ. ИФДЭ-5 дают антипролиферативный эффект [49]. Три одобренных для лечения эректильной дисфункции препарата — силденафил, тадалафил, варденафил вызывают выраженную дилатацию легочных сосудов [50]. Максимум действия достигается через 60, 75—90 и 40—45 мин соответственно. В нашей стране для лечения больных ЛГ одобрен препарат силденафил [1]. К настоящему времени уже накоплены данные, демонстрирующие хорошую переносимость и высокую эффективность силденафила у больных ЛГ различной этиологии. В неконтролируемых клинических исследованиях силденафил применялся при ИЛГ, ЛГ, ассоциированной с ДЗСТ, ВПС, при ХТЭЛГ в разовых дозах 25—75 мг 2—3 раза в сутки и вызывал улучшение гемодинамики, толерантности к физическим нагрузкам. Описаны редкие побочные эффекты препарата — головная боль, заложенность носа, приливы, нарушения зрения, диспепсия.
В рандомизированном исследовании SUPER-1 у 278 больных ЛАГ, получавших силденафила цитрат в дозах 20, 40 и 80 мг 3 раза в сутки, отмечалось улучшение клинической симптоматики, гемодинамики, толерантности к физическим нагрузкам [51]. Одобренная доза составляет 20 мг 3 раза в сутки. Однако стабильный эффект лечения отмечался только при применении дозы 80 мг 3 раза в сутки. В клинической практике часто требуется повышение дозы до 40—80 мг 3 раза в сутки. В исследовании PACES показана эффективность силденафила в сочетании с внутривенным эпопростенолом [9,46].
Комбинированная терапия
Комбинированная терапия при ЛАГ — одновременное использование более одного класса специфических лекарственных средств для лечения больных, например АРЭ в сочетании с простаноидами или ИФДЭ-5 [1, 9, 46, 52]. Во многих специализированных центрах по лечению ЛГ комбинированная терапия является стандартом лечения, хотя ее долгосрочные эффективность и безопасность до конца не изучены.
В серии клинических исследований показаны эффективность и безопасность различных комбинаций. В исследовании STEP-1 12-недельная терапия ингаляционным илопростом в сочетании с бозентаном приводила к выраженному увеличению расстояния в ТПГХ. После ингаляции илопроста ее прирост составлял +26 м (р—0,051) [52]. При проведении ТШХ до ингаляции по сравнению с плацебо увеличение расстояния составляло +19 м, но было недостоверным. Через 12 нед терапии илопростом не отмечалось клинически значимых изменений гемодинамических параметров, однако время до развития клинического ухудшения улучшалось по сравнению с таковым в группе плацебо (0 исходов против 5 исходов в группе плацебо). Напротив, исследование COMBI, в котором оценивались возможности комбинированной терапии илопростом и бозентаном, досрочно прекращено из-за отсутствия влияния на толерантность к нагрузкам и времени до развития клинического ухудшения.
Важно отметить особенности при совместном применении специфической для ЛАГ терапии. Так, в рамках исследования EARLY изучались фармакокинетические взаимодействия бозентана и силденафила, которые являются соответственно ингибитором и индуктором изоферментов цитохрома Р-450. При сочетанном применении концентрация силденафила снижается, а бозентана — повышается. Но это не сказывается на эффективности терапии. Не описано подобных взаимодействий между силденафилом и двумя другими АРЭ (табл. 6) [9].
Показанием к назначению комбинированной терапии у больных ЛАГ является отсутствие стабильного клинического эффекта.
Бозентан является индуктором изоферментов CYP3A4, CYP2C9 цитохрома Р-450. Концентрации в плазме крови лекарственных препаратов, метаболизируемых указанными изоферментами, уменьшаются при сочетанном применении с бозентаном. Концентрация бозентана при этом возрастает (см. табл. 6).
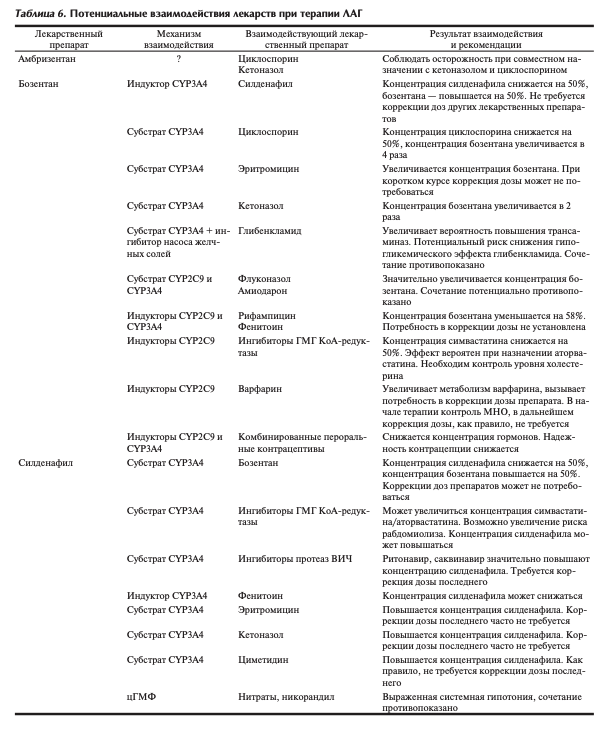
Концентрация бозентана возрастает при сочетанном применении с ингибиторами CYP3A4 (кетоназол, ритонавир) и/или ингибиторами CYP2C9 (амиодарон, флуконазол). Поэтому бозентан потенциально противопоказан при приеме этих препаратов.
Считается противопоказанным назначение бозентана при приеме итраконазола, такролимуса, сиролимуса, карбамазепина, фенобарбитала, дапсона.
Основной путь метаболизма силденафила — CYP3A4 и в меньшей степени CYP2C9. Индукторы CYP3A4 (кар
бамазепины, фенитоин, фенобарбитал, рифампицин) уменьшают концентрацию силденафила. Несколько повышается концентрация препарата при употреблении грейпфрутового сока — слабого ингибитора CYP3A4/5.
Из-за риска развития системной гипотонии требуется особая предосторожность при сочетанном применении специфической терапии ЛАГ с антигипертензивными препаратами, такими как ß-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента и др.
Лечение аритмий
У больных ЛГ злокачественные нарушения ритма, такие как желудочковая тахикардия, фибрилляция желудочков, отмечаются реже, чем у пациентов, страдающих левожелудочковой СН. Среди 132 больных ЛАГ только у 8% остановка сердца вызвана фибрилляцией желудочков [9, 20]. В 6-летнем наблюдении у 231 больного ЛАГ или ХТЭЛГ наблюдался только 1 случай злокачественной желудочковой аритмии. Наджелудочковые аритмии возникают при ЛГ с частотой 2,8% в год. Трепетание или мерцание предсердий встречаются одинаково часто и приводят к клиническому ухудшению и развитию правожелудочковой СН. Лечение трепетания предсердий более эффективно, чем мерцательной аритмии. Восстановление синусового ритма у больных Л Г приводило к повышению выживаемости по сравнению с таковой у больных с постоянной формой мерцательной аритмии, из которых 80% умирали в течение 2 лет. Хотя отсутствуют данные контролируемых исследований или проспективных набл юдений целью терапии должно быть удержание стабильного синусового ритма. При выборе антиаритми- ческих препаратов предпочтение отдается тем, которые не оказывают отрицательное инотропное действие, в частности амиодарону [9].
Хирургическое лечение
Предсердная септостомия (ПСС). Обоснованием для проведения ПСС явились наблюдения, показавшие, что выживаемость больных с синдромом Эйзенменгера и ИЛГ с открытым овальным окном выше, чем в случае неизмененной межпредсердной перегородки [1, 53]. Создание шунта справа налево позволяет снизить среднее ДПП и перегрузку ПЖ, а также увеличить преднагрузку ЛЖ и, таким образом, СВ. В этих условиях улучшается транспорт кислорода, несмотря на десатурацию артериальной крови, уменьшается симпатическая гиперактивация. Процедура противопоказана при среднем ДПП выше 20 мм рт.ст., насыщении крови кислородом менее 80% в покое. В результате вмешательства наблюдается уменьшение синкопе, повышение толерантности к нагрузке [54]. ПСС рекомендована только больным с IV ФК (ранее также III ФК) с частыми синкопе и/или рефрактерной правожелудочковой СН, несмотря на медикаментозную терапию, в том числе перед трансплантацией, не только при ИЛГ, но и ассоциированной ЛГ при ДЗСТ, оперированных ВПС, дистальных тромбозов в ЛА, ЛВОБ, легочном капиллярном гемангиоматозе [1]. Рандомизированные исследования доказали эффективность процедуры в отношении улучшения гемодинамического и функционального статуса больных, а также их прогноза.
ПСС рекомендована больным ЛГ с III и TV ФК (ВОЗ) с частыми синкопе или рефрактерной к терапии правожелудочковой СН. Смертность больных при проведении ПСС составляет 5—15%.
Тромбэндартерэктомия. Этот вид хирургического лечения больных ЛГ с тромботической обтурацией проксимальных отделов ЛА позволяет уменьшить общее ЛСС, улучшить систолическую функцию ПЖ, толерантность к физическим нагрузкам, увеличить продолжительность жизни больных [9, 55].
Показаниями к тромбэндартерэктомии являются III—TV ФК, ЛСС >300 дин/с/см5, наличие центральных тромбов (до сегментарного уровня) (>50% обструкция в проксимальных артериях по данным АПГ), сохранение тромбозов на фоне адекватной антикоагулянтной терапии в течение 3 мес. Противопоказания: тяжелые хронические заболевания легких (обструктивные, рестриктивные), тяжелая сопутствующая патология, дистальные поражения легочных сосудов, тяжелая левожелудочковая недостаточность.
Тромбэндартерэктомия показана пациентам с ХТЭЛГ, ИБС, клапанными пороками.
Трансплантация легких или комплекса сердце—легкие. Совершенствование лекарственной терапии ЛАГ существенно уменьшило потребность в трансплантации [1, 9, 56, 57]. Примерно у 25% больных ИЛГ не отмечено существенного улучшения при назначении специфической терапии. Прогноз у больных с ФК III—TV остается крайне неблагоприятным и зависит от этиологии. Так, у больных ЛАГ на фоне ДЗСТ он значительно хуже, чем при ИЛГ. Наибольшая выживаемость отмечается у больных ЛАГ на фоне ВПС, наихудший прогноз — при ЛВОБ, легочном капиллярном гемангиоматозе, когда медикаментозная терапия малоэффективна.
Больные с худшим прогнозом должны включаться в лист ожидания трансплантации комплекса сердце—легкие или билатеральной трансплантации легких. Точная статистика осложнений в виде развития систолической дисфункции ПЖ и/или диастолической дисфункции ЛЖ неизвестна. Из-за дефицита донорских органов чаще выполняется билатеральная трансплантация легких. При резком снижении посленагрузки ПЖ в результате проведения билатеральной трансплантации легких часто в раннем послеоперационном периоде отмечается нестабильность гемодинамики. Выживаемость после трансплантации одного или двух легких примерно одинаковая. После трансплантации одного легкого отмечается более тяжелая гипоксемия. В настоящее время в большинстве центров операцией выбора является билатеральная трансплантация легких. Согласно данным регистра Международного общества трансплантации сердца и легких при синдроме Эйзенменгера вследствие простых пороков выбором может быть изолированная трансплантация легкого с одновременной коррекцией порока. При желудочковых дефектах лучшие исходы наблюдаются при трансплантации комплекса сердце—легкие; 5-летняя выживаемость у больных ЛАГ составляет примерно 45—50%.
Алгоритм лечения больных ЛАГ
Различные виды специфической лекарственной терапии оценивались у больных ИЛГ, наследуемой ЛАГ, ЛАГ на фоне приема анорексиков, ДЗСТ, ВПС (в том числе после коррекции), поэтому алгоритм лечения относится исключительно к больным ЛАГ [9, 58].
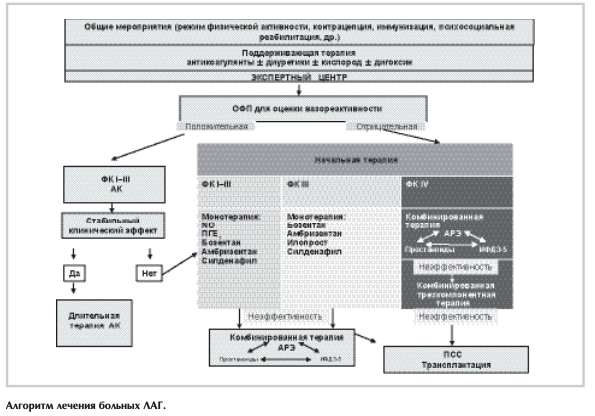
После установления диагноза начальные мероприятия связаны с соблюдением общих рекомендаций и назначением поддерживающей терапии. Больных ЛАГ необходимо направлять в экспертный центр.
Всем больным ЛАГ (группа 1) показано проведение ОФП для оценки вазореактивности. Вероятность положительной ОФП особенно высока при ИЛГ, наследуемой ЛАГ, ЛАГ на фоне приема анорексиков. У больных этой категории наиболее вероятен успех при применении АК в высоких дозах. Обязательно подтверждение стабильности эффекта терапии через 3—4 мес.
При отрицательной ОФП у больных ЛАГ с ФК I—II необходимо назначение специфической терапии ингаляционным NO (курсовая терапия при стабильном течении заболевания), ПГГ, (курсовая терапия при стабильном течении заболевания), АРЭ (бозентан или амбризентан) или ИФДЭ-5 силденафилом.
При отрицательной ОФП у больных ЛАГ с ФК III показано лечение АРЭ или ИФДЭ-5 или простаноидами.
Отсутствуют прямые сравнительные исследования по оценке эффективности различных видов специфической терапии ЛАГ. Выбор препарата зависит от формы ЛАГ, ФК, наличия противопоказаний, доступности препарата, пути введения, побочных эффектов, опыта врача и предпочтений больного.
Больным с ФК IV показана начальная комбинированная специфическая терапия ЛАГ, включающая два лекарственных препарата: сочетание АРЭ (бозентан или амбризентан) и илопроста или силденафила. При неэффективности двухкомпонентной специфической терапии рекомендуется назначение 3 лекарственных препаратов — АРЭ + ило прост + силденафил.
ПСС (атриосептостомия) и/или трансплантация показана больным ЛАГ при неадекватном клиническом эффекте медикаментозной терапии и должна проводиться только в экспертных центрах.
Алгоритм лечебной тактики для селективного выбора терапии представлен на рисунке.
Требования к экспертному центру ЛГ. Для оптимизации медицинской помощи больным ЛГ в нашей стране целесообразно формирование структуры экспертных центров. В соответствии с международными рекомендациями экспертным может считаться центр, в котором осуществляется наблюдение не менее чем за 50 больными ЛАГ или ХТЭЛГ, ежемесячно появляется не менее 2 новых случаев ЛАГ или ХТЭЛГ, ежегодно проводится как минимум 20 тестов на вазореактивность во время катетеризации правых отделов сердца [9].
Экспертный центр должен:
- располагать высококвалифицированным персоналом: как минимум 2 консультанта (кардиологи и/или пульмонологи) (специализация в области ЛГ); радиолог (эксперт в области ЛГ); кардиолог со специализацией по ЭхоКГ; квалифицированная медицинская сестра; специалист по психологической помощи и социальной адаптации пациентов; обмен информацией (телефон, интернет);
- иметь палаты для больных ЛАГ, отделение интенсивной терапии, поликлиническое отделение, диагностическую службу (ЭхоКГ, КТ, радионуклидная лаборатория, МРТ, УЗИ, нагрузочные пробы, оценка легочной функции, оценка гемодинамики с ОФП);
- располагать установленными связями с другими диагностическими и лечебными службами: генетическая лаборатория; ревматологический центр; центр планирования семьи; хирургический стационар (тромбэндартерэктомия, трансплантация);
- осуществлять анализ клинических исходов (в том числе анализ выживаемости больных);
- участвовать в клинических исследованиях в области ЛАГ, включая фазы II и III;
- осуществлять образовательные программы;
- взаимодействовать с ассоциациями пациентов.
ЛИТЕРАТУРА
- Диагностика и лечение легочной гипертензии. Российские рекомендации. Кардиоваск тер и проф 2007; 6: Приложение 2.
- Simonneau G., Robbins I., Beghetti M. et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2009; 54: S43-S54.
- Hatano S., Strasser T. World Health Organization 1975. Primary pulmonary hypertension. Geneva: WHO 1975.
- Simonneau G., Galie'N., Rubin L.J. etal. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004;43:85-812.
- Peacock A.J., Murphy N.F., McMurray J.J. V. et al. An epidemiological study of pulmonary arterial hypertension. Eur Respir J 2007; 30:104-109.
- Oudiz R.J. Pulmonary hypertension associated with left-sided heart disease. Clin Chest Med 2007; 28: 233—241.
- Chaouat A., BugnetA.S., Kadaoui N. et al. Severe pulmonary hypertension and chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2005; 172:189-194.
- Hoeper M.M., Mayer E., Simonneau G., Rubin L.J. Chronic thromboembolic pulmonary hypertension. Circulation 2006; 113: 2011-2020.
- Guidelines for the diagnosis and treatment of pulmonary hypertension. Update 2009. European society of cardiology. Eur Heart J 2009; 30: 2493-2537.
- D’Alonzo G.E., Barst R.J., Ayres S.M. etal. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann Intern Med 1991; 115: 343—349.
- Мартынюк ТВ. Идиопатическая легочная гипертензия: клинико-патофизиологические особенности и возможности патогенетически обоснованной терапии: Автореф. дне.... д-ра мед. наук. М 2013.
- Machado R., Eickelberg О., Elliott C.G. etal. Genetics and genomics of pulmonary arterial hypertension. J Am Coll Cardiol 2009; 54: 832-842.
- Fedullo P.F., Auger W.R., Kerr K.M., Rubin L.J. Chronic thromboembolic pulmonary hypertension. N Engl J Med 2001; 345: 1465-1472.
- Беленков Ю.Н, Чазова И.Е. Первичная легочная гипертензия. М: Нолидж 1991.
- Morrell N, Adnot S., Archer S. et al. Cellular and molecular basis of pulmonary arterial hypertension. J Am Coll Cardiol 2009; 54: 820-831.
- Hassoun P.M., Mouthon L., Barbera J.A. et al. Inflammation, growth factors, and pulmonary vascular remodeling. J Am Coll Cardiol 2009; 54: 810-819.
- Stewart D.J., LevyRJ)., CemacekP, Langleben D. Increased plasma endothelin-1 in pulmonary hypertension: marker or mediator of disease? Ann Intern Med 1991; 114:464—469.
- Sztrymf B., Coulet E, Girerd B. et al. Clinical outcomes of pulmonary arterial hypertension in carriers of BMPR2 mutation. Am J Respir Crit Care Med 2008; 177:1377-1383.
- Trembath R.C., Thomson J.R., Machado R.D. et al. Clinical and molecular genetic features of pulmonary hypertension in patients with hereditary hemorrhagic telangiectasia. N Engl J Med 2001; 345: 325-334.
- Tbngers J, Schwerdtfeger B., Klein G. et al. Incidence and clinical relevance of supraventricular tachyarrhythmias in pulmonary hypertension. Am Heart J 2007; 153:127—132.
- Fisher M.R., Forfia P.R., Chamera E. et al. Accuracy of Doppler echocardiography in the hemodynamic assessment of pulmonary hypertension. Am J Resp Crit Care Med 2009; 179: 615—621.
- Mukerjee D., St George D., Knight C. et al. Echocardiography and pulmonary function as screening tests for pulmonary arterial hypertension in systemic sclerosis. Rheumatology 2004; 43: 461— 466.
- Hoeper M.M., Lee S.H., Voswinckel R. etal. Compheations of right heart catheterization procedures in patients with pulmonary hypertension in experienced centers. J Am Coh Cardiol 2006; 48: 2546-2552.
- Tunariu N, Gibbs S.R., Win Z. et al. Ventilation-perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension. J Nucl Med 2007; 48: 680—684.
- Resten A., Maitre S., Humbert M. et al. Pulmonary hypertension: CT of the chest in pulmonary venoocclusive disease. Am J Roentgenol 2004; 183:65-70.
- Tbrbicki A. Cardiac magnetic resonance in pulmonary arterial hypertension: a step in the right direction. Eur Heart J 2007; 28: 1187-1189.
- Rich S., Kieras K, Groves B., Stobo J.D., Brundage B. Antinuclear antibodies in primary pulmonary hypertension. J Am Coh Cardiol 1986; 8:1307-1311.
- Chu J. W, Kao P.N., FaulJ.L., Doyle R.L. High prevalence of autoimmune thyroid disease in pulmonary arterial hypertension. Chest 2002; 122:1668-1673.
- Albrecht T, Blomley M.J., Cosgrove D. O. et al. Non-invasive diagnosis of hepatic cirrhosis by transit-time analysis of an ultrasound contrast agent. Lancet 1999; 353:1579—1583.
- McLaughlin V.V., Presberg K.W., Doyle R.L. etal. Prognosis of pulmonary arterial hypertension ACCP evidence-based clinical practice guidelines. Chest 2004; 126: 788—928.
- Galie N, Manes A., Palazzini M. et al. Management of pulmonary arterial hypertension associated with congenital systemic-to-pul- monary shunts and Eisenmenger’s syndrome. Drugs 2008; 68: 1049-1066.
- Mereles D., Ehlken N, Kreuscher S. et al. Exercise and respiratory training improve exercise capacity and quality of life in patients with severe chronic pulmonary hypertension. Circulation 2006; 114:1482-1489.
- The Task Force on the Management of Cardiovascular Diseases During Pregnancy of the European Society of Cardiology. Expert consensus document on management of cardiovascular diseases during pregnancy. Eur Heart J 2003; 24: 761—781.
- Herve P., Humbert M., Sitbon O. et al. Pathobiology of pulmonary hypertension: the role of platelets and thrombosis. Clin Chest Med 2001; 22:451-458.
- Fuster V, Steele P.M., Edwards W.D. et al. Primary pulmonary hypertension: natural history and the importance of thrombosis. Circulation 1984; 70: 580-587.
- Weitzenblum E., Sautegeau A., Ehrhart M. et al. Long-term oxygen therapy can reverse the progression of pulmonary hypertension in patients with chronic obstructive pulmonary disease. Am Rev RespirDis 1985; 131:493-498.
- Rich S., Seidlitz M., Hodin L et al. The short-term effects of digoxin in patients with right ventricular dysfunction from pulmonary hypertension. Chest 1998; 114: 787—792.
- Rich S., Dantzker D.R., Ayres S.M. et al. Primary pulmonary hypertension. A national prospective study. Ann Intern Med 1987; 107: 216-223.
- Rich S., Kaufmann E., Levy P.S. The effect of high doses of calci- um-channel blockers on survival in primary pulmonary hypertension. N Engl J Med 1992; 327: 76-81.
- Sitbon O., Humbert M., Jais X. et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005; 111: 3105—3111.
- Gälte N., Manes A., Branzi A. Prostanoids for pulmonary arterial hypertension. Am J Respir Med 2003; 2:123—137.
- Rubin L.J., Mendoza J-, Hood M. et al. Treatment of primary pulmonary hypertension with continuous intravenous prostacyclin (epoprostenol). Results of a randomized trial. Ann Intern Med 1990; 112:485-491.
- Barst R.J., Rubin L.J., Long W.A. et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. The Primary Pulmonary Hypertension Study Group. N Engl J Med 1996; 334: 296-302.
- McLaughlin V.V., Shillington A., Rich S. Survival in primary pulmonary hypertension: the impact of epoprostenol therapy. Circulation 2002; 106:1477-1482.
- Olschewski H, Simonneau G., Gälte N. et al., for the AIR Study Group. Inhaled iloprost in severe pulmonary hypertension. N Engl J Med 2002; 347: 322-329.
- Gälte N, Manes A., Negro L. etal. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur Heart J 2009; 30: 394-403.
- McLaughlin V.V., Sitbon O., Badesch D.B. et al. Survival with first- line bosentan in patients with primary pulmonary hypertension. Eur Respir J 2005; 25: 244-249.
- Gälte N, Badesch B.D., Oudiz R. et al. Ambrisentan therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2005; 46: 529-535.
- Tantini B., Manes A., Fiumana E. et al. Antiproliferative effect of sildenafil on human pulmonary artery smooth muscle cells. Basic Res Cardiol 2005; 100:131-138.
- Ghofrani H.A., Voswinckel R., Reichenberger F. et al. Differences in hemodynamic and oxygenation responses to three different phosphodiesterase-5 inhibitors in patients with pulmonary arterial hypertension: a randomized prospective study. J Am Coll Cardiol 2004; 44:1488-1496.
- Michelakis E.D., Tymchak W, Noga M. etal. Long-term treatment with oral sildenafil is safe and improves functional capacity and hemodynamics in patients with pulmonary arterial hypertension. Circulation 2003; 108: 2066—2069.
- McLaughlin V.V., Oudiz R. J., Frost A. etal. Randomized study of adding inhaled iloprost to existing bosentan in pulmonary arterial hypertension. Am J Respir Crit Care Med 2006; 174:1257—1263.
- Sandoval J., Gaspar J., Pulido T. et al. Graded balloon dilation atrial septostomy in severe primary pulmonary hypertension. A therapeutic alternative for patients nonresponsive to vasodilator treatment. J Am Coll Cardiol 1998; 32: 297—304.
- Kurzyna M., Dabrowski M., Bielecki D. et al. Atrial septostomy in treatment of end-stage right heart failure in patients with pulmonary hypertension. Chest 2007; 131: 977—983.
- Rubin L.J., Hoeper M.M., Klepetko W. et al. Current and future management of chronic thromboembolic pulmonary hypertension: from diagnosis to treatment responses. Proc Am Thorac Soc 2006; 3: 601-607.
- Orens J.B., Estenne M., Arcasoy S. et al. International guidelines for the selection of lung transplant candidates: 2006 update — a consensus report from the Pulmonary Scientific Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2006; 25: 745—755.
- Trulock E.P., Edwards L.B., Taylor D. O. et al. International Society for Heart and Lung Transplantation. Registry of the International Society for Heart and Lung Transplantation: twenty third official adult lung and heart lung transplantation report — 2006. J Heart Lung Transplant 2006; 25: 880—892.
- Barst R.J., Gibbs J.S., Ghofrani HA. etal. Updated evidence-based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2009; 54: S78-S84.





