Особенности клинического течения болезни Паркинсона при отложении железа в базальных ганглиях


Published: April 1, 2022
Latest article update: Sept. 1, 2022
Abstract
Болезнь Паркинсона (БП) — хроническое прогрессирующее заболевание нервной системы, сопровождающееся развитием ряда двигательных нарушений, таких как гипокинезия, мышечная ригидность и тремор, а также группы немоторных симптомов. До сих пор как один из ведущих патофизиологических процессов при БП рассматривается патологическое накопление альфа-синуклеина и формирование телец Леви в черной субстанции (ЧС) и других отделах головного мозга (ГМ). Многообразие современных методов исследования позволяет изучить вклад в нейродегенеративный процесс других механизмов, таких как феномен эксайтотоксичности, избыточное отложение железа и окислительный стресс.
Keywords
Отложение железа, взвешенные по магнитной восприимчивости, изображения, базальные ганглии, болезнь Паркинсона, ферроптоз, магнитно-резонансная томография.
Введение
Болезнь Паркинсона (БП) — хроническое прогрессирующее заболевание нервной системы, сопровождающееся развитием ряда двигательных нарушений, таких как гипокинезия, мышечная ригидность и тремор, а также группы немоторных симптомов [1]. До сих пор как один из ведущих патофизиологических процессов при БП рассматривается патологическое накопление альфа-синуклеина и формирование телец Леви в черной субстанции (ЧС) и других отделах головного мозга (ГМ). Многообразие современных методов исследования позволяет изучить вклад в нейродегенеративный процесс других механизмов, таких как феномен эксайтотоксичности, избыточное отложение железа и окислительный стресс [2–4].
В 2012 г. группой американских ученых был описан новый тип регулируемой клеточной гибели с участием железа, который получил название ферроптоз [5]. Особенностями данного процесса являются истощение внутриклеточного глутатиона и уменьшение активности фермента глутатионпероксидазы-4, с последующим развитием перекисного окисления липидов, обусловленного снижением антиоксидантной защиты клеток и накоплением активных форм кислорода. В свою очередь источником свободных радикалов может быть избыточное отложение железа и окисление Fe2+ до Fe3+ в ходе реакции Фентона [4, 6].
Ряд современных исследований [4, 7, 8] рассматривают повышенное депонирование железа и ферроптоз как один из механизмов, приводящих к нейродегенерации при БП. В то же время важным вопросом остается выбор методики оценки распределения металла в ГМ, и в частности в структурах экстрапирамидной системы. Возм ожность неинвазивно in vivo изучать характер отложения железа предоставляет магнитно-резонансная томография (МРТ) в режиме изображений, взвешенных по магнитной восприимчивости (susceptibility weighted imaging — SWI), которая с каждым годом все активней применяется у пациентов с БП и другими заболеваниями нервной системы [9, 10]. В то же время для комплексной оценки клинических проявлений заболевания применяются специализированные шкалы, позволяющие с высокой точностью охарактер e8зовать разнообразные симптомы БП и степень их выраженности. При совместном применении данных методик с нейровизуализационным обследованием посредством МРТ в режиме SWI появилась возможность изучить взаимосвязь патологического отложения железа в базальных ганглиях и развития моторных и немоторных нарушений у пациентов с БП.
Цель исследования: оценить взаимосвязь отложения железа в структурах экстрапирамидной системы с особенностями клинической картины у пациентов с различными стадиями БП.
Материал и методы
В исследование было включено 92 пациента с диагнозом БП, установленным согласно критериям MDS (International Parkinson and Movement Disorder Society) [11]. В зависимости от стадии заболевания пациенты были разделены на 2 группы. В 1-ю вошли 42 пациента со II стадией по Хен — Яру, средний возраст которых составил 60,4±4,5 года, а продолжительность заболевания — 2,3±1,2 года. При этом у 24 (57,1%) больных данной группы на основании клинических данных была установлена смешанная форма заболевания, а у 18 (42,9%) пациентов — акинетико-ригидная. Во 2-ю группу вошли 50 пациентов с III стадией по Хен —Яру, средний возраст — 66,4±4,7 года, продолжительность заболевания — 7,8±5,2 года, из них 23 (46,0%) человека — со смешанной формой БП, а 27 (54,0%) больных — с акинетико-ригидной.
Всем пациентам выполнялось клиническое и нейропсихологическое обследование по специализированным шкалам, таким как унифицированная шкала оценки болезни Паркинсона (UPDRS), шкала ходьбы и равновесия (GABS), шкала застываний (FOGQ), краткая шкала оценки психического статуса (MMSE), тест «Батарея лобной дисфункции» (FAB), а также шкала депрессии Бека. Затем всем пациентам проводилась МРТ ГМ на МР-томографе Magnetom Trio A Tim 3,0 Тесла (SIEMENS, Германия) с применением импульсной последовательности SWI. На полученных аксиальных SWI-изображениях выделялись области интереса, такие как: ЧС, красное ядро (КЯ), бледный шар (БШ), головка хвостатого ядра (ХЯ), скорлупа и зубчатое ядро мозжечка. В проекции каждой изучаемой структуры экстрапирамидной системы при помощи программы SPIN (signal processing in NMR) Software (SpinTechMRI, США) вручную измерялся уровень интенсивности сигнала с получением числовых значений. С учетом особенностей формирования конечных изображений в режиме SWI более низкие показатели сигнала соответствовали более высокому содержанию железа.
Статистическая обработка данных проводилась с использованием программного обеспечения Statistica 12 (StatSoft, США). Количественные показатели представлены в виде медианы и нижнего и верхнего квартилей (Me [LQ; UQ]). Для выявления статистически значимых различий применялся непараметрический те ст Манна — Уитни, а для определения корреляционных связей — критерий Спирмена.
Результаты исследования
Сравнительный анализ групп пациентов с БП II и III стадий по Хен — Яру продемонстрировал статистически значимые различия по результатам обследования по шкале UPDRS, ее разделам UPDRS II, UPDRS III и UPDRS IV, шкалам нарушений ходьбы FOGQ, GABS, а также тестам для оценки когнитивных функций MMSE и FAB (табл. 1).
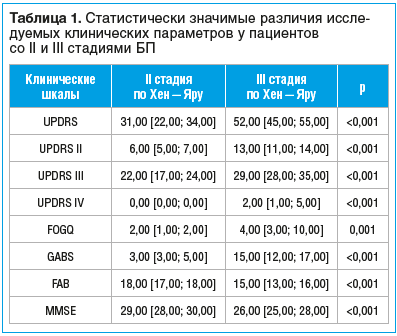
У пациентов c III стадией БП были выявлены более высокие баллы по шкале UPDRS и ее разделам, что свидетельствует о большей выраженности клинических симптомов заболевания, как моторных, так и немоторных.
Шкалы GABS и FOGQ позволяют оценить тяжесть нарушений ходьбы, равновесия, а также наличие и выраженность застываний у пациентов с БП. В нашем исследовании обнаружено, что в группе больных с III стадией БП данные расстройства имели заметно более выраженные проявления. Стоит отметить отсутствие застываний у пациентов со II стадией заболевания, что согласуется с общепринятыми представлениями о стадийном прогрессировании клинической симптоматики при БП.
При оценке когнитивных функций исследуемых групп также были выявлены статистически значимые различия. Пациенты с III стадией БП характеризовались более выраженными познавательными расстройствами, в структуру которых входили как нейродинамические, так и регуляторные нарушения. При этом у 13 человек с развернутой стадией заболевания диагностирована деменция, чего не наблюдалось ниодного обследуемого со II стадией по Хен — Яру.
Согласно результатам сравнительного анализа накопления железа в базальных ганглиях у больных исследуемых групп обнаружены статистически значимые различия показателей интенсивности сигнала от таких структур, как правая и левая ЧС, правая и левая скорлупа, левыЦ 9 БШ, а также правое и левое ХЯ (табл. 2).
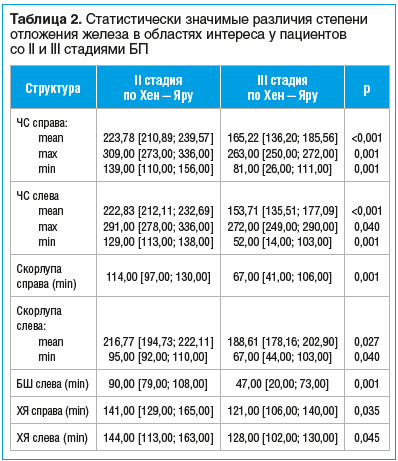
Более низкий сигнал на SWI-изображениях отражает более высокое содержание железа, что свидетельствует о преобладании его депонирования практически во всех структурах экстрапирамидной системы у больных с III стадией БП.
Согласно результатам корреляционного анализа у пациентов со II стадией по Хен — Яру были выявлены множественные взаимосвязи отложения железа в базальных ганглиях с данными обследования по шкале UPDRS и ее разделам (табл. 3).
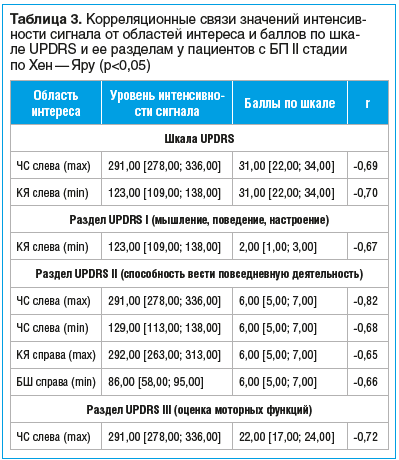
У пациентов с III стадией по Хен — Яру была обнаружена единственная статистически значимая корреляция (r=-0,57) накопления железа с результатами обследования по разделу UPDRS III (29,00 [28,00; 35,00]), которую продемонстрировал минимальный уровень сигнала от правого БШ (60,00 [26,00; 92,00]).
При анализе корреляционных связей между результатами клинической оценки расстройств ходьбы по шкалам GABS и FOGQ и накоплением железа в структурах экстрапирамидной системы была выявлена единственная связь (r=-0,86) уровня интенсивности сигнала от левого БШ min (90,00 [79,00; 108,00]) и баллов по шкале FOGQ (2,00 [1,00; 2,00]) у пациентов со II стадией по Хен — Яру. В то же время статистически значимых корреляций со шкалой нарушения ходьбы и равновесия у данной группы обследованных обнаружено не было.
У пациентов с III стадией БП единственной структурой, которая продемонстрировала значимую корреляцию с баллами по шкале FOGQ, оказалась левая скорлупа. В то же время оценка по шкале GABS имела множество статистически значимых связей с накоплением железа в базальных ганглиях (табл. 4).
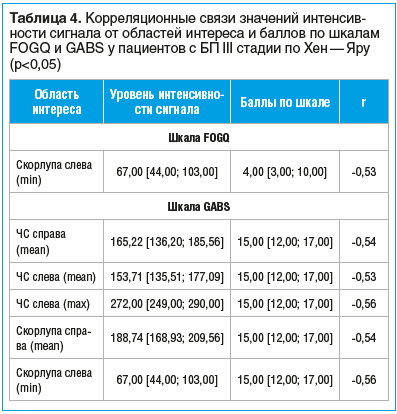
Корреляционный анализ уровня интенсивности сигнала от структур экстрапирамидной системы и результатов оценки когнитивных функций у пациентов со II стадией по Хен — Яру продемонстрировал влияние накопления железа в правом БШ на развитие познавательных расстройств (табл. 5).

У пациентов с III стадией БП нами было выявлено значительное большее влияние избыточного депонирования железа в структурах экстрапирамидной системы на развитие когнитивных нарушений (см. табл. 5).
В проведенном нами исследовании не было установлено статистически значимых корреляционных связей значений интенсивности сигнала от изучаемых областей и результатов обследования по шкале депрессии Бека у пациентов со II стадией БП. При этом у пациентов с III стадией БП была обнаружена взаимосвязь (r=-0,62) развития депрессии с накоплением железа (282,00 [268,00; 290,00]) в левом ХЯ max (11,00 [6,00; 19,00]).
Обсуждение
Согласно гипотезе H. Braak et al. [2] отложение альфа-синуклеина при БП носит стадийный характер, последовательно вовлекая в патологический процесс множество различных структур ГМ. В то же время клиническое течение заболевания также характеризуется последовательным прохожд ением через несколько стадий, каждая из которых имеет свои особенности. В нашем исследовании пациенты с III стадией БП характеризовались более тяжелыми моторными и немоторными нарушениями, что нашло отражение в результатах комплексного клинико-нейропсихологического обследования. Кроме того, у данной группы пациентов было обнаружено более высокое
'f1одержание железа в ЧС, скорлупе, БШ и ХЯ, чем у пациентов со II стадией по Хен — Яру. Исходя из этого, можно сделать предположение, что процесс развития заболевания и эволюция клинической картины сопровождаются накоплением металла в базальных ганглиях и, возможно, являются отчасти и его следствием. Для определения связи депонирования железа в конкретных структурах экстрапирамидной системы с отдельными симптомами и синдромами БП был проведен корреляционный анализ, который продемонстрировал множество статистически значимых связей.
Так как дегенерация нейронов компактной части ЧС, по современным представлениям, занимает центральное место в теории патогенеза БП, то взаимосвязь накопления железа в данной структуре среднего мозга с тяжестью моторных и некоторых немоторных проявлений заболевания весьма закономерна и может объясняться развитием ферроптоза и окислительного стресса в дофаминпродуцирующих клетках. Уровень интенсив ности сигнала от ЧС продемонстрировал статистически значимые корреляционные связи со шкалой UPDRS, разделами UPDRS II, UPDRS III у пациентов со II стадией БП и шкалами GABS и FAB у обследуемых с III стадией по Хен — Яру. Однако нами были обнаружены взаимосвязи, требующие углубленного анализа в силу своей неочевидности. Например, с накоплением железа в КЯ оказались взаимосвязаны не только клинические проявления БП, оцениваемые по шкале UPDRS и ее разделам у пациентов со II стадией по Хен — Яру, но и когнитивные нарушения у лиц с III стадией заболевания. Если представление об участии КЯ в формировании двигательных актов уже является общепринятым, то их возможный вклад в осуществление сенсорных, познавательных и психических функций за счет обширных связей с префронтальной, поясной и инсулярной корой изучается только сегодня [12, 13].
Помимо ЧС с выраженностью нарушений ходьбы и застываниями у пациентов с III стадией БП были связаны отложения железа в скорлупе. Данные структуры экстрапирамидной системы находятся в тесном физиологическом взаимодействии посредством нигростриарного дофаминергического пути, который обеспечивает достижение дофамином дофаминовых рецепторов, экспрессирующихся на поверхности нейронов стриатума [14]. Дегенерация нигростриарного тракта и снижение уровня нейромедиатора лежат в основе патогенеза БП и являются причиной развития двигательных проявлений заболевания. Возможно, именно прогрессирующее накопление железа в ЧС и скорлупе с последующим ферроптозом и гибелью во влеченных нейронов вносит существенный вклад в формирование нарушений ходьбы у пациентов с развернутой клинической картиной БП.
Депрессия является одним из аффективных расстройств, характерных для БП, причем ее развитие может происходить еще во время продромального периода и на много лет опережать дебют двигательных проявлений заболевания [15–17]. В нашем исследовании была обнаружена статистически значимая связь накопления железа в левом ХЯ с результатами обследования по шкале депрессии Бека у пациентов с III стадией по Хен — Яру, что можно объяснить тесными взаимосвязями стриатума с различными отделами ГМ, включая лимбическую систему [18].
Литература
1. Balestrino R., Schapira A.H.V. Parkinson disease. Eur J Neurol. 2020;27(1):27–42. DOI: 10.1111/ene.14108.
2. Braak H., Del Tredici K., Rüb U. et al. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging. 2003;24(2):197–211. DOI: 10.1016/s0197-4580(02)00065-9.
3. Fayyad M., Salim S., Majbour N. et al. Parkinson’s disease biomarkers based on α-synuclein. J Neurochem. 2019;150(5):626–636. DOI: 10.1111/jnc.14809.
4. Mahoney-Sánchez L., Bouchaoui H., Ayton S. et al. Ferroptosis and its potential role in the physiopathology of Parkinson’s Disease. Prog Neurobiol. 2021;196:101890. DOI: 10.1016/j.pneurobio.2020.101890.
5. Dixon S.J., Lemberg K.M., Lamprecht M.R. et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 2012;149(5):1060–1072. DOI: 10.1016/j.cell.2012.03.042.
6. Li J., Cao F., Yin H.L. et al. Ferroptosis: past, present and future. Cell Death Dis. 2020;11(2):88. DOI: 10.1038/s41419-020-2298-2.
7. Литвиненко И.В., Красаков И.В., Труфанов А.Г. Церебральные нарушения обмена железа как основа развития и прогрессирования нейродегенеративных заболеваний. Вестник Российской Военно-медицинской академии. 2018;3:68–78. [Litvinenko I.V., Krasakov I.V., Trufanov A.G. Cerebral disorders of iron metabolism as a basis for the development and progression of neurodegenerative diseases. Bulletin of the Russian Military medical academy. 2018;3:68–78 (in Russ.)]. DOI: 10.32863/1682-7392-2018-3-63-68-77.
8. Han C., Liu Y., Dai R. et al. Ferroptosis and Its Potential Role in Human Diseases. Front Pharmacol. 2020;11:239. DOI: 10.3389/fphar.2020.00239.
9. Pyatigorskaya N., Sanz-Morère C.B., Gaurav R. et al. Iron Imaging as a Diagnostic Tool for Parkinson’s Disease: A Systematic Review and Meta-Analysis. Front Neurol. 2020;11:366. DOI: 10.3389/fneur.2020.00366.
10. Aker L., Abandeh L., Abdelhady M. et al. Susceptibility-weighted Imaging in Neuroradiology: Practical Imaging Principles, Pearls and Pitfalls. Curr Probl Diagn Radiol. 2021;8:S0363–0188. DOI: 10.1067/j.cpradiol.2021.05.001.
11. Postuma R.B., Berg D., Stern M. et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord. 2015;30(12):1591–1601. DOI: 10.1002/mds.26424.
12. Cacciola A., Milardi D., Basile G.A. et al. The cortico-rubral and cerebello-rubral pathways are topographically organized within the human red nucleus. Sci Rep. 2019;9(1):12117. DOI: 10.1038/s41598-019-48164-7.
13. Basile G.A., Quartu M., Bertino S. et al. Red nucleus structure and function: from anatomy to clinical neurosciences. Brain Struct Funct. 2021;226(1):69–91. DOI: 10.1007/s00429-020-02171-x.
14. Mishra A., Singh S., Shukla S. Physiological and Functional Basis of Dopamine Receptors and Their Role in Neurogenesis: Possible Implication for Parkinson’s disease. J Exp Neurosci. 2018;12:1179069518779829. DOI: 10.1177/1179069518779829.
15. Милюхина И.В. Патогенез, клинические особенности и методы лечения депрессии при болезни Паркинсона. Неврология, нейропсихиатрия, психосоматика. 2019;11(2):93–99. [Milyukhina I.V. Pathogenesis, clinical features, and treatments of depression in Parkinson’s disease. Neurology, Neuropsychiatry, Psychosomatics. 2019;11(2):93–99 (in Russ.)]. DOI: 10.14412/2074-2711-2019-2-93-99.
16. Нодель М.Р., Яхно Н.Н. К вопросу о гетерогенности депрессии при болезни Паркинсона. Неврология, нейропсихиатрия, психосоматика. 2020;12(5):46–52. [Nodel M.R., Yakhno N.N. On the heterogeneity of depression in Parkinson’s disease. Neurology, Neuropsychiatry, Psychosomatics. 2020;12(5):46–52 (in Russ.)]. DOI: 10.14412/2074-2711-2020-5-46-52.
17. Коцоев Г.А., Федотова Е.Ю., Иллариошкин С.Н. Оценка критериев MDS, предложенных для установления продромальной стадии болезни Паркинсона, у пациентов с клинически диагностированным заболеванием. Нервные болезни. 2021;2:30–34. [Kotsoev G.A., Fedotova E.Yu., Illarioshkin S.N. Evaluation of the MDS criteria proposed for establishing prodromal stage of Parkinson’s disease in patients with clinically diagnosed disease. Nervous diseases. 2021;2:30–34 (in Russ.)]. DOI: 10.24412/2226-0757-2021-12323.
18. Floresco S.B. Dopaminergic regulation of limbic-striatal interplay. J Psychiatry Neurosci. 2007;32(6):400–411.





