Резорбция грыжи межпозвонкового диска. Феномен транзиторного увеличения размера


Published: April 1, 2022
Latest article update: Sept. 1, 2022
Abstract
Консервативное лечение грыж межпозвонковых дисков (ГМПД) часто сопровождается уменьшением их размера или резорбцией. В настоящее время выявлено, что процесс резорбции грыжи может сопровождаться транзиторным увеличением ее размера. Однако данные о частоте этого феномена и его роли в процессе резорбции отсутствуют.
Keywords
Резорбция, псевдопрогрессия, феномен транзиторного увеличения размера., грыжа межпозвонкового отдела позвоночника
Введение
На фоне общего старения населения растет число пациентов с жалобами на боль в спине [1], однако, несмотря на высокую распространенность такой боли, понимание патофизиологии дегенеративных изменений позвоночника до сих пор является недостаточным. При возникновении грыжи cежпозвонковых дисков (ГМПД) ткани диска выступают в спинномозговой канал и могут вызывать симптомы неспецифической боли в спине или симптомы радикулопатии за счет воспаления и компрессии нервных корешков. Дегенерацию межпозвонкового диска (МПД) рассматривают в качестве одного из возможных этиологических факторов боли в спине [2–8]. Локальное возникновение болевого синдрома может быть обусловлено воспалением, связанным с дегенерациеЦ 9 тканей МПД, и увеличением сенсорной иннервации диска (дискогенные боли). По этой причине ряд авторов рассматривает МПД в качестве основной терапевтической мишени лечения боли в спине [4, 5].
Благодаря повышению качества нейровизуализационных методов исследования, особенно МРТ, было продемонстрировано, что при консервативном лечении ГМПД по мере облегчения симптомов иногда отмечается уменьшение размеров грыжевого выпячивания. Этот феномен был назван «резорбцией грыжи межпозвонкового диска» [9]. По данным метаанализа, частота этого феномена составляет 62,5–82,9% [10]. Однако до сих пор не выявлены прогностические критерии резорбции, что важно для выбора тактики лечения пациентов с ГМПД. Кроме того, не совсем очевидны этапы резорбции. В ходе динамического МРТ-наблюдения за 135 пациентами с ГМПД, проведенного нами ранее, у 89 пациентов наблюдалось увеличение линейных размеров грыжи диска на 2–5 мм, которое предшествовало ее последующему уменьшению и было названо псевдопрогрессией ГМПД или транзиторным увеличением размера. Мы предположили, что данный феномен может рассматриваться как положительный прогностический признак последующего уменьшения размеров ГМПД [11]. Транзиторное увеличение может ошибочно трактоваться специалистами как отрицательная динамика и критически влиять на изменение стратегии лечения пациента.
Цель исследования: определить частоту псевдопрогрессии, или транзиторного увеличения размера, ГМПД и ее роль в процессе резорбции грыжи.
Материал и методы
Ретроспективное исследование включало 327 пациентов (178 (54,4%) женщин и 149 (45,6%) мужчин) в возрасте 43,2±9,4 года с грыжами шейного и поясничного отделов позвоночника, проходивших консервативное физиотерапевтическое лечение (ФТЛ) и иглорефлексотерапию (от 2 до 6 курсов по 12 процедур с перерывами в 2–3 мес. между курсами в период с 2014 по 2019 г.), у которых в течение проводимого курсового лечения отмечалось уменьшение объема ГМПД более чем на 50%. В исследование включали пациентов с корешковым синдромом шейной или поясничной локализации, индуцированным ГМПД, без выраженного неврологического дефицита и тяжелой сопутс твующей патологии, отказавшихся от хирургического лечения.
Критерии включения: возраст пациентов от 20 до 70 лет; клинический диагноз ГМПД в соответствии МКБ-10, подтвержденный данными МРТ (или КТ); длительность болевого синдрома до 6 нед.; тяжесть болевого синдрома в ноге не менее 6 баллов по визуально-аналоговой шкале (ВАШ); подписанное информированное согласие на участие в исследовании.
Критерии исключения: эпилепсия; тяжелые психические заболевания; выраженные когнитивные расстройства; тяжелые, декомпенсированные соматические заболевания; беременность или лактация; наличие абсолютных показаний к хирургическому лечению; локальные инъекции глюкокортикостероидов (ГКС) в течение последних 4 нед.; операции по поводу ГМПД в анамнезе; участие в других клинических исследованиях.
Пациенты в качестве анальгетической терапии получали адъювантные анальгетики — габапентин, амитриптилин или НПВП (по требованию). Дозу габапентина корректировали в соответствии со степенью выраженности боли (от 300 до 1800 мг/сут). Этот препарат назначался на основании данных о его эффективности при нейропатическом компоненте болевого синдрома в соответствии с Клиническими рекомендациями Российско e3о общества по изучению боли [12]. Эффективность габапентина при невропатической боли доказана (сила рекомендаций А, класс доказательности I) [12, 13].
Всех пациентов изначально подробно информировали о целях лечения, направленного на адекватное селективное обезболивание, стимулирование и отслеживание резорбции. Достичь этого предполагалось за счет сохранения воспалительной реакции, которая представляет собой естес твенный этап заживления тканей, а также за счет стимуляции местных воспалительных процессов посредством ФТЛ — лазеротерапией (действием многоволновой закрытой системы, в которой используется две длины волны — 808 и 905 нм, первая обладает противоотечным и противовоспалительным действием, вторая — обезболивающим действием). Пациентам не рекомендовали использовать инъекции ГКС во время прохождения лечения. В случае сильной боли допускался прием НПВП: ибупрофена в дозе 200–400 мг после еды или целекоксиба в дозе 100–200 мг после еды, а также аппликация лидокаинового пластыря Версатис (экспозиция — 12 ч) курсом до 5 дней. На этот период рекомендовали прием гастропротекторов (омепразол).
МРТ проводилась на томографах 1,5 и 3,0 Тл с использованием Т1, Т2 и Т2-STIR последовательностей в трех плоскостях с шагом 3 мм без расстояния между срезами. Количество исследований у каждого пациента составляло от 3 до 9 (9 исследований выполнено только 15 больным), в зависимости от скорости прогрессирования МРТ-изменений, с примерной периодичностью раз в 2–3 мес. Период наблюдения составлял от 1,5 до 18 мес. Кратность МРТ-исследований определялась клинической картиной (выраженностью болевого синдрома) и скоростью достижения резорбции.
Все изображения МРТ были проанализированы и обработаны двумя независимыми рентгенологами с опытом работы на МРТ более 7 лет. Затем данные сравнивали и усредняли. При достаточном уменьшении размеров грыжи, трактуемых как резорбция, и при сопоставимом клиническом улучшении курс ФТЛ и прием медикаментов завершался
Результаты исследования
Грыжи МПД шейного отдела позвоночника были диагностированы у 52 (15,9%) пациентов, поясничного — у 275 (84,1%). У большинства пациентов продолжительность заболевания составляла от 3 до 12 мес.
Провоцирующими факторами последнего обострения болевого синдрома явились: подъем тяжестей, физическое перенапряжение, резкие повороты или длительное пребывание в неудобном положении — у 194 (59,3%) человек (91 мужчина и 103 женщины); переохлаждение — у 54 (16,5%) пациентов (18 мужчин и 36 женщин). Сочетание этих факторов наблюдалось у 58 (17,7%) человек (27 мужчин и 31 женщина). У 21 (6,5%) пациента (13 мужчин и 8 женщин) не удалось установить причину обострения.
В течение периода наблюдения все пациенты проходили курс ФТЛ, а также принимали препараты для купирования болевого синдрома.
В процессе исследования у всех больных наблюдалось постепенное снижение выраженности болевого синдрома и уменьшение размеров ГМПД.
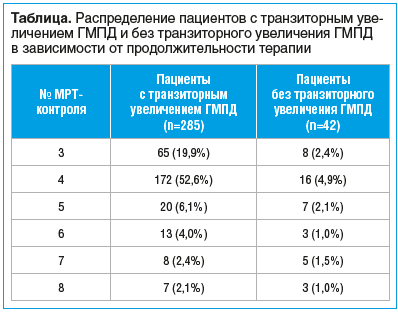
Было обнаружено, что у 285 (87,1%) пациентов на фоне клинического улучшения отмечалось транзиторное увеличение ГМПД (см. таблицу) на 2–6 мм в линейных размерах (горизонтальном или вертикальном), что в 266 (81,3%) случаях сопровождалось усилением сигнала на T2-взвешенных импульсных последовательностях. Транзиторное увеличение размеров с одновременным изменением сигнала наблюдалось у большинства пациентов в период от 2 до 5 мес. (3,4±0,9 мес.) с начала лечения, после которого происходило последующее уменьшение размеров ГМПД.
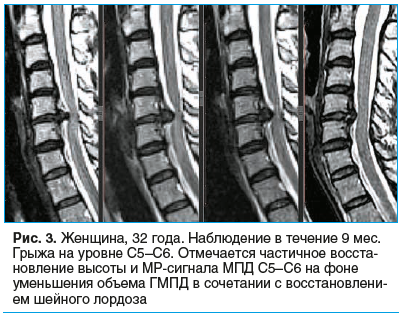
На рисунках 1–3 представлены снимки пациентов, включенных в исследование, наблюдавшихся от 6 до 12 мес., с регрессией ГМПД.
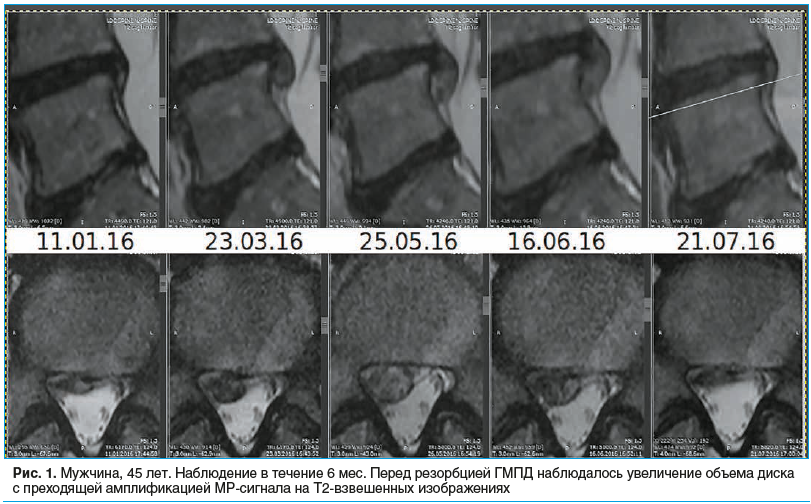
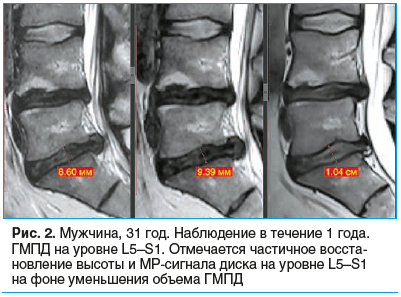
У 233 (71,2%) пациентов отмечалось усиление сигнала от ГМПД, у 195 (59,6%) пациентов — частичное восстановление высоты МПД, но не более чем на 2 мм.
Кроме того, резорбция грыжи сопровождалась улучшением статики позвоночного столба у 85 (25,9%) пациентов — уменьшением или исчезновением сколиоза, восстановлением лордоза. Среднее время объективно зафиксированной резорбции ГМПД составило 4,8±0,6 мес.
С того момента, как F.C. Guinto et al. [14] в 1984 г. впервые представили клинический случай спонтанного регресса ГМПД, растущее число исследований продемонстрировало данный феномен не только в поясничном, но также в грудном и шейном отделах позвоночника [15–17]. Основная теория резорбции ГМПД, которая нашла свое подтверждение в исследованиях, предполагает, что ткань пульпозного ядра после попадания в сосудистое пространство эпидуральной оболочки спинного мозга распознается иммунной системой как инородное тело и провоцирует воспалительную реакцию. Воспалительная реакция приводит к неоваскуляризации тканей поврежденного МПД, ферментативному разрушению его ткани и фагоцитозу макрофагами [18–21].
К прогностическим факторам относят размеры грыжи, целостность тканей и рентгенологические характеристики МПД с грыжей. По данным S.H. Ahn et al. [22], степень уменьшения ГМПД коррелировала с изначально большими размерами грыжевого выпячивания.
H. Komori et al. [21] пришли к заключению, что морфологические изменения по данным МРТ преимущественно соответствовали клиническому исходу, однако обнаруживаемые изменения несколько отставали от динамики регресса клинических проявлений. Исчезновение ГМПД часто наблюдалось в случаях грыж 3-го типа; предполагается, что этот феномен является результатом контакта с кровоснабжаемыми тканями. R.A. Autio et al. [23, 24] также опубликовали статью о маркерах спонтанной резорбции ГМПД. Авторы пришли к заключению, что усиление сигнала по контуру поврежденного МПД после введения контрастного вещества коррелировало с более высокой частотой спонтанной резорбции грыжи и предположительно было связано с ангиогенезом, который обеспечивает доступность тканей ГМПД для иммунной системы.
МРТ позволяет достоверн ee оценить состояние разрушенного МПД в связи с высокой чувствительностью метода к содержанию воды в тканях МПД. Но точность этого диагностического метода еще недостаточно высока для определения потенциального источника боли в спине и в настоящее время составляет около 70% [25]. Для оценки состояния МПД чаще всего используют T2- и T1-взвешенные изображения. МРТ также используют для классифика ции повреждения МПД [26, 27].
Резорбция ГМПД может сопровождаться временным увеличением ее размеров и изменением ее структуры, вероятно, в результате воспалительной реакции и инфильтрации ткани грыжи иммунными клетками [9]. В данном исследовании мы подтвердили, что ранее замеченный феномен транзиторного увеличения ГМПД не должен рассматриваться только как отрицательная динамика консервативного лечения ГМПД, так как в большинстве случаев за ним следует уменьшение размеров ГМПД и клинически eе улучшение.
В то же время остается открытым вопрос, когда увеличение размеров ГМПД с изменением сигнала на Т2-взвешенных изображениях или без него может быть признаком ее рецидива или отрицательной динамики, что требует дополнительных исследований.
Заключение
В настоящей работе мы впервые использовали новый термин для МРТ-исследования позвоночника — «транзиторное увеличение размера ГМПД», чтобы описать феномен псевдопрогрессирования, который наблюдается в процессе резорбции ГМПД и определили его частоту. Данный феномен может являться положительным прогностическим фактором, когда одновременно с увеличением размера ГПМД происходит усиление сигнала на T2-взвешенных импульсных последовательностях, и должен рассматриваться как возможный предиктор резорбции ГМПД. Необходимы дальнейшие исследования в этой области для определения визуализационных маркеров резорбции и более точного распределения пациентов на амбулаторном этапе для выбора консервативного или хирургического лечения.





