Инициация и интенсификация сахароснижающей терапии у больных сахарным диабетом 2 типа: обновление консенсуса совета экспертов Российской ассоциации эндокринологов (2015 г.)


Published: Jan. 1, 2015
Latest article update: Nov. 24, 2022
Abstract
Настоящее обновление консенсусного алгоритма инициации и интенсификации сахароснижающего лечения у больных сахарным диабетом 2 типа (СД2) сохраняет основные положения предшествующего документа Российской ассоциации эндокринологов, вышедшего в 2011 г.
Обновление исходного документа было обусловлено появлением новых сахароснижающих препаратов, необходимостью определения их места в терапевтических схемах, появлением новых данных по безопасности ранее применявшихся средств, а также обновлением рекомендаций международных диабетологических сообществ.
Абсолютным приоритетом при выборе тактики ведения на любом этапе остается формирование индивидуального подхода к каждому пациенту, обеспечивающее эффективность и безопасность сахароснижающего лечения.
Основные принципы определения индивидуальных терапевтических целей с учетом имеющихся осложнений, возраста пациента, ожидаемой продолжительности жизни и риска гипогликемий остались прежними, однако внесено несколько уточнений, призванных облегчитъ принятие клинического решения.
Сохранен принцип стратификации терапевтической тактики в зависимости от исходного уровня метаболического контроля (монотерапия или комбинированное лечение), при этом учтено расширение перечня групп лекарственных препаратов, доступных в Российской Федерации для лечения больных СД2 на момент публикации обновленного консенсуса. Обозначены рациональные и нерациональные комбинации сахароснижающих
Keywords
Терапия, консенсус;, сахароснижающая, Российская, диабет, типа;, ассоциация, эндокринологов;, 2, сахарный
В Российской Федерации продолжает увеличиваться число больных сахарным диабетом 2 типа (СД2), что является отражением общемировых тенденций. По данным Государственного Регистра больных СД2, на 1 января 2015 г. в РФ по обращаемости в лечебные учреждения насчитывается 3,7 млн чел. [1].
Помимо стремительных темпов роста заболеваемости СД2, его характерными особенностями являются: тенденция к омоложению возраста дебюта, относительно поздняя диагностика как самого заболевания, так и его осложнений в связи с длительным бессимптомным течением, полиморбидность (особенно при сочетании с ССЗ и ожирением). Принимая во внимание вышеперечисленные закономерности и тренд к увеличению продолжительности жизни больных диабетом становится очевидной острая необходимость в наличии дифференцированного алгоритма сахароснижающего лечения, что необходимо для предупреждения развития инвалидизирующих осложнений СД и обеспечения индивидуального подхода к лечению пациентов разного возраста, длительности заболевания, выраженности осложнений соматических отягощений и рисков и т.д.
В 2011 г. после длительного всестороннего обсуждения Российской ассоциацией эндокринологов (РАЭ) был принят Консенсус по инициации и интенсификации сахароснижающей терапии у больных СД2, провозгласивший приоритет индивидуального подхода к лечению и выбор индивидуальных целей терапии в зависимости от возраста, наличия тяжелых осложнений, риска гипогликемий и ожидаемой продолжительности жизни [2]. С учетом международного опыта были сформулированы принципы стратификации терапевтической тактики в зависимости от исходной метаболической декомпенсации с использованием всех доступных на тот момент классов лекарственных препаратов [2, 3].
Однако за время, прошедшее с момента публикации консенсусного алгоритма РАЭ 2011 г., накоплен значительный объем новых данных по безопасности уже используемых сахароснижающих средств. Кроме того, произошло внедрение в клиническую практику новых лекарственных препаратов, что в совокупности требует обновления исходного документа. Международные ассоциации также начинают проводить обновление своих рекомендательных документов по терапии СД2, обосновывая эту необходимость теми же аргументами [4]. Дополнительно необходимо отметить назревшую необходимость существенного расширения раздела, касающегося вопросов инициации и интенсификации инсулинотерапии при СД2.
Совет экспертов РАЭ после дискуссионного обсуждения вышеперечисленных вопросов разработал настоящее Обновление Консенсуса по инициации и интенсификации сахароснижающей терапии СД2 2015 г.
Необходимо подчеркнуть, что общие положения Консенсуса РАЭ по инициации и интенсификации сахароснижающей терапии СД2 не претерпели существенных изменений. Для целостности восприятия и сохранения логической последовательности единого документа новые изменения и отдельные комментарии интегрированы в текст Консенсуса 2011 г (разделы, не подвергавшиеся изменениям, оставлены в прежней редакции).
В представленном обновленном алгоритме РАЭ индивидуальный подход к лечению пациента сохранен в качестве главного идеологического положения.
Приоритетом в выборе терапии должны стать безопасность и эффективность лечения. По мнению экспертов РАЭ, эти параметры являются гораздо более важными, чем стоимость препарата или длительность его использования в клинической практике. Следует четко представлять, что стоимость сахароснижающих препаратов представляет собой лишь малую часть всей стоимости лечения СД (включая средства самоконтроля, лечение гипогликемических эпизодов и их последствий, госпитализаций и т.д.). Наибольшая часть расходов связана с лечением осложнений СД, развитие которых практически неизбежно при отсутствии адекватного гликемического контроля.
Представленное обновление консенсусного алгоритма инициации и интенсификации сахароснижающей терапии СД2 (2015 г.) является согласованным решением совета экспертов РАЭ, основанным на обобщении Российского и международного опыта лечения СД2 и опирающимся на данные доказательной медицины.
Общие положения консенсуса РАЭ по инициации и интенсификации сахароснижающей терапии СД2
- Определение индивидуального целевого значения гликемического контроля по уровню гликированного гемоглобина НЬА1С.
Для каждого пациента индивидуально устанавливается целевой уровень НЬА1С, который зависит от возраста пациента или ожидаемой продолжительности его жизни, длительности заболевания, наличия сосудистых осложнений, риска развития гипогликемий.
На выбор индивидуального целевого уровня НЬА1С также могут оказывать влияние и другие факторы: мотивация, приверженность к лечению, уровень образования пациента, использование других лекарственных средств.
- Стратификация терапевтической тактики в зависимости от исходного уровня НЬА1С.
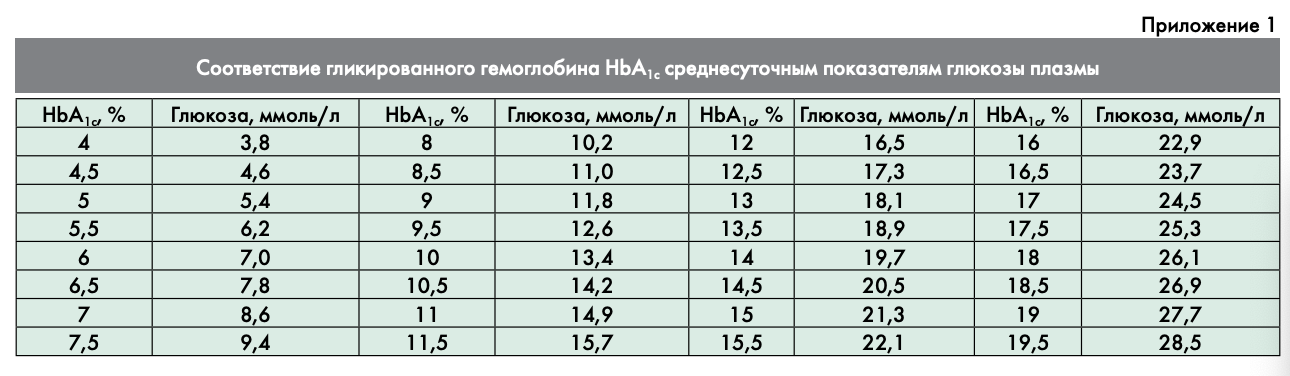
Основным ориентиром в выборе стратегии лечения пациентов с впервые выявленным СД2 должен являться показатель НЬА1С, так как значения гликемии в течение суток имеют большую вариабельность. Показатели гликемии (натощак и постпрандиальные) могут быть использованы для принятия решений при невозможности получить результаты НЬА1С (приложение 1. «Соответствие гликированного гемоглобина НЬА1С среднесуточному уровню глюкозы плазмы за последние 3 мес»).
- Изменение образа жизни (снижение массы тела при ее избытке, ограничение легкоусвояемых углеводов и насыщенных жиров, активизация физических нагрузок) является основой терапии СД2 при любом исходном уровне метаболического контроля и должно продолжаться на всем протяжении заболевания. Обучение и мотивация больного должны начинаться незамедлительно и сопровождать лечение. Поэтому терапия сахароснижающими препаратами в подавляющем большинстве случаев добавляется к изменению образа жизни уже в дебюте заболевания с учетом сложного патогенеза и прогрессирующего течения.
- При НЬА1С 6,5—7,5% в дебюте достижение целевых значений гликемии возможно при использовании монотерапии сахароснижающими препаратами. Если при монотерапии достичь поставленных целей не удается, то в последующем возможно применение комбинированного лечения (два или три препарата).
- При НЬА1С 7,6—9,0% в дебюте следует сразу начинать с комбинированной терапии. При неэффективности возможно сочетание трех сахароснижающих препаратов или начало инсулинотерапии.
- При НЬА1С более 9,0% в дебюте при наличии выраженной клинической симптоматики (потеря массы тела, жажда, полиурия и др.) следует назначить инсулин (в виде монотерапии или в комбинации с пероральными сахароснижающими препаратами). В дальнейшем, в случае достижения целевых показателей метаболического контроля, пациент может быть переведен на комбинированное лечение без инсулина.
В случае отсутствия клинических симптомов декомпенсации в «дебюте» возможно назначение комбинации 2 или 3 сахароснижающих препаратов.
3. Принятие решения об изменении (интенсификации) ранее назначенной терапии.
Мониторинг эффективности сахароснижающей терапии по уровню НЬА1С рекомендуется осуществлять каждые 3 мес. Титрация дозы назначенных сахароснижающих препаратов до максимально эффективной (переносимой) осуществляется по данным самоконтроля гликемии.
Изменение (интенсификация) сахароснижающей терапии при ее неэффективности (т.е. при отсутствии достижения индивидуальных целей НЬА1С) должно быть выполнено не позднее чем через 6 мес; в случае ухудшения самочувствия или при отсутствии признаков эффективности лечения решение об интенсификации может быть принято раньше.
Следует подчеркнуть, что срок принятия решения «не позднее, чем через 6 мес» в значительной степени обусловлен необходимостью предостеречь от излишне быстрой и агрессивной интенсификации лечения у пациентов, имеющих высокий сердечно-сосудистый риск. В то же время, у лиц с низким риском целесообразна интенсификация лечения не позднее, чем через 3 мес терапии, не обеспечившей достижения индивидуальных целевых значений гликемического контроля. Данное уточнение в настоящем консенсусе относится ко всем разделам, касающимся интенсификации терапии.
Безопасность и эффективность являются приоритетами в выборе лечения. Индивидуальный подход должен применяться как на старте терапии, так и на любом этапе лечения.
Определение индивидуального целевого значения гликемического контроля по уровню НЬА1с
Индивидуальный подход к больному и, соответственно, определение индивидуального целевого уровня НЬА1С должны являться основой выбора стратегии сахароснижающего лечения.
При выборе индивидуального целевого уровня НЬА1С в первую очередь следует учитывать:
- возраст пациента;
- ожидаемую продолжительность жизни (ОПЖ);
- наличие тяжелых макрососудистых осложнений;
- риск развития тяжелых гипогликемий.
Доказано, что сердечно-сосудистые осложнения и смертельный исход более часто встречаются у пациентов с гипогликемическими эпизодами (особенно тяжелыми гипогликемиями).
Риски интенсивной сахароснижающей терапии, имеющей целью предупредить развитие сосудистых осложнений диабета, могут превысить ожидаемую пользу по мере увеличения длительности диабета, возраста пациента и наличия уже имеющихся сосудистых осложнений. Результаты исследования ACCORD показали, что чрезмерно быстрое или агрессивное регулирование терапии ассоциировано с повышенным риском развития гипогликемий и смертности от сердечно-сосудистых причин [5].
Основываясь на результатах международных исследований ACCORD, VADT, UKPDS и ADVANCE, был принят следующий алгоритм индивидуализированного выбора целей терапии по уровню НЬА1С [5—8] (табл. 1).

Пояснения к индивидуализированному выбору целей НЬА1С
- Возраст пациента не позволяет четко разграничить цели гликемического контроля, поскольку функциональное изнашивание органов и систем каждого человека с возрастом строго индивидуально. Поэтому параллельно с относительными понятиями «молодой», «средний» и «пожилой» возраст существует понятие «ожидаемой продолжительности жизни» (ОПЖ), которая в большей степени, чем возраст, позволяет определить предполагаемое общее состояние пациента и вероятность развития у него сосудистых осложнений. У пациентов молодого и среднего возраста с высокой ОПЖ предлагается достижение более строгих целей контроля гликемии для предупреждения развития микро- и макрососудистых осложнений диабета. У пациентов с 0ПЖ<5 лет (вне зависимости от возраста) цели гликемического контроля могут быть менее строгими, поскольку прогноз жизни такого пациента, как правило, определяется другой патологией (например, онкологическим заболеванием).
- Наличие тяжелых макрососудистых осложнений СД является определяющим фактором при избрании индивидуальных целей контроля гликемии. Вышеупомянутые исследования ACCORD и VADT показали, что при наличии сердечно-сосудистых осложнений достижение нормогликемии опасно развитием гипогликемических состояний, влекущих за собой кардио- и цереброваскулярные исходы.
Комментарий. Введение определения, уточняющего наличие именно тяжелых макрососудистых осложнений СД в качестве определяющего критерия для избрания целей терапии, продиктовано необходимостью исключить ситуации, когда наличие начальных стадий сосудистых повреждений трактуется как основание для менее жестких целей гликемического контроля и в итоге приводит к хронической гипергликемии и прогрессированию осложнений.
Такой подход категорически не означает, что наличие тяжелых микрососудистых осложнений (например, выраженных стадий хронической болезни почек (ХБП)) не след ует учитывать при избрании целей лечения. Напротив, наличие ХБП >3 стадии будет прямым указанием для избрания более мягких целей сахароснижающего лечения, так как находится в перечне основных критериев риска тяжелой гипогликемии.
- Риск тяжелой гипогликемии резко ограничивает возможность строгого контроля гликемии, поскольку влечет за собой риск сердечно-сосудистых событий. По данным исследования VADT, перенесенная тяжелая гипогликемия в 4 раза повышает риск сердечно-сосудистой смертности и по значимости превосходит другие факторы риска, такие как возраст, наличие дислипидемии и сердечно-сосудистых заболеваний [6]. Основными критериями риска тяжелой гипогликемии являются: тяжелая гипогликемия в анамнезе, бессимптомная гипогликемия, большая продолжительность СД, наличие ХБП >3 стадии, деменция. Также в группу риска развития тяжелой гипогликемии входят пациенты пожилого возраста и получающие ß-блокаторы (особенно неселективные или слабоселективные).
Таким образом, предлагаются следующие целевые значения гликемического контроля.
При отсутствии тяжелых макрососудистых осложнений/низком риске тяжелых гипогликемий:
- молодой возраст: <6,5%;
- средний возраст: <7,0%;
- пожилой возраст (и/или ОПЖ <5 лет): <7,5%.
При наличии тяжелых макрососудистых осложнений/ высоком риске тяжелых гипогликемий:
- молодой возраст: <7,0%;
- средний возраст: <7,5%;
- пожилой возраст (и/или ОПЖ<5 лет): <8,0%.
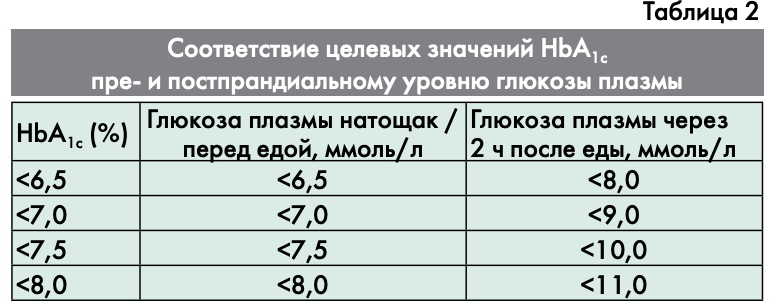
Ниже в таблице 2 указаны целевые значения глюкозы плазмы натощак перед едой и через 2 ч после еды, соответствующие целевым значениям уровня НЬА1С. Данные целевые значения не относятся к детям, подросткам и беременным женщинам.
Выбор терапевтической тактики при исходном уровне НЬА1с 6,5-7,5%
На рис. 1 представлена схема выбора стартовой сахароснижающей терапии (1 этап) и ее интенсификация (2 и 3 этапы) при исходном уровне НЬА1С 6,5—7,5%.
1 ЭТАП - СТАРТ ТЕРАПИИ
Прежде чем начать медикаментозную терапию, необходимо определить индивидуальное целевое значение уровня НЬА1С конкретного пациента (табл. 1). В том случае, если индивидуальная цель оказалась выше исходного уровня НЬА1С (это может бытъ у пожилых лиц с тяжелыми сосудистыми осложнениями), следует обучить пациента правилам здорового питания и определить график наблюдения за пациентом на фоне предложенной диетотерапии.
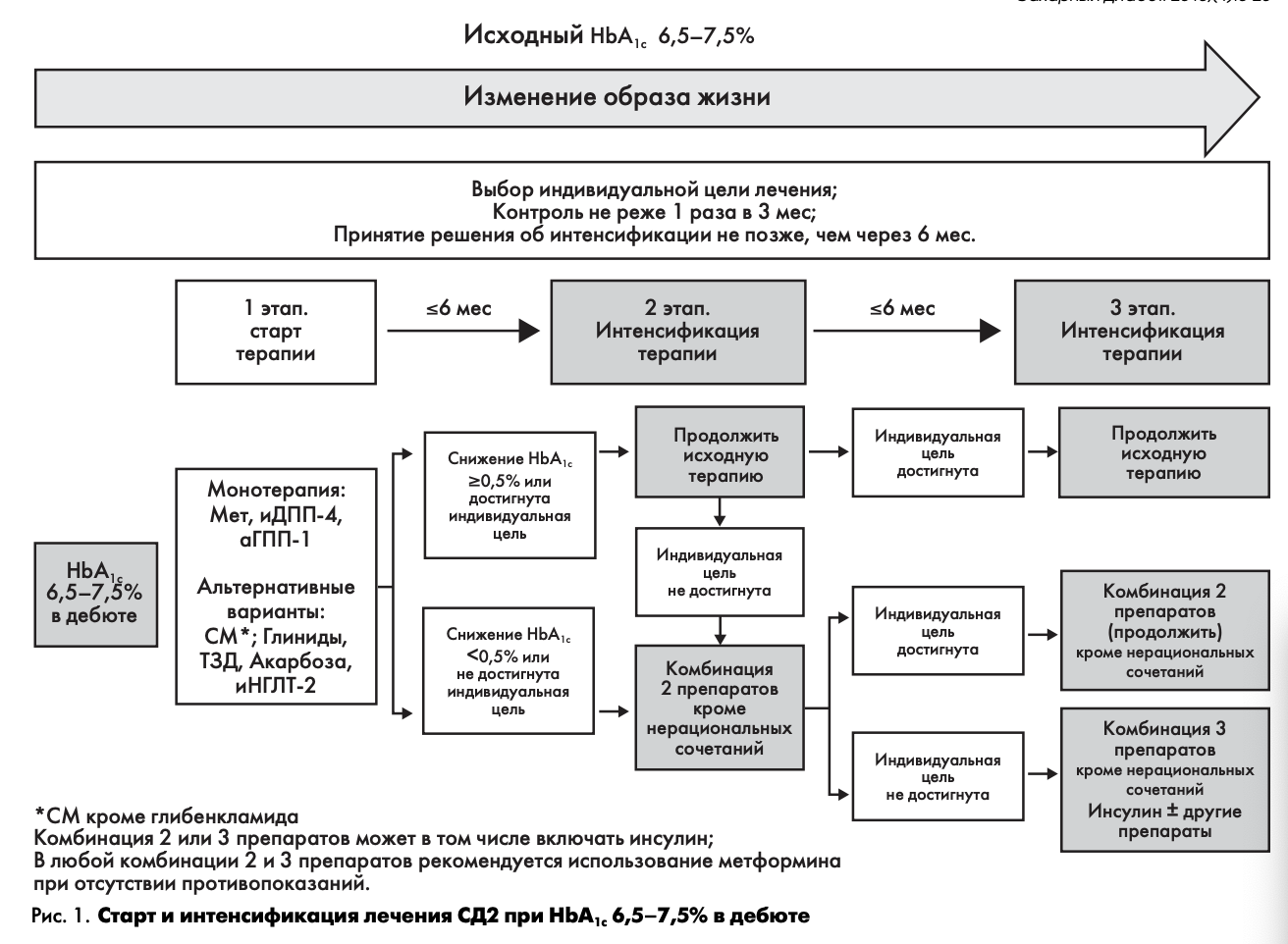
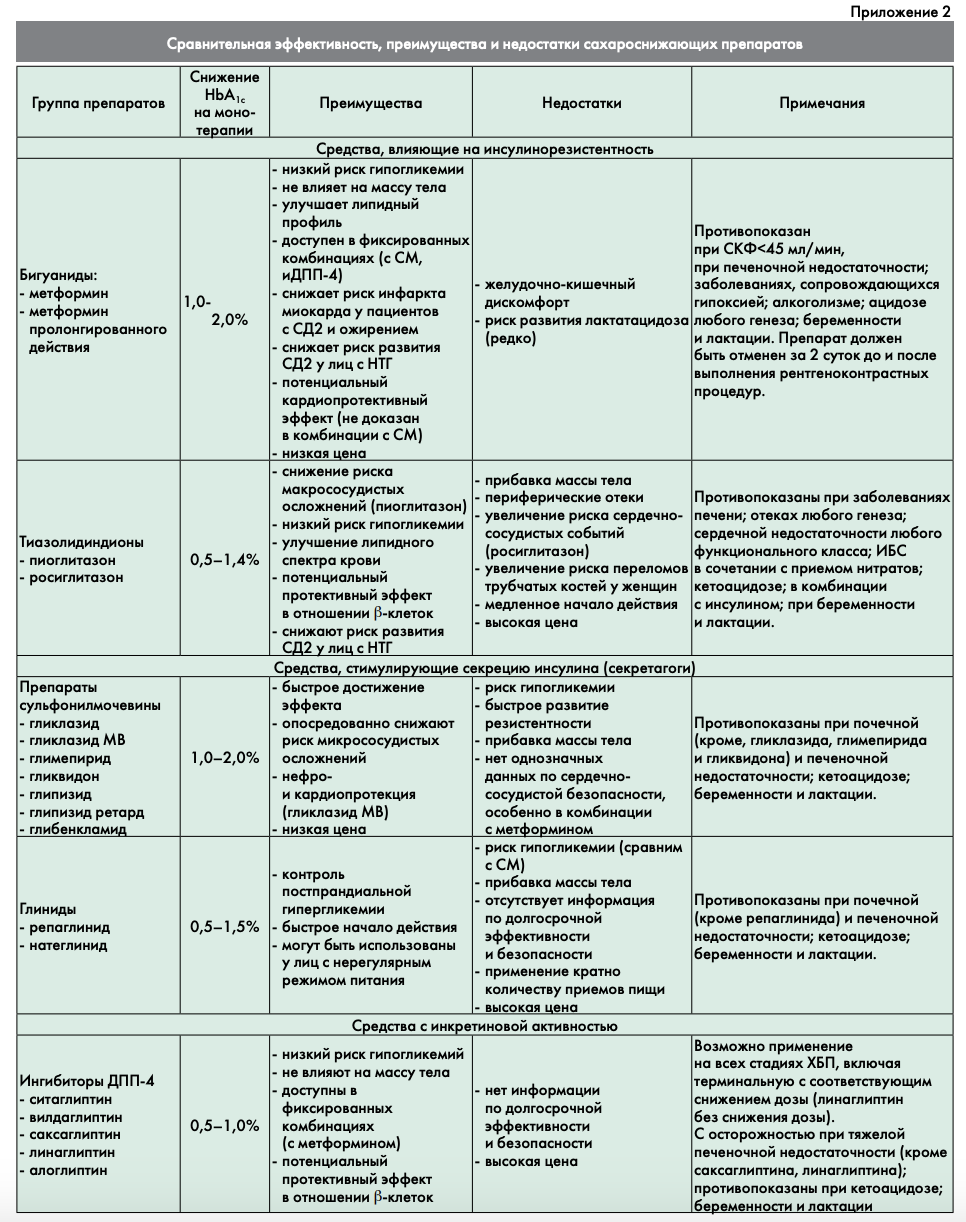
Если же индивидуальная цель ниже исходного уровня НЬА1С, то в этом случае диетотерапию необходимо дополнить медикаментозной монотерапией. Исходя из реальной клинической ситуации и поставленных индивидуальных целей, врач может выбрать препарат, оптимально подходящий конкретному пациенту (основные характеристики всех групп препаратов, используемых в современной диабетологии и зарегистрированных в РФ, представлены в приложении 2).
При выборе препарата необходимо учесть следующие факторы:
- ожидаемая сахароснижающая эффективность;
- риск гипогликемий;
- масса тела;
- возраст;
- наличие сосудистых осложнений;
- наличие сопутствующей патологии;
- длительность диабета.
Кроме того, на выбор препарата могут влиять: удобство использования, предполагаемая степень приверженности пациента к лечению, стоимость.
Приоритет должен быть отдан средствам с минимальным риском гипогликемий. При непереносимости или противопоказаниях к препаратам первого ряда рекомендуется начало терапии с альтернативных классов сахароснижающих препаратов. Эффективным считается темп снижения НЬА1с>0,5 % за 6 мес. наблюдения.
Особого внимания требует группа высокого риска: пациенты с длительностью СД более 10 лет, с выраженной макрососудистой патологией, отсутствием распознавания гипогликемий, ограниченной ОПЖ или серьезными сопутствующими заболеваниями.
Препараты первого ряда для старта терапии:
- метформин;
- ингибиторы ДПП-4;
- агонисты рецепторов ГПП-1.
Метформин остается наиболее изученным с точки зрения эффективности и безопасности препаратом при монотерапии. Препарат не вызывает гипогликемии и прибавки массы тела. Предпочтительно назначение больным с избытком массы тела или ожирением. Обладает рядом дополнительных положительных эффектов, помимо сахароснижающего, — кардиопротективным, гиполипидемическим. Метформин рекомендован в качестве стартовой терапии всеми ведущими профессиональными сообществами диабетологов. Необходимо помнить, что наибольшая сахароснижающая эффективность метформина отмечается при достижении дозы 2000—2500 мг/сутки. Эта доза должна достигаться методом постепенной титрации по 500 мг каждую неделю (для минимизации нежелательных побочных явлений со стороны желудочно-кишечного тракта). С 2013 г. РАЭ изменила ограничения по приему метформина при нарушении функции почек, согласно которым прием препарата разрешен при снижении СКФ до 45 мл/мин/1,73 м2), что было продиктовано накопленным объемом данных о соотношении риск/польза у пациентов с ХБП [9, 10]. Метформин противопоказан при состояниях тяжелой гипоксии (сердечной недостаточности III—IV функционального класса, дыхательной недостаточности, анемии), при злоупотреблении алкоголем. При проведении рентгеноконтрастных исследований требуется временная отмена метформина с учетом риска развития контра- стиндуцированной нефропатии (за 2 суток).
Ингибиторы ДПП-4 (вилдаглиптин, ситаглиіітин, сак- саглиптин, линаглиптин, алоглиптин) — группа препаратов инкретинового ряда для перорального применения. Не вызывают гипогликемии и прибавки массы тела. Предположительно (доказано в эксперименте на животных), эти препараты обладают дополнительным преимуществом в отношении сохранения массы ß-клеток поджелудочной железы [11, 12]. Предпочтительно назначение больным с избытком массы тела или ожирением, лицам пожилого возраста с высоким риском гипогликемий.
В 2013 г. завершены крупные рандомизированные исследования SAVOR и EXAMINE, в целом показавшие сердечно-сосудистую безопасность применения ингибиторов ДПП-4 [13, 14]. Однако при этом необходимо учитывать результаты исследования SAVOR, указывающие на необходимость соблюдения осторожности у лиц с сердечной недостаточностью [13]. Несколько других масштабных исследований по оценке сердечно-сосудистого риска на фоне приема ингибиторов ДПП-4 находятся в завершающих стадиях [15].
В последнее время снижены ограничения по применению препаратов этой группы при почечной патологии (применение при ХБП 1—5 ст. с коррекцией дозы для большинства препаратов) [1].
Традиционно рекомендуется осторожность при назначении препаратов пациентам с анамнестическими указаниями на наличие панкреатита, однако на настоящий момент совокупный анализ результатов наблюдательных программ и баз данных, а также завершенных клинических исследований (в том числе крупномасштабных SAVOR и EXAMINE), не позволяет утверждать, что этот вид терапии ассоциирован со значимым увеличением заболеваний поджелудочной железы [16].
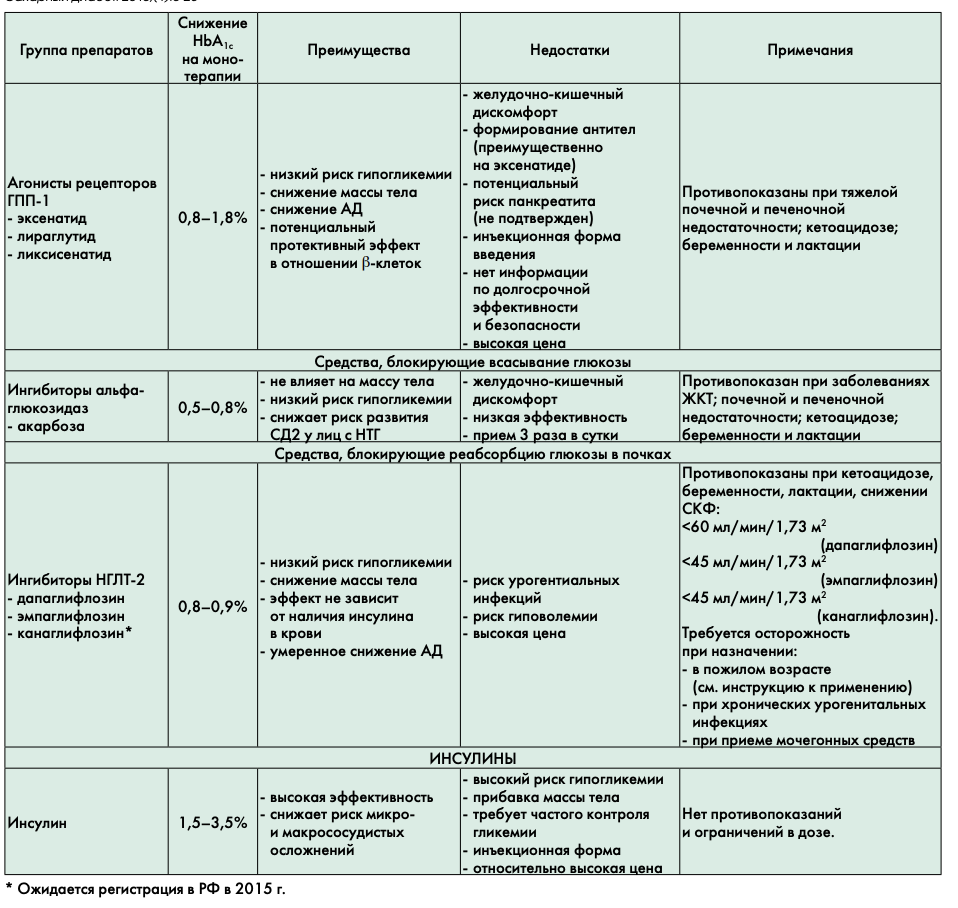
Агонисты рецепторов ТПП-1 (эксенатид, лираглутид, ликсисенатид) — препараты из класса инкретинового ряда для подкожного введения. Лираглутид — первый аналог человеческого ТПП-1, вводится один раз в сутки. Препараты не вызывают гипогликемии, снижают массу тела и артериальное давление. Предположительно (доказано в эксперименте на животных) обладают дополнительным преимуществом в отношении сохранения массы ß-клеток поджелудочной железы [17,18]. У больных с ожирением позволяют ожидать дополнительный эффект в виде снижения массы тела. Препараты не рекомендуется применять у пациентов с тяжелыми нарушениями функции почек (СКФ менее 30 мл/мин/1,73 м2); нарушениями функции печени; сердечной недостаточностью III—IV функционального класса; воспалительными заболеваниями кишечника; парезом желудка. Требуется осторожность при назначении препаратов пациентам с анамнестическими указаниями на рецидивирующий панкреатит. С учетом основных характеристик аГПП-1 могут быть предпочтительны при наличии ожирения и артериальной гипертензии в связи с эффективным снижением массы тела и уровня систолического АД.
Альтернативные препараты для старта терапии
Отнесение препарата к альтернативным (применительно к ситуации выбора стартового препарата в качестве монотерапии) обусловлено не столько характеристиками сахароснижающего потенциала, сколько присутствием любого из следующих факторов: увеличение риска гипогликемий, увеличение массы тела, значимые побочные эффекты, недостаточная длительность клинического применения в Российской Федерации.
На настоящий момент к альтернативным препаратам для старта терапии предлагается относить:
- препараты сульфонилмочевины;
- глиниды (меглитиниды);
- тиазолидиндионы (глитазоны);
- ингибиторы альфа-глюкозидаз;
- ингибиторы натрий-глюкозного котранспортера 2 типа (глифлозины).
Препараты сульфонилмочевины (СМ) при исходном уровне НЬА1С 6,5—7,5% не являются средствами первого ряда. Серьезным ограничением их применения является риск развития гипогликемий и прибавка массы тела. Поэтому назначение этих препаратов при данном уровне НЬА1С оправдано только при отсутствии избыточной массы тела или ожирения (что свидетельствует в пользу сниженной секреции инсулина у конкретного пациента), при наличии непереносимости или противопоказаний к применению препаратов с низким риском гипогликемии. Из препаратов СМ предпочтительно назначение гликлазида модифицированного высвобождения или глимепирида. Препарат глибенкламид не рекомендуется в качестве стартового сахароснижающего средства, поскольку его применение ассоциировано с наиболее высоким риском гипогликемий [19]. Также его назначение не рекомендовано у лиц пожилого возраста и при ХБП 3 ст. и более.
Глиниды (репаглинид, натеглинид), как и препараты СМ, ассоциируются с риском гипогликемий и увеличением массы тела. Показаны для лиц с отсутствием избыточной массы тела или ожирения, т.е. с признаками недостаточной секреции инсулина.
Тиазолидиндионы (ТЗД) (пиоглитазон, росиглитазон). Несмотря на чрезвычайно благоприятный метаболический профиль действия (снижение инсулинорезистентности, сахароснижающий эффект без риска развития гипогликемии, гиполипидемический эффект, данные о сохранении функции ß-клеток), использование этих препаратов имеет весьма серьезные ограничения. С 2010 г. росиглитазон по решению Европейского медицинского агентства (ЕМЕА) изъят с рынка в связи с негативными сердечно-сосудистыми эффектами, а в США наложены ограничения к применению этого препарата. Однако позиция FDA впоследствии была пересмотрена в сторону меньшей определенности в отношении повышенного риска сердечно-сосудистых событий на фоне приема росиглитазона [20]. Также крупный мультипопуляцион- ный анализ (данные 1,01 млн пациентов, более 5,9 млн пациенто-лет наблюдения) не выявил ассоциации между приемом пиоглитазона и риском развития рака мочевого пузыря [21]. Тем не менее, реально применяемым представителем этого класса препаратов в большинстве стран мира и в России остается только пиоглитазон. Общим негативным эффектом глитазонов является прибавка массы тела, возможность развития отеков, повышенный риск развития переломов трубчатых костей и сердечной недостаточности. Пиоглитазон рекомендуется в качестве монотерапии пациентам с выраженной инсулинорезистентностью, отсутствием сердечно-сосудистой патологии в случае непереносимости или противопоказаний к применению препаратов первого ряда.
Ингибиторы альфа-глюкозидаз (акарбоза) обладают относительно скромным сахароснижающим потенциалом и выраженными побочными эффектами со стороны желудочно-кишечного тракта, что обусловливает крайне низкую приверженность к лечению у пациентов. Препарат не оказывает системного действия, не вызывает гипогликемий, снижает главным образом уровень пост- прандиальной гликемии. В качестве монотерапии может бытъ рекомендован пациентам при непереносимости или наличии противопоказаний к препаратам первого ряда выбора.
Ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) (дапаглифлозин, эмпаглифлозин (в 2015 г. ожидается регистрация в РФ препарата канаглифлозин)). Внедрение в клиническую практику этого принципиально нового класса сахароснижающих средств является одним из важных факторов, обусловивших потребность в обновлении Консенсуса 2011 г. Отнесение препаратов группы иНГЛТ-2 к альтернативным препаратам для старта терапии обусловлено отсутствием длительного опыта их применения в Российской Федерации.
Терапевтический потенциал по снижению НЬА1С этой группы препаратов составляет 0,8—0,9%. Препараты иНГЛТ—2 снижают реабсорбцию глюкозы
Сахарный диабет. 2015:(1):5-23 в почках и увеличивают экскрецию глюкозы с мочой до 60—80 г/сут. Механизм действия иНГЛТ-2 является инсулин-независимым, поэтому они не только обладают низким риском развития гипогликемий, но и могут применяться при любой длительности заболевания, в том числе на фоне значительного снижения инсулиновой секреции [22].
Дополнительными преимуществами этой группы является умеренное снижение веса (в среднем около 2 кг) и снижение артериального давления (систолического на 2—4 мм рт.ст., диастолического на 1—2 мм рт.ст.). В клинических исследованиях показана тенденция к снижению уровня мочевой кислоты в плазме крови и снижению альбуминурии (хотя эти данные требуют дальнейшего изучения) [22].
С учетом особенностей механизма действия могут сочетаться со всеми основными классами сахароснижающих препаратов, что отражено в обновленных рекомендательных документах по лечению СД2 ведущих международных профессиональных ассоциаций (однако комбинация иНГЛТ-2 и аГПП-1 остается неизученной) [4,23]. В клинических исследованиях использование иНГЛТ-2 в комбинации с инсулином сопровождалось снижением дозы последнего [24].
Побочные эффекты терапии иНГЛТ-2 преимущественно включают генитальные микотические инфекции (их частота на 11% выше у женщин и на 4% у мужчин по сравнению с плацебо), также повышен риск инфекций мочевыводящих путей. В связи с тем, что иНГЛТ-2 обладают эффектом умеренного осмотического диуреза, существует риск развития симптомов гиповолемии и гипотензии, поэтому требуется осторожность при назначении лицам пожилого возраста и принимающим диуретики. Может иметь место небольшое обратимое повышение уровня креатинина. Вследствие особенностей механизма действия препараты менее эффективны у лиц со сниженной СКФ (инструкции отдельных препаратов различаются в отношении лимитирующего уровня СКФ). Предварительно выполненные анализы совокупных данных завершенных рандомизированных исследований с применением иНГЛТ-2 продемонстрировали сердечно-сосудистую безопасность этих препаратов, тем не менее, окончательные выводы об отсутствии повышения сердечно-сосудистого риска можно будет сделать по мере завершения крупных проспективных исследований [25].
Инсулинотерапия — при уровне НЬА1С 6,5—7,5%, как правило, не требуется, однако у ряда пациентов с выраженными клиническими признаками дефицита инсулиновой секреции (отсутствие избыточной массы тела, выраженная потеря массы тела в последние месяцы, жажда, сухость, полиурия) лечение может быть начато с инсулинотерапии. Такой вариант начала СД необходимо дифференцировать с медленно прогрессирующим аутоиммунным сахарным диабетом взрослых (LADA).
Более подробно основные аспекты инсулинотерапии представлены в новом разделе «Инициация и интенсификация инсулинотерапии при СД2».
2 ЭТАП - ИНТЕНСИФИКАЦИЯ ТЕРАПИИ (КОМБИНАЦИЯ 2 ПРЕПАРАТОВ)
Принятие решения об активном действии (усилении либо принципиальном изменении терапии при ее недостаточной эффективности) следует осуществить не позже чем через 6 мес. Однако в случае ухудшения самочувствия пациента либо отсутствия признаков эффективности лечения, решение об изменении лечения может бытъ принято раньше.
В случае достижения индивидуальных целей метаболического контроля или снижении уровня НЬА1С более чем на 0,5% от исходного за 6 мес наблюдения используемую ранее монотерапию следует продолжить.
При отсутствии достижения индивидуальных целей гликемического контроля или при снижении уровня НЬА1С менее чем на 0,5% от исходного за 6 мес наблюдения, на втором этапе необходимо назначение комбинации 2 препаратов, обладающих взаимодополняющим механизмом действия.
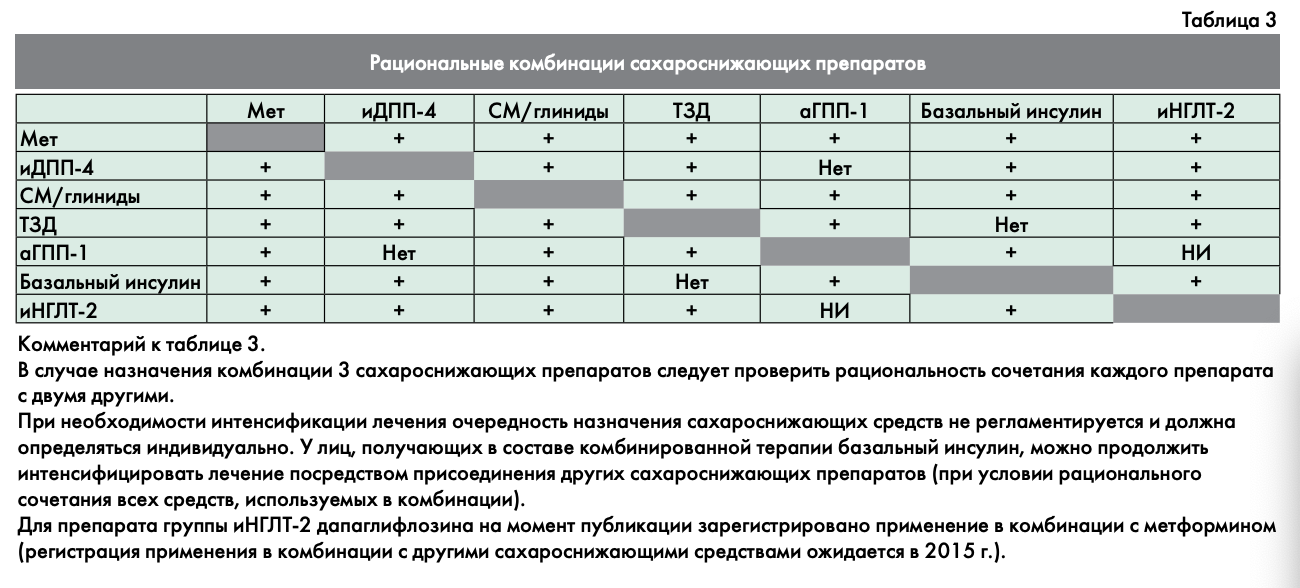
В таблице 3 отражены все возможные комбинации сахароснижающих препаратов.
Акарбоза может быть использована в комбинации с другими препаратами, однако требуется особая осторожность при сочетании акарбозы и инсулина либо секретагогов, поскольку купирование гипогликемии с помощью употребления сложных углеводов в этом случае затруднено, так как акарбоза препятствует их расщеплению и всасыванию в кишечнике. В такой ситуации купирование гипогликемии возможно только при употреблении чистой глюкозы.
Возможно назначение фиксированных комбинаций 2 различных препаратов.
Следует учесть, что инсулинотерапия базальным инсулином может быть использована уже на этом этапе (например, двойная комбинация Мет+Базальный инсулин широко применяется в практике лечения СД2 в Европе).
Необходимо помнить о нерациональных комбинациях препаратов, сочетание которых противопоказано или не приносит дополнительного эффекта. Перечень нерациональных и/или неразрешенных к применению комбинаций сахароснижающих препаратов — см. Приложение 3.
3 ЭТАП - ДАЛЬНЕЙШАЯ ИНТЕНСИФИКАЦИЯ ТЕРАПИИ (КОМБИНАЦИЯ 3 ПРЕПАРАТОВ ИЛИ ИНСУЛИНОТЕРАПИЯ)
Решение о дальнейшей интенсификации терапии должно быть принято не позднее, чем через 6 мес после 2-го этапа (контроль НЬА1С при этом рекомендуется проводить 1 раз в 3 мес).
В случае достижения индивидуальных целей гликемического контроля применявшуюся ранее комбинацию 2 сахароснижающих препаратов следует продолжить.
Если двойная терапия оказалась недостаточно эффективной, даже при использовании обоих компонентов в максимально эффективной дозе, то следующим шагом является попытка назначения тройной комбинации, в том числе с использованием инсулинотерапии.
В лечении, исходя из конкретной ситуации, могут быть использованы любые сочетания препаратов, кроме нерациональных комбинаций (см. Приложение 3). Метформин продолжает являться основой лечения на данном этапе, даже когда требуется интенсификация лечения и назначение инсулинотерапии.
В тройной комбинации следует использовать сочетание препаратов с взаимодополняющим механизмом действия. Предпочтительными компонентами комбинированной терапии должны являться средства с низким риском гипогликемий и отсутствием негативного влияния на массу тела (с учетом особенностей исходной клинической ситуации и профиля безопасности). В состав тройной комбинации может входить инсулин.
Инсулинотерапия
Если при применении комбинации 3 сахароснижающих препаратов не удается достичь эффективного контроля гликемии, то наиболее вероятно, что функциональные резервы ß-клеток поджелудочной железы уже полностью истощены и необходимо проведение инсулинотерапии.
Список препаратов, которые можно комбинировать с инсулином, ограничен.
Метформин в целом является достаточно безопасным препаратом для комбинации с инсулином (при отсутствии противопоказаний к метформину).
Препараты иДПП-4 и аГПП-1 возможно применять в комбинации с базальным инсулином.
Использование ТЗД с инсулином ассоциируется с нарастанием веса, задержкой жидкости, повышенным риском сердечной недостаточности, в связи с чем эта группа препаратов не рекомендуется к совместному применению с инсулином.
Эффективность ингибиторов альфа-глюкозидаз маловероятна на этом этапе, когда требуется назначение инсулина.
Использование СМ и глинидов с инсулином требует осторожности, так как повышает риск гипогликемий. Целесообразно прекратить их прием, когда начинается терапия прандиальным инсулином.
Ингибиторы НГЛТ2 могут применяться в сочетании с инсулином. В клинических исследованиях было показано уменьшение суточной дозы инсулина на фоне применения иНГЛТ-2 [24].
Основные принципы назначения инсулинотерапии на данном этапе изложены в разделе «Инициация и интенсификация инсулинотерапии».
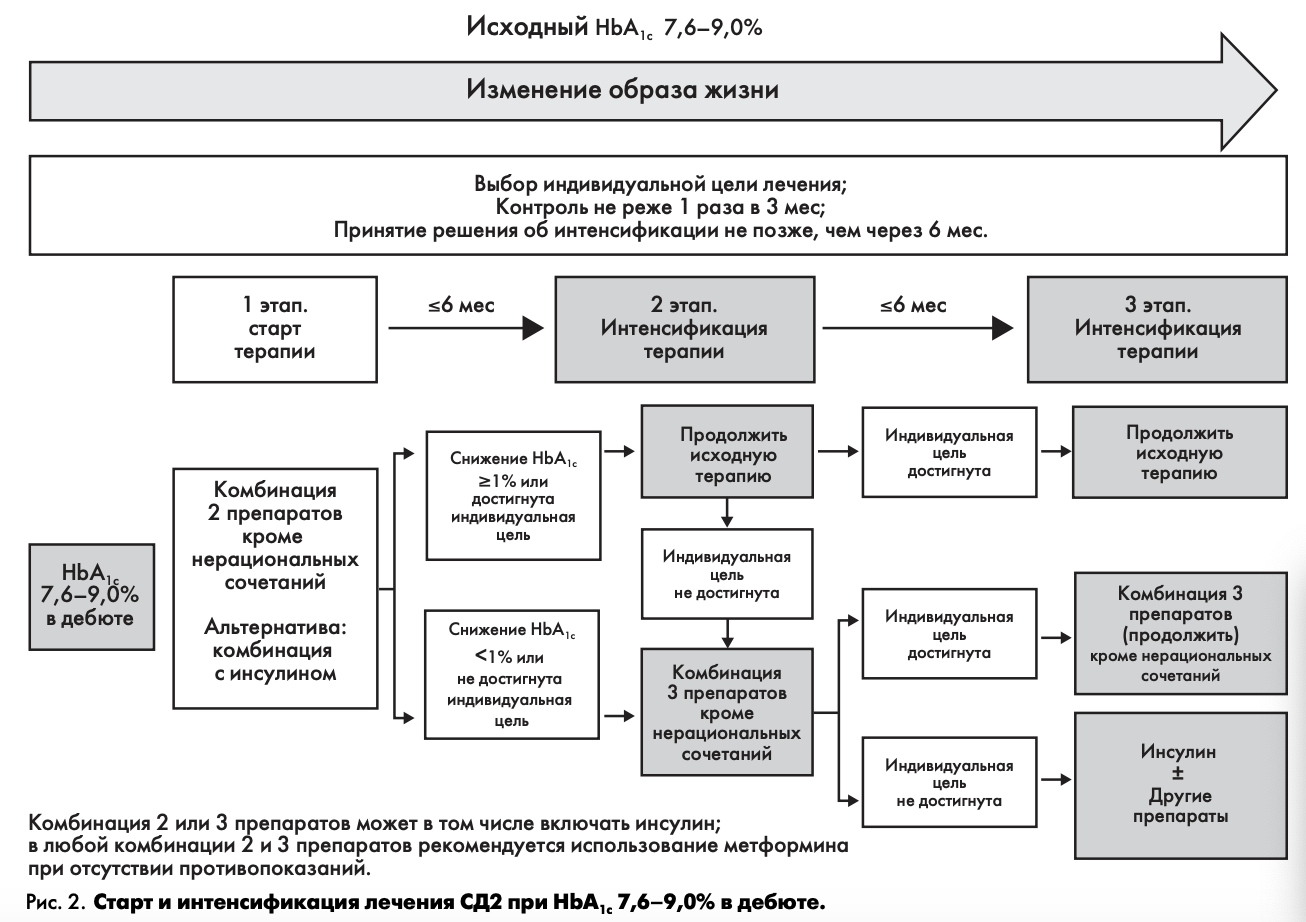
Выбор терапевтической тактики при исходном уровне НЬА1с 7,6-9,0%
На рис. 2 представлена схема выбора стартовой сахароснижающей терапии (1 этап) и ее интенсификация (2 и 3 этапы) при исходном уровне НЬА1С 7,6—9,0%.
1 ЭТАП - СТАРТ ТЕРАПИИ
Прежде всего, необходимо определить индивидуальное целевое значение уровня НЬА1С конкретного пациента (табл. 1). В том случае, если индивидуальная цель выше исходного уровня НЬА1С (например, 8,0%, что может бытъ у пожилых лиц с тяжелыми сосудистыми осложнениями), то следует обучить пациента правилам здорового питания, определить график наблюдения за пациентом на фоне пред ложенной диетотерапии и для поддержания целевого значения НЬА1С рекомендуется к диетотерапии добавить монотерапию препаратом с низким риском развития гипогликемии (метформин или иДПП-4) в минимальных (начальных) дозах.
Для пациентов с НЬА1С в пределах 7,6—9,0%, имеющих более жесткие индивидуальные целевые значения контроля гликемии, достижение этих целей назначением монотерапии не представляется возможным. В этой ситуации сразу с момента диагностики СД2 наиболее целесообразным является назначение комбинации 2 сахароснижающих препаратов, воздействующих на разные механизмы развития болезни. К наиболее распространенным рациональным комбинациям относятся сочетания метформина (базового препарата, снижающего инсулинорезистентность) и препаратов, стимулирующих секрецию инсулина: иДПП-4, аГПП-1 или СМ (глиниды).
Назначение комбинаций метформина с иДПП-4, аГПП-1, иНГЛТ-2 предпочтительно у лиц, входящих в группу высокого риска развития гипогликемических состояний, поскольку именно такие комбинации характеризуются минимальным риском гипогликемий. Эти же комбинации наиболее оправданы у лиц, имеющих избыточную массу тела или ожирение.
У больных с неудовлетворительным гликемическим контролем (при значениях НЬА1С более 8,5%) часто используются комбинации метформина с препаратами СМ или с инсулином. Следует учесть, что в данном случае весьма эффективными могут оказаться иНГЛТ-2, оказывающие сахароснижающее действие независимо от уровня инсулина в крови.
В зависимости от конкретной ситуации (индивидуального профиля переносимости препаратов, их побочных действий или противопоказаний) возможны и другие разрешенные комбинации сахароснижающих препаратов, указанные в табл. 3.
Назначение нерациональных комбинаций недопустимо (см. Приложение 3. «Перечень нерациональных и/или неразрешенных к применению комбинаций сахароснижающих препаратов»),
2 ЭТАП - ИНТЕНСИФИКАЦИЯ ТЕРАПИИ (КОМБИНАЦИЯ 3 ПРЕПАРАТОВ)
Принятие решения об активном действии (усилении либо принципиальном изменении терапии при ее недостаточной эффективности) следует осуществить не позже чем через 6 мес. Однако в случае ухудшения самочувствия пациента либо отсутствия признаков эффективности лечения решение по изменению лечения может бытъ принято раньше.
В случае достижения индивидуальных целей метаболического контроля или снижения уровня НЬА1С более чем на 1,0% от исходного за 6 мес наблюдения используемую ранее комбинированную терапию следует продолжить.
При отсутствии достижения индивидуальных целей гликемического контроля или при снижении уровня НЬА1С менее чем на 1% от исходного за 6 мес наблюдения, на втором этапе необходимо назначение комбинации 3 препаратов, одним из которых может быть инсулин.
В любой комбинации 3 препаратов рекомендуется использование метформина (при отсутствии противопоказаний).
Назначение нерациональных комбинаций недопустимо (см. Приложение 3. «Перечень нерациональных и/или неразрешенных к применению комбинаций сахароснижающих препаратов»),
3 ЭТАП - ДАЛЬНЕЙШАЯ ИНТЕНСИФИКАЦИЯ ТЕРАПИИ (КОМБИНИРОВАННАЯ ИНСУЛИНО- ТЕРАПИЯ)
Решение о дальнейшей интенсификации терапии должно быть принято не позднее, чем через 6 мес после 2-го этапа (контроль НЬА1С при этом рекомендуется проводить 1 раз в 3 мес).
В случае достижения индивидуальных целей гликемического контроля применявшуюся ранее комбинацию 3 сахароснижающих препаратов следует продолжить.
Если комбинированная терапия оказалась недостаточно эффективной, даже при использовании 3 препаратов, то рекомендуется инициировать или интенсифицировать инсулинотерапию.
Основные принципы назначения инсулинотерапии на данном этапе — см. в разделе «Инициация и интенсификация инсулинотерапии».
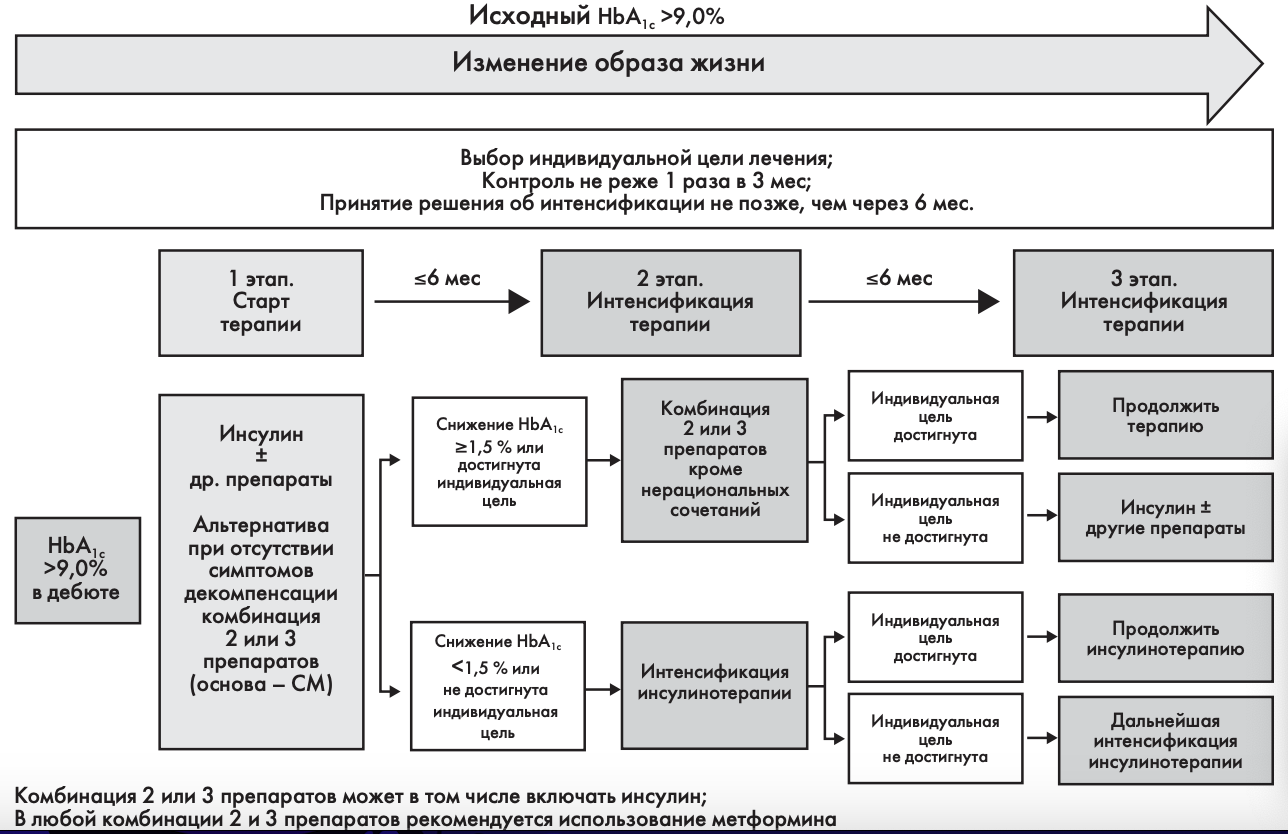
Выбор терапевтической тактики при исходном уровне НЬА1с>9,0%
На рис. 3 представлена схема выбора стартовой сахароснижающей терапии (1 этап) и ее интенсификация (2 и 3 этапы) при исходном уровне НЬА1С>9%.
1 ЭТАП - СТАРТ ТЕРАПИИ
На старте лечения необходимо определить индивидуальное целевое значение НЬА1С.
Исходный уровень НЬА1С>9% в «дебюте» заболевания как правило подразумевает необходимость срочного устранения глюкозотоксичности (т.е. токсичного воздействия глюкозы на органы и ткани, в том числе на ß-клетки поджелудочной железы). Такое интенсивное снижение гликемии возможно только при назначении инсулинотерапии (или комбинации инсулина с другими сахароснижающими препаратами).
Режимы назначения инсулина могут быть различными (см. раздел «Инициация и интенсификация инсулинотерапии») .
Эта инсулинотерапия может носить временный характер. Если в течение короткого времени удается устранить токсическое воздействие глюкозы на поджелудочную железу, то ß-клетки вновь начинают секретировать инсулин в достаточных количествах.
В редких случаях, когда в «дебюте» заболевания определяется уровень НЬА1С более 9%, но при этом отсутствуют выраженные клинические симптомы декомпенсации (прогрессирующая потеря массы тела, жажда,
Сахарный диабет. 2015:(1):5-23 полиурия), то можно начать лечение с альтернативного варианта — комбинации 2 или 3 сахароснижающих препаратов.
В случае ограниченных материальных ресурсов основой такой комбинации должны стать препараты СМ, как средства с максимальной инсулинсекреторной способностью. Новый класс сахароснижающих препаратов иНГЛТ-2, имеющий инсулин-независимый механизм действия, может способствовать значимому снижению НЬА1С в данной клинической ситуации.
В дальнейшем, при достижении целей терапии в течение 6 мес комбинированную терапию можно продолжить. Но в случае отсутствия эффекта обязателен переход на инсулинотерапию.
2 И 3 ЭТАПЫ - ИНТЕНСИФИКАЦИЯ ТЕРАПИИ
Если в течение 6 мес инсулинотерапии достигнуты индивидуальные цели гликемического контроля или уровень НЬА1С снизился более чем на 1,5%, то в этом случае возможен переход на комбинацию 2 или 3 сахароснижающих препаратов с отменой инсулинотерапии.
Если целевой уровень гликемии сохраняется и на протяжении последующих 6 мес наблюдения, то комбинированную терапию можно продолжить.
В любой комбинации 2 или 3 препаратов рекомендуется использование метформина (при отсутствии противопоказаний).
Назначение нерациональных комбинаций недопустимо (см. Приложение 3. «Перечень нерациональных и/или неразрешенных к применению комбинаций сахароснижающих препаратов»).
Если же за 6 мес. терапии цель не достигнута или уровень НЬА1С снизился менее чем на 1,5%, то терапию инсулином необходимо интенсифицировать.
Основные принципы назначения инсулинотерапии — см. в разделе «Инициация и интенсификация инсулинотерапии»
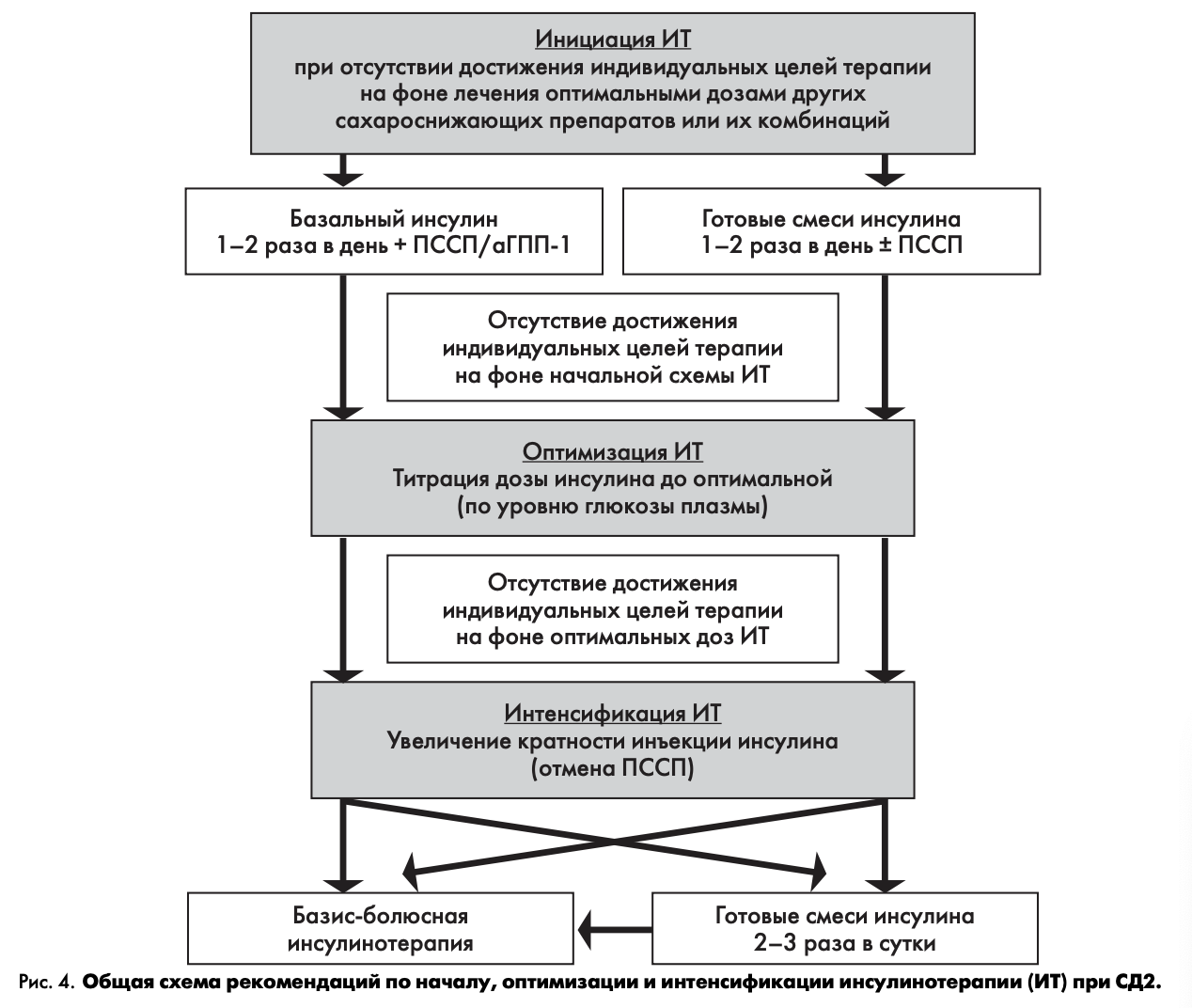
Инициация и интенсификация инсулинотерапии
Содержание данного раздела отражает основные положения клинических рекомендаций по оптимизации и интенсификации инсулинотерапии при СД2, дополненные с учетом появления различных видов аналогов инсулина [26].
Патогенез СД2, характеризующегося в том числе неуклонным снижением функции ß-клетки, указывает на большую вероятность возникновения необходимости инсулинотерапии с течением времени, особенно с учетом тенденции к более раннему возрасту дебюта заболевания и увеличению продолжительности жизни.
С момента установления диагноза больные СД2 должны быть осведомлены о возможном назначении инсулина с учетом прогрессирующего течения заболевания.
Для преодоления существующих барьеров необходимо объяснять пациентам следующие ключевые моменты:
- инсулинотерапии с течением времени может понадобиться большинству пациентов с СД2;
- инсулинотерапии — это эффективный метод управления диабетом, а не показатель неудачного лечения или неблагоприятного течения заболевания;
- можно подобрать режим инсулинотерапии с учетом образа жизни пациента;
- субоптимальный гликемический контроль на фоне максимально переносимых доз пероральных сахароснижающих препаратов уже является поводом задуматься об инсулинотерапии;
- безопасность инсулинотерапии абсолютно доказана;
- современные инсулины позволяют подобрать оптимальную схему инсулинотерапии с учётом индивидуальных особенностей пациента.
Инициация инсулинотерапии при СД2 показана в следующих ситуациях:
- у лиц с впервые выявленным СД2 — при уровне НЬА1С>9 % и наличии выраженной клинической симптоматики декомпенсации;
- у лиц с анамнезом СД2 — при отсутствии достижения индивидуальных целей гликемического контроля на фоне лечения оптимальными дозами других сахароснижающих препаратов или их комбинаций;
- при наличии противопоказаний к назначению или непереносимости других сахароснижающих препаратов;
- при кетоацидозе;
- при необходимости оперативного вмешательства, острых интеркуррентных и обострениях хронических заболеваний, сопровождающихся декомпенсацией углеводного обмена (возможен временный перевод на инсулинотерапию).
Перед плановым переводом больного на инсулинотерапию НЕОБХОДИМО обучить пациента методам самоконтроля; предупредить о возможности гипогликемии, информировать о ее симптомах и методах устранения и профилактики; пересмотреть принципы питания.
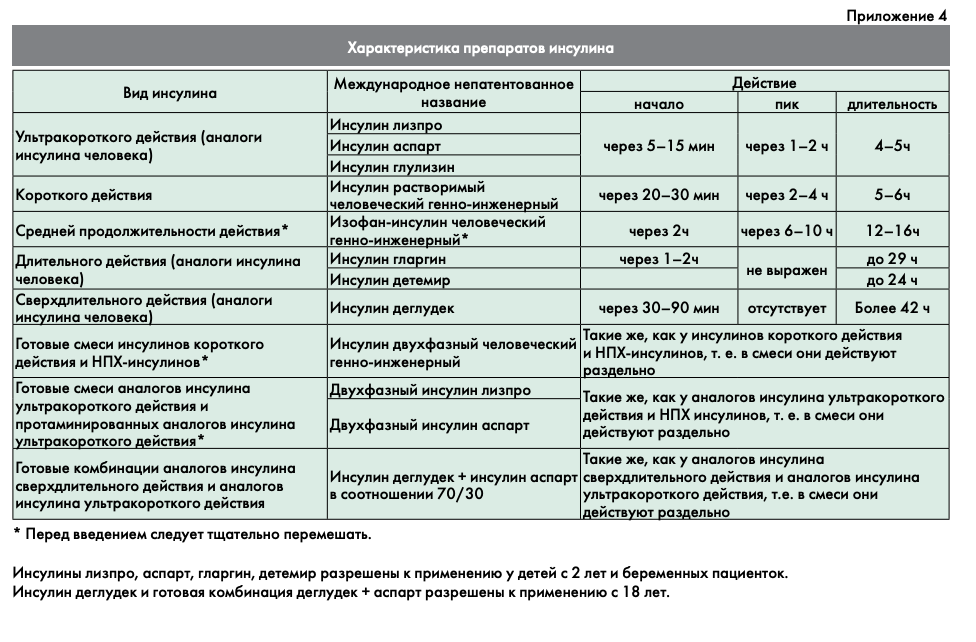
В настоящее время в Российской Федерации при лечении больных СД2 применяются только генно-инженерные человеческие инсулины и их аналоги (их основные характеристики перечислены в приложении 4):
- ультракороткого действия (аналоги инсулина человека);
- короткого действия;
- средней продолжительности действия;
- длительного действия (аналоги инсулина человека);
- сверхдлительного действия (аналоги инсулина человека);
- готовые смеси инсулинов короткого действия и НПХ-инсулинов;
- готовые смеси аналогов инсулина ультракороткого действия и протаминированных аналогов инсулина ультракороткого действия;
- готовые комбинации аналогов инсулина сверхдлительного действия и аналогов инсулина ультракороткого действия.
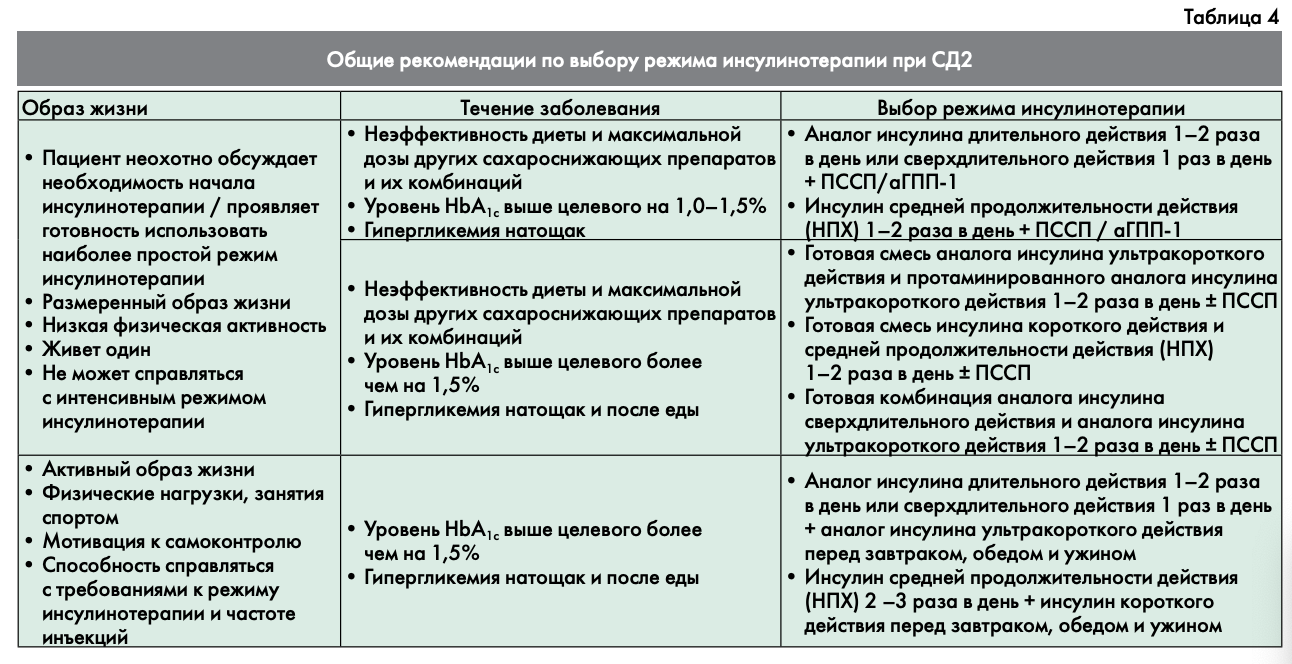
Выбор режима инсулинотерапии зависит от ряда факторов: образа жизни, режима питания, мотивации на проведение самоконтроля, физической активности, уровня НЬА1С и глюкозы плазмы натощак и после еды (табл. 4).
Показаниями для интенсификации инсулинотерапии при СД2 являются:
- отсутствие достижения индивидуальных целей терапии на предшествующем режиме инсулинотерапии в течение 3—6 мес.;
- дальнейшее титрование дозы в одной инъекции ограничено из-за большой однократной дозы (увеличение риска развития гипогликемии);
- режим питания предполагает необходимость интенсификации инсулинотерапии.
ВОЗМОЖНЫЕ ВАРИАНТЫ ИНТЕНСИФИКАЦИИ ИНСУЛИНОТЕРАПИИ ПРИ СД2
Интенсификация инсулинотерапии может быть осуществлена несколькими способами (общая схема рекомендаций по началу, оптимизации и интенсификации инсулинотерапии (ИТ) при СД2 представлена на рис. 4).
Базис-болюсный режим:
аналог инсулина длительного действия 1—2 раза в день или сверхд лительного действия 1 раз в день + аналог инсулина ультракороткого действия перед завтраком, обедом и ужином
или
инсулин средней продолжительности действия (НИХ) 2—3 раза в день + инсулин короткого действия перед завтраком, обедом и ужином.
Режим многократных инъекций готовых смесей инсулина:
готовая смесь аналога инсулина ультракороткого действия и протаминированного аналога инсулина ультракороткого действия перед завтраком, обедом и ужином
или
готовая смесь инсулина короткого действия и средней продолжительности действия (НПХ) перед завтраком, обедом и ужином.
Режим многократных инъекций перед едой:
аналог инсулина ультракороткого действия или
инсулин короткого действия перед завтраком, обедом и ужином.
ДОЗЫ ИНСУЛИНА
Дозы инсулина индивидуальны, увеличение проводится постепенно, до достижения индивидуальных целевых показателей углеводного обмена. Не существует ограничений в дозе инсулина.
Стартовая доза базального инсулина при инициации инсулинотерапии обычно составляет 10 ЕД или 0,1—0,2 ЕД/кг. Алгоритм титрации базального аналога инсулина прост и эффективен. Доза инсулина титруется каждые 3 дня, до достижения целевых значений НЬА1С. Титрация дозы осуществляется по среднему
Сахарный диабет. 2015;(1):5-23
уровню глюкозы плазмы натощак за 3 предшествующих дня. Шаг титрации зависит от исходного уровня гликемии и обычно в амбулаторных условиях составляет 1—2 ЕД (или около 10% от ранее вводившейся дозы).
Старт инсулинотерапии с двухфазного аналога инсулина возможен с одной инъекции (начальная доза 12 ЕД) непосредственно перед ужином или во время ужина с постепенным увеличением дозы до целевых значений глюкозы плазмы натощак или с двух инъекций перед ужином и завтраком по 6 ЕД с постепенной титрацией дозы по уровню глюкозы плазмы натощак/перед ужином. При использовании схемы с введением инсулина в виде 1 инъекции в случае неэффективности дозы 30 ЕД обычно требуется ее разделение на 2 инъекции (утром и вечером) с последующей титрацией, а при необходимости следует добавить 3-ю инъекцию (в обед).
Прандиальный инсулин обычно начинают с дозы 1 ЕД на 1 хлебную единицу. Для подбора дозы прандиального инсулина недостаточно контролировать только уровень НЬА1С и глюкозы плазмы натощак. Необходимо мониторировать уровень постпрандиальной гликемии. Титрация дозы прандиального инсулина обычно проводится 1 раз в 3 дня в амбулаторных условиях или ежедневно в стационаре (до достижения целевых значений гликемии).
Схема инициации, оптимизации и интенсификации инсулинотерапии показана на рис. 4.
Предпочтительно применение современных инсулинов (аналогов инсулина), ассоциирующихся с меньшим риском гипогликемий, более физиологическим действием, меньшей вариабельностью действия, простотой титрации, а значит — большей эффективностью в сравнении с человеческими инсулинами.
Достижение целевых значений гликемического контроля для предупреждения развития осложнений и улучшения качества жизни пациентов определяет активную тактику ведения больных с подбором адекватных доз, проведением самоконтроля гликемии и мониторингом НЬА1С.
Следует отметить необходимость активного привлечения самих больных в процесс управления СД посредством их обучения. Тесный контакт между врачом и пациентом, понимание целей и путей их достижения существенно улучшают результаты лечения.
Заключение
Настоящее обновление Консенсуса РАЭ по инициации и интенсификации сахароснижающей терапии у больных СД2 сохраняет приоритет индивидуального подхода к каждому пациенту, эффективность и безопасность проводимого лечения в качестве основополагающих принципов при выборе тактики лечения.
Определение индивидуальных целей терапии с учетом возраста, наличия осложнений, риска гипогликемий и стратификация терапевтической тактики в зависимости от исходного уровня метаболического контроля являются необходимыми условиями для обеспечения персонализированного подхода к лечению.
Данные базовые рекомендации по лечению больных СД2 созданы с учетом всех зарегистрированных в данный момент в Российской Федерации сахароснижающих препаратов, отражают современные представления по безопасности этих средств и могут потребовать пересмотра по истечении определенного временного промежутка и накопления новых объемов научной информации либо возникновения необходимости определения места новых лекарственных средств в терапевтических схемах.


Список литературы
1. Дедов И.И., Шестакова М.В., Галстян Г.Р., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под редакцией И.И. Дедова, М.В. Шестаковой (7-й выпуск). // Сахарный диабет. - 2015. - Т.18. - №1S. - С. 1-112. [Dedov II, Shestakova MV, Galstyan GR, et al. Standards of specialized diabetes care. Edited by Dedov I.I., Shestakova M.V. (7th edition). Diabetes mellitus. 2015;18(1S):1-112.] https://doi.org/10.14341/DM20151S1-112
2. Дедов И.И., Шестакова М.В., Аметов А.С., и др. Консенсус совета экспертов Российской ассоциации эндокринологов по инициации и интенсификации сахароснижающей терапии у больных сахарным диабетом 2 типа. // Сахарный диабет. - 2011. - №4. - С. 6-17. [Dedov II, Shestakova MV, Ametov AS, et al. Russian Association of Endocrinologists expert consensus document on initiation and intensification of antyhyperglycaemic therapy in type 2 diabetes mellitus. Diabetes mellitus. 2011;14(4):6-17.] https://doi.org/10.14341/2072-0351-5810
3. Rodbard HW, Jellinger PS, Davidson JA, et al. Statement by an American Association of Clinical Endocrinologists/American College of Endocrinology consensus panel on type 2 diabetes mellitus: an algorithm for glycemic control. Endocrine practice. 2009;15(6):540-559. https://doi.org/10.4158/EP.15.6.540
4. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycaemia in type 2 diabetes, 2015: a patient-centred approach. Update to a Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia. 2015;58(3):429-442. https://doi.org/10.1007/s00125-014-3460-0
5. Action to Control Cardiovascular Risk in Diabetes Study Group; Gerstein HC, Miller ME, et al. Effects of intensive glucose lowering in type 2 diabetes. The New England journal of medicine. 2008;358(24):2545-2559. https://doi.org/10.1056/NEJMoa0802743
6. Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. The New England journal of medicine. 2009;360(2):129-139. https://doi.org/10.1056/NEJMoa0808431
7. Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ. 2000;321(7258):405-412.
8. Group AC, Patel A, MacMahon S, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. The New England journal of medicine. 2008;358(24):2560-2572. https://doi.org/10.1056/NEJMoa0802987
9. Дедов И.И., Шестакова М.В., Александров А.А., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под редакцией И.И. Дедова, М.В. Шестаковой (6-й выпуск). // Сахарный диабет. - 2013. - №1(приложение 1). - С. 1-120. [Dedov II, Shestakova MV, Aleksandrov AA, Galstyan GR, Grigoryan OR, Esayan RM, et al. Standards of specialized diabetes care. Edited by Dedov II, Shestakova MV (6th edition). Diabetes mellitus. 2013;16(1S):1-120.] https://doi.org/10.14341/DM20131S1-121
10. Lipska KJ, Bailey CJ, Inzucchi SE. Use of Metformin in the Setting of Mild-to-Moderate Renal Insufficiency. Diabetes care. 2011;34(6):1431-1437. https://doi.org/10.2337/dc10-2361
11. Pospisilik JA, Martin J, Doty T, et al. Dipeptidyl peptidase IV inhibitor treatment stimulates beta-cell survival and islet neogenesis in streptozotocin-induced diabetic rats. Diabetes. 2003;52(3):741-750.
12. Mu J, Woods J, Zhou YP, et al. Chronic inhibition of dipeptidyl peptidase-4 with a sitagliptin analog preserves pancreatic beta-cell mass and function in a rodent model of type 2 diabetes. Diabetes. 2006;55(6):1695-1704. https://doi.org/10.2337/db05-1602
13. Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. The New England journal of medicine. 2013;369(14):1317-1326. https://doi.org/10.1056/NEJMoa1307684
14. White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. The New England journal of medicine. 2013;369(14):1327-1335. https://doi.org/10.1056/NEJMoa1305889
15. Ussher JR, Drucker DJ. Cardiovascular biology of the incretin system. Endocrine reviews. 2012;33(2):187-215. https://doi.org/10.1210/er.2011-1052
16. Egan AG, Blind E, Dunder K, et al. Pancreatic safety of incretin-based drugs--FDA and EMA assessent. The New England journal of medicine. 2014;370(9):794-797. https://doi.org/10.1056/NEJMp1314078
17. Sturis J, Gotfredsen CF, Romer J, et al. GLP-1 derivative liraglutide in rats with beta-cell deficiencies: influence of metabolic state on beta-cell mass dynamics. British journal of pharmacology. 2003;140(1):123-132. https://doi.org/10.1038/sj.bjp.0705397
18. Xu G, Stoffers DA, Habener JF, Bonner-Weir S. Exendin-4 stimulates both beta-cell replication and neogenesis, resulting in increased beta-cell mass and improved glucose tolerance in diabetic rats. Diabetes. 1999;48(12):2270-2276. https://doi.org/10.2337/diabetes.48.12.2270
19. Gangji AS, Cukierman T, Gerstein HC, et al. A systematic review and meta-analysis of hypoglycemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin. Diabetes care. 2007;30(2):389-394. https://doi.org/10.2337/dc06-1789
20. U.S. Food and Drug Administration. FDA News Release (25-nov-2013): FDA requires removal of certain restrictions on the diabetes drug Avandia. Available from: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm376516.htm
21. Levin D, Bell S, Sund R, et al. Pioglitazone and bladder cancer risk: a multipopulation pooled, cumulative exposure analysis. Diabetologia. 2015;58(3):493-504. https://doi.org/10.1007/s00125-014-3456-9
22. Nauck MA. Update on developments with SGLT2 inhibitors in the management of type 2 diabetes. Drug design, development and therapy. 2014;8:1335-1380. https://doi.org/10.2147/DDDT.S50773
23. American Diabetes Asosiation. Approaches to Glycemic Treatment. Diabetes care. 2015;38(Supplement 1):S41-S48. https://doi.org/10.2337/dc15-S010
24. Rosenstock J, Jelaska A, Frappin G, et al. Improved Glucose Control With Weight Loss, Lower Insulin Doses, and No Increased Hypoglycemia With Empagliflozin Added to Titrated Multiple Daily Injections of Insulin in Obese Inadequately Controlled Type 2 Diabetes. Diabetes care. 2014;37(7):1815-1823. https://doi.org/10.2337/dc13-3055
25. Inzucchi SE, Zinman B, Wanner C, et al. SGLT-2 inhibitors and cardiovascular risk: Proposed pathwys and review of ongoing outcome trials. Diabetes & vascular disease research. 2015;12(2):90-100. https://doi.org/10.1177/1479164114559852
26. Дедов И.И., Шестакова М.В., Абусуев С.А., и др. Оптимизация и интенсификация инсулинотерапии при сахарном диабете 2 типа (клинические рекомендации). // Сахарный диабет. - 2010. - №5. - С. 9-16. [Dedov II, Shestakova MV, Abusuev SA, Valeeva FV, Verbovoy AF, Galstyan GR, et al. Optimizatsiya i intensifikatsiya insulinoterapii pri sakharnom diabete 2 tipa (klinicheskie rekomendatsii). Diabetes mellitus. 2010;13(5):9-16.] https://doi.org/10.14341/2072-0351-6049