Инновационные технологии в лечении и профилактике сахарного диабета и его осложнений


Published: March 1, 2013
Latest article update: Nov. 23, 2022
Abstract
В ряду пандемий хронических заболеваний особое место занял сахарный диабет (СД), демонстрирующий стремительную распространенность. Сложная природа СД предполагает дальнейшее погружение в ее изучение и поиск средств своевременного воздействия. Бурное развитие биомедицинской науки уже сейчас делает возможным внедрение фантастических инноваций в способах лечения, методах диагностики и профилактики заболевания.
Keywords
Сахарный диабет, молекулярно-генетический анализ, инновационные технологии
В ряду пандемий хронических заболеваний особое место занял сахарный диабет (СД), демонстрирующий стремительную распространенность. За три последних года еще 86 млн пополнили ряды больных диабетом. Сегодня это 371 млн больных, а к 2025 году ожидается 552 млн. [1] Данные за 2012 год весьма драматичны: более 50% больных не знают о своем заболевании, умерли 4,8 млн больных СД, затраты достигли 471 млрд долларов США. Диабет не только причиняет боль и страдания миллионам больных, но и ложится тяжелым финансовым бременем на их семьи и на систему здравоохранения государств в целом.
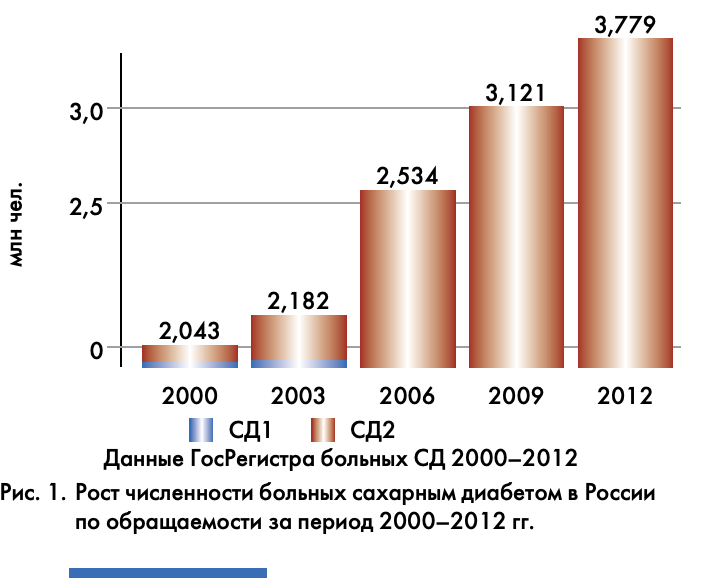
Распространенность СД в Российской Федерации тоже продолжает расти, прежде всего за счет больных СД 2 типа (СД2) (рис. 1). Сегодня, по данным ГосРегистра, мы имеем 325 743 больных СД 1 типа (СД1), в том числе почти 20 000 детей и более 9000 подростков (рис. 2). Численность больных СД2 достигла 3 452 954 человек, и среди них 394 детей и 332 подростка [2]! А ведь только недавно это были единичные случаи заболеваемости СД2 в таком юном возрасте. И как не вспомнить мудрые слова Василия Гавриловича Баранова, что деление СД на 1 и 2 тип по возрасту может быть только условно.

Однако фактическая распространенность СД, по данным серьезных исследований, в 3–4 раза выше. Это показали Национальный проект «Здоровье» и Общероссийский проект «Диабет – узнай вовремя». Эксперты ВОЗ предположительно насчитывают в России порядка 12 млн больных СД и включают нашу страну в число 10 стран мира с их наибольшей численностью. Когда сегодня стоит вопрос о всеобщей диспансеризации, нам надо ориентироваться именно на эти цифры. Необходимо помнить и о том, что у больных СД2, составляющих основную массу, уже при диагностике заболевания в 40% случаев имеются осложнения. Все это требует серьезных кадровых и финансовых ресурсов, нового программного обеспечения для формирования регистра, реального планирования расходов на лекарственные средства.
Каковы же сегодня расходы на лечение 1 больного в России? По данным IDF – 650 долларов США в год. Несмотря на то, что это заниженные цифры, мы отстаем от США, Японии и стран Западной Европы. Впечатляет опыт Финляндии, где затраты на 1 больного в 2012 году составили почти 5000 долларов США. Это страна с высокой заболеваемостью СД1, требующей энергичных иммуногенетических исследований с большими финансовыми вложениями, направленными на индивидуальную профилактику.
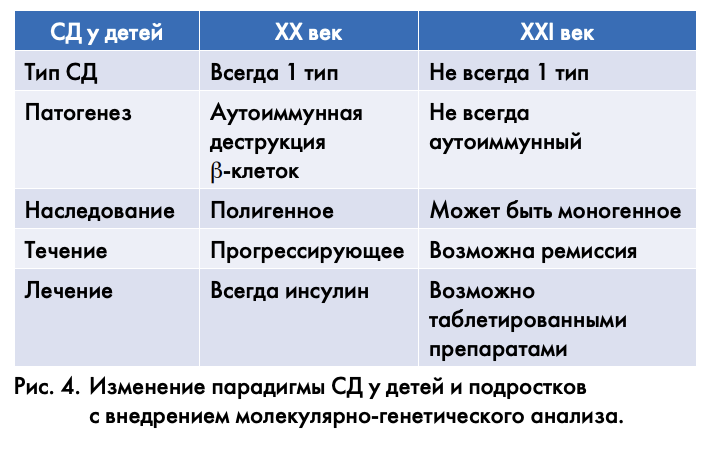
Действительно, 21 век – это время молекулярно-генетического анализа в диагностике СД с последующим персонифицированным, индивидуальным подходом в лечении. Стало очевидным, что СД в детском и подростковом возрасте не ограничивается аутоиммунным 1 типом. Все чаще у них удается идентифицировать диабет 2 типа, MODY тип (более 10 подтипов), а также более редкие синдромальные формы диабета. Истинная распространенность «диабета не 1 типа», предположительно, может достигать 10%. Развитие молекулярной биологии в наш век открывает широкие возможности для определения различных симптомокомплексов в нозологически самостоятельные формы. Важность диагностики этих синдромов для детей – грамотная идентификация и лечение составляющих синдрома проявлений, а для родителей – возможность медико-генетической консультации и соответствующих рекомендаций.
Неонатальный СД – редкое гетерогенное заболевание, дебютирующее в первые 6 мес жизни с выделением двух клинических групп: транзиторный неонатальный СД и перманентный неонатальный СД [3]. Кроме того, определены клинические синдромы, связанные с перманентным неонатальным СД: IPEX синдром (диффузные нарушения аутоиммунитета), митохондриальные заболевания, тяжелая гипоплазия поджелудочной железы, связанная с IPF1 (PDX1)‑мутацией, гомозиготная мутация глюкокиназы, синдром Уолкотт-Роллисона (сочетающийся с гипофизарной недостаточностью) и др. Для большинства больных с неонатальным СД молекулярная этиология в настоящее время может быть определена. Выявлено более 10 генов, ответственных за развитие заболевания, из которых наибольшее практическое значение имеют активирующая мутация в KCNJ11 и ABCC8 (рецептор к сульфонилмочевине-1 – SUR1). До 80% детей с неонатальным СД, вызванным мутацией в KCNJ11, могут быть переведены с инсулина на сульфонилмочевинные препараты с улучшением гликемического контроля, независимо от длительности заболевания. Вот почему необходимо генетическое тестирование всех детей с манифестацией диабета до 6-месячного возраста. В перспективе реален тот момент, когда дети с нарушениями углеводного обмена будут проходить такой же тотальный скрининг, какой сегодня проходят на адреногенитальный синдром, врожденный гипотиреоз. Это и другие перспективы, и другой прогноз!
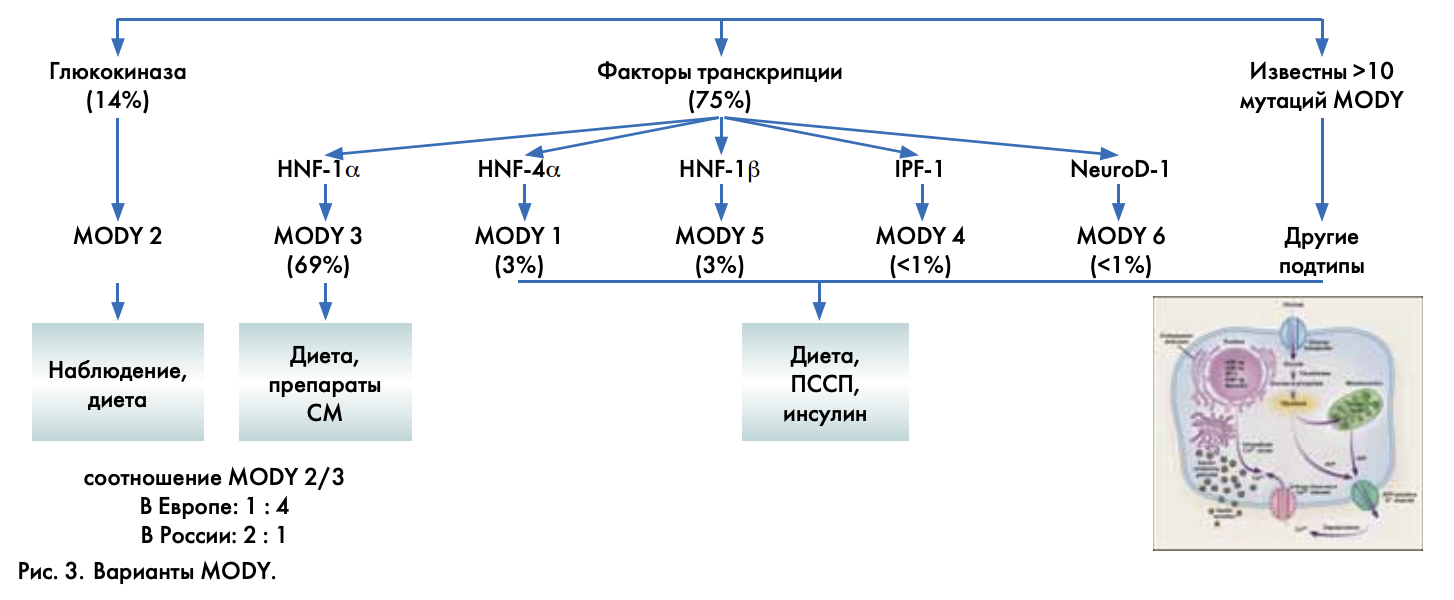
Вопрос гетерогенности MODY в большей степени был решен с прояснением генетической основы заболевания [4]. Первый ген MODY (мутация гена глюкокиназы) был идентифицирован в 1992 году. К настоящему времени известно более 10 генов, мутации которых приводят к развитию MODY (рис. 3). У 15% пациентов с MODY мутации не идентифицированы и отнесены к MODY-Х. Большинство генов кодирует глюкокиназу, катализирующую фосфорилирование глюкозы, 5 факторов транскрипции, инициирующих продукцию белков, необходимых для развития поджелудочной железы. Каждый генотип производит уникальный фенотип. В странах Европы (Великобритания, Норвегия, Германия) и в ряде азиатских стран до 60% всех случаев MODY составляет MODY-3 (мутация ядерного фактора гепатоцитов HNF-1α). В России, как в Италии и Франции, наибольшую распространенность имеют мутации в гене глюкокиназы (MODY-2). Обычно у детей с MODY-2 наблюдается хорошая компенсация углеводного обмена при соблюдении диеты и соответствующем наблюдении. Дети с MODY-3 особенно чувствительны к сульфонилмочевинным препаратам. При других генных мутациях ухудшение функции β-клеток прогрессирует быстрее, что может потребовать лечение инсулином. Сейчас нам необходимо набирать статистику, входить в Еврорегистр, обмениваться данными с учетом нашей высокой этнической разнородности.
Особого внимания заслуживает синдром Вольфрама (DIDMOAD-синдром) – редкий аутосомно-рецессивный синдром, ассоциированный с инсулинзависимым СД, прогрессирующей атрофией зрительного нерва и нейросенсорной тугоухостью, несахарным диабетом, дисфункцией автономной нервной системы, мозжечковой атаксией, атрофией ствола мозга. Развитие синдрома – следствие инактивирующей мутации в гене WES1, продуктом экспрессии которого является трансмембранный транспортный белок Wolframin в эндоплазматическом ретикулуме. Белок играет важную роль в регуляции внутриклеточного кальциевого обмена в клетках поджелудочной железы и лимбической системы, что и определяет симптомокомплекс синдрома. Трудно поверить нам – клиницистам в то, что мутация одного гена ведет к генерализованному процессу, к поражению ключевых органов и систем. Необходимо намного шире и глубже рассматривать такую вроде бы установившуюся клиническую картину заболевания. А для этого мы закладываем солидные «площадки» для геномных исследований моногенных заболеваний и, как и во всех странах, создаем биобанки, чтобы потом в дальнейшем вернуться вновь к этим вопросам и подвергнуть анализу на основе новых технологий.
Итак, меняется парадигма СД у детей и подростков с внедрением молекулярно-генетического анализа (рис. 4). Считалось, что у детей СД – всегда 1 тип, патогенез – аутоиммунный, наследование – полигенное, течение – прогрессирующее, лечение – всегда инсулин. А мы с вами перешагнули из 20-го в 21-й век, и оказывается, что диабет может быть неиммунным, может быть моногенным, и возможна ремиссия, и возможно, конечно, лечение таблетированными препаратами. Мы обращаем на это особое внимание, потому что будем создавать в регионах как минимум 7 «площадок» солидных геномных исследований (пока у детей) для идентификации генов, мутации в которых приводят к развитию неиммунных форм СД с разработкой соответствующих специфических методов терапии.
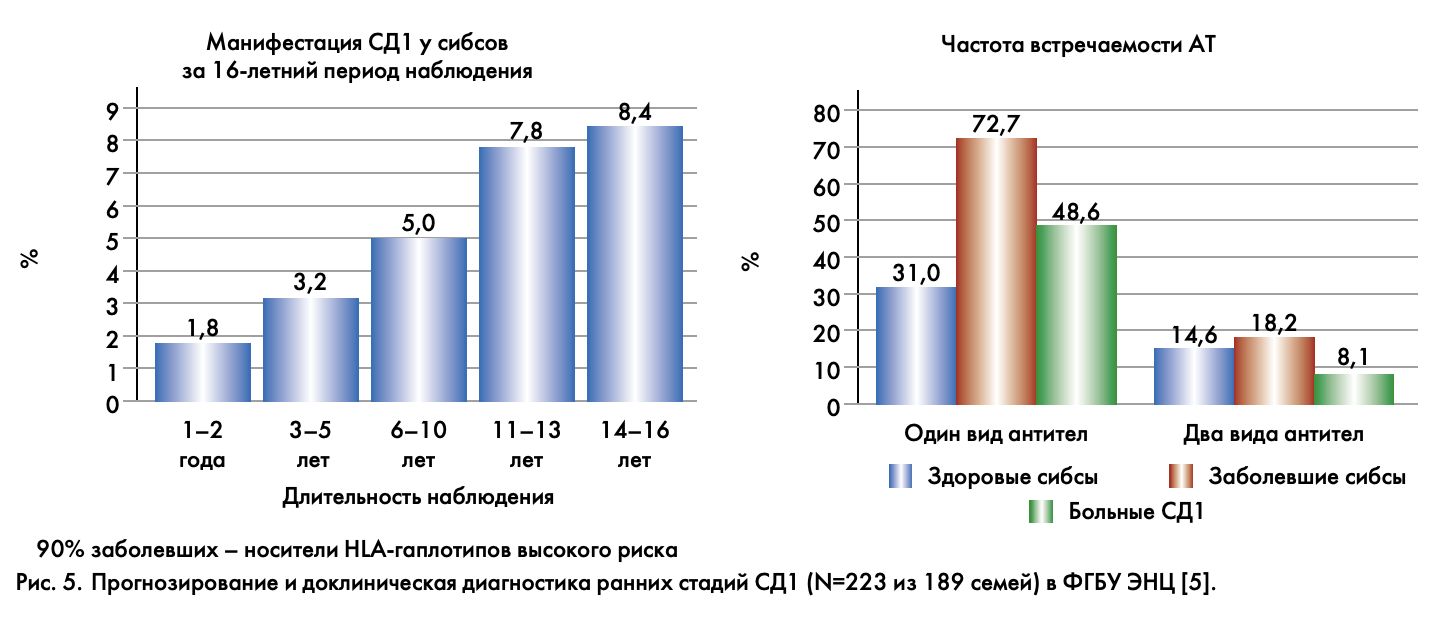
Прогнозирование СД – первый этап разработки профилактических мероприятий, наиболее эффективных на ранних доклинических стадиях. Большинство случаев СД1 развивается спорадически без отягощенного семейного анамнеза. Риск развития СД1 в популяции составляет 0,2–0,4%. Максимальный риск имеют родственники первой степени родства больных СД1: братья, сестры, дети, родители. В среднем он составляет 5%. Риск заболевания зависит от количества больных и здоровых родственников, возраста манифестации диабета у членов семьи, возраста обследуемого. При наличии предрасполагающих HLA-гаплотипов риск развития СД1 составляет 18–50%. На основе молекулярно-генетических исследований, проведенных в ФГБУ Эндокринологический научный центр (ЭНЦ), выделены предрасполагающие и протективные гаплотипы в отношении развития СД1 и рассчитаны относительные риски в зависимости от носительства того или иного гаплотипа в российской популяции. Для диагностики ранней доклинической фазы важно иммунологическое обследование. При появлении положительных аутоантител (ICA, IAA, GAD, IA-2A) риск развития СД1 повышается до 40–70% (рис. 5). При развитии сниженной инсулиновой секреции риск развития заболевания составляет 70–90% в течение 10-летнего периода наблюдения. Мы много лет наблюдаем «ядерные» семьи и, естественно, можем говорить, что сегодня есть возможности снизить и даже нивелировать риски. Первые 2 года – это всего 1,8%, т.е. ниже, чем риск предсказанный, но по мере взросления риски возрастают. Вот это надо понимать и, конечно, организовать мониторинг таких детей – это настоящая индивидуальная работа с семьей, и тогда можно получить результат – отсрочить и нивелировать риски.
Мы разработали и неоднократно издавали программы прогнозирования рисков развития СД1. Они, конечно, меняются. Мы их критично оцениваем. Когда-то мы были увлечены, но сегодня больше информации, все это оказалось сложнее, чем нам представлялось. Тем не менее, мы продолжаем работать совместно с Институтом иммунологии и Центром генетики. Призываем наших коллег из регионов к совместным исследованиям.
Цели профилактики: предотвратить развитие аутоиммунной реакции против β-клеток у лиц с высоким генетическим риском СД1; замедлить или блокировать уже начавшуюся аутоиммунную реакцию. Первичная профилактика при наличии HLA-рисков – исключение коровьего молока у детей до 6–8 месяцев, борьба за грудное вскармливание, исключение глютена у детей до 1 года, интраназальный, пероральный инсулин у детей 1,5–7 лет, омега 3 ПНЖК для беременных и детей до 6 месяцев, витамин D для новорожденных.
Вторичная профилактика при наличии аутоантител – ведутся исследования по эффективности применения перорального и интраназального инсулина.
Исследования по третичной профилактике при впервые выявленном СД1 – вакцинация GAD, DiaPep 277, «IBC-VS01»; иммуномодуляторы Анти-CD3, Анти- CD20 (Ритуксимаб), антагонист рецептора IL-1 (Анакинра), ингибитор TNF-α, антимоноцитарный глобулин; комбинированная терапия Анти-CD3+назальный/оральный инсулин, Анти- CD3+Эксенатид, Эксенатид+Даклизумаб.
В лабораториях мира идет энергичный поиск. В настоящее время еще не разработаны такие специфические профилактические средства, которые могли бы быть рекомендованы для широкого внедрения в практику. В перспективе – клеточные технологии, тем более, что именно диабетологи первыми ставили вопрос о воссоздании массы β-клеток или поджелудочной железы.
Важнейший вопрос современной диабетологии – прогнозирование риска развития СД2. Генетическая детерминированность подтверждается семейной агрегацией СД2 и исследованиями на гибридных популяциях с очень высокой частотой заболевания. Наиболее оправдан поиск генетических маркеров, определяющих основные патогенетические механизмы развития СД2: инсулинорезистентность и секрецию инсулина. В ФГБУ ЭНЦ совместно с ФГУП «ГосНИИ Генетика» проводился поиск полиморфных маркеров указанных генов-кандидатов и их связи с риском развития СД2. Удалось выявить несколько генов-кандидатов, полиморфизм которых был значимо сцеплен с риском развития заболевания. Согласно полученным данным, предрасполагающим или протективным эффектом обладали гены-кандидаты, регулирующие синтез и секрецию инсулина, а не гены, определяющие инсулинорезистентность.
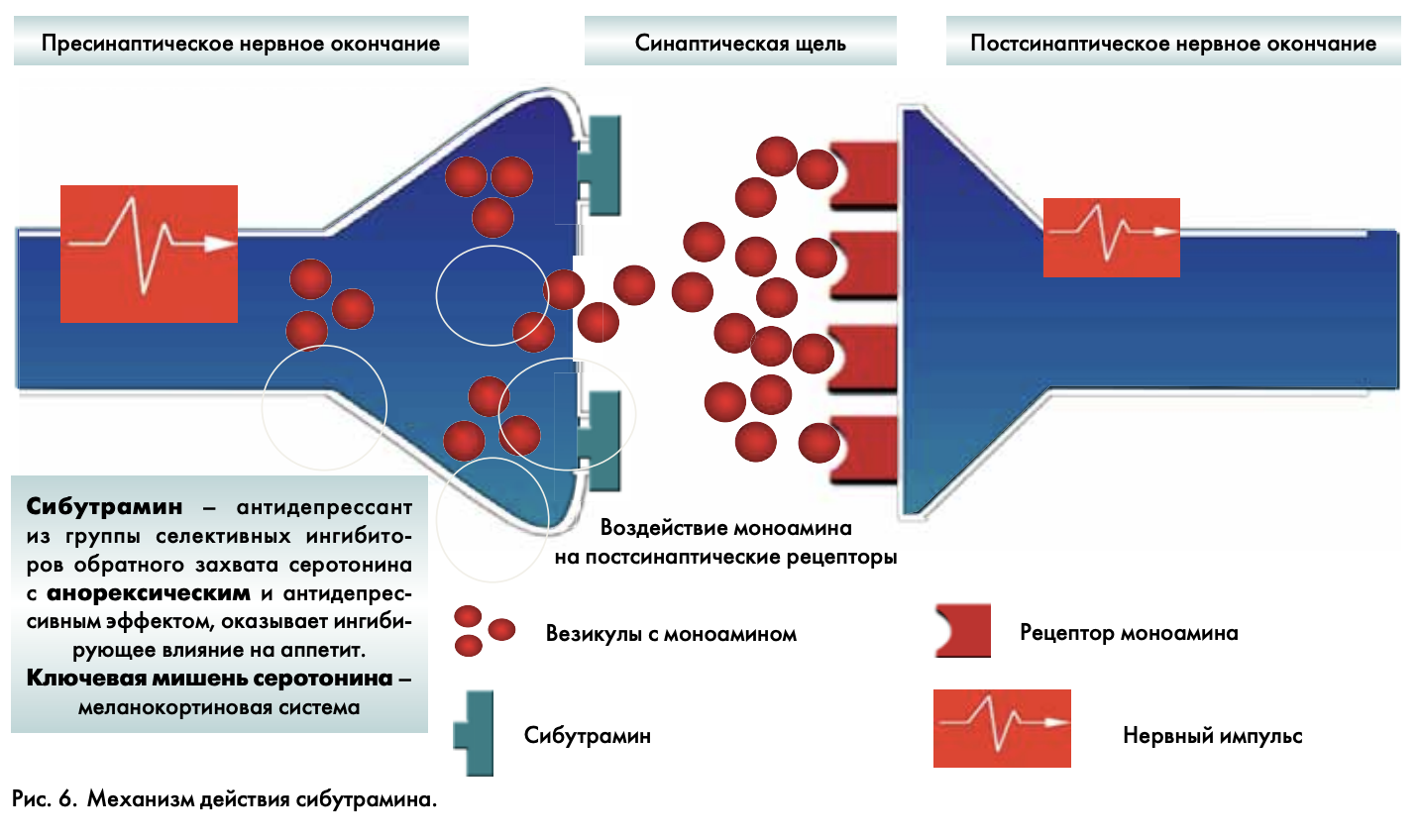
Генетические или эволюционные факторы могут присутствовать у любого человека, однако реализация этих факторов в болезнь происходит только при воздействии внешних факторов – калорийного питания, низкой физической активности и др., ведущих к развитию ожирения. Ожирение – прелюдия всех этих метаболических процессов. В мире стремительно растет число людей с избыточным весом. К сожалению, в России тоже число людей с излишней массой тела нарастает. Жировая ткань – удивительная, просто фантастическая ткань, к которой мы как-то небрежно относимся, а без нее невозможна реализация генотипа в фенотип. Сегодня известно, что жировая ткань бывает как минимум трех вариантов: белая, бурая и бежевая. В онтогенезе человека 2 периода, когда закладывается жировая ткань. Это эмбриогенез и пубертат. В другие периоды жизни человека размножение клеток-предшественников не происходит. Накопление жира происходит только путем увеличения размеров жировых клеток. Жировая ткань – это практически неограниченный спектр гормонов, цитокинов и, безусловно, рецепторов. Практически все жизненно важные клеточные и тканевые факторы, через которые реализуются регуляторные сигналы нервной, эндокринной и иммунной систем, жировая ткань несет в себе. Причины нарушения пищевого поведения – это нарушение функциональных регулирующих систем. Их очень и очень много. Мы должны с вами управлять жировой тканью, а не бороться с ней. Пока у нас есть единственный препарат, модулирующий пищевое поведение – сибутрамин – ингибитор обратного захвата серотонина и норадреналина (рис. 6). Как сегодня борются с жировой тканью, конечно, это недопустимо – зверски уродуя свой организм, корректируя с помощью скальпеля и «пылесоса» свой фенотип.
Эпидемические масштабы распространенности СД2 требуют колоссальных расходов на лечение, включая осложнения. Это делает проблему профилактики СД2 приоритетной задачей здоровья общества. Проведенные проспективные контролируемые исследования по эффективности изменения образа жизни в профилактике СД2 (DPP, DPS, Da Qing) дали впечатляющие результаты. Эффективность и безопасность немедикаментозных способов профилактики СД2 не вызывают сомнений и требуют более широкого внедрения не только в группах высокого риска, но и в рамках популяционных мероприятий. Однако, к сожалению, приходится констатировать, что этот способ профилактики характеризуется крайне низкой степенью приверженности к лечению. Поэтому так важно обучение и поддержание мотивации.
Медикаментозная профилактика СД2 (метформин, глитазоны, ингибиторы альфа-глюкозидазы, орлистат) не может рекомендоваться столь однозначно. Возникают вопросы этичности лечения, возможности маскировки уже существующего диабета, соотношения риска/пользы с учетом побочных эффектов препаратов.
Что же мы с вами сегодня можем предложить нашим пациентам? Потрясающий арсенал лекарственных средств, отражающий развитие мировой диабетологии, поиска новых препаратов от первых инсулинов до аналогов и инкретинов. Когда мы 10 лет назад получили аналоги инсулина, это казалось фантастикой, открывающей новые перспективы проведения интенсифицированной инсулинотерапии. Мы участвовали во 2-й фазе исследований аналогов инсулинов и продолжаем дальнейший поиск в надежде придти к оптимальным лечебным средствам. Продолжается поиск в направлении сверхкороткого действия после введения инсулина. Но надо взвешенно оценить возможности природной контринсулиновой системы с позиций рисков гипогликемий.

Сейчас идет очень серьезная, фундаментальная работа по разработке интраназального и перорального инсулина. Это героические усилия ученых. Как найти такой транспортер, который бы мог «протащить» в кровь инсулин через альвеолы легких или слизистую и желудочно-кишечного тракта? Это непростая «история». Для всего живого на земле, и прежде всего высших позвоночных, включая человека, такой способ поступления инсулина исторически, эволюционно Природой не предусмотрен.
Ожидается завершение 3 фазы исследования сверхбыстрого ингаляционного инсулина по технологии Technosphere® на основе рекомбинантного человеческого инсулина, который может открыть новые перспективы терапии диабета.
Одновременно продолжаются исследования и инсулинов сверхдлительного и длительного действия, необходимость которых определяется неудовлетворенностью фармакокинетического профиля имеющихся препаратов и стремлением достичь постоянной концентрации инсулина плазмы, аналогичной физиологическому уровню (рис. 7). Но для нас очень важно учесть циркадные ритмы нашего организма и возможность отсроченных гипогликемических состояний.
Поиск оптимального лечения СД2, основанный на изучении принципиально нового механизма регуляции гомеостаза глюкозы, привел к созданию препаратов, основанных на действии инкретинов (гормонов желудочно-кишечного тракта). Популярность этих препаратов растет. Мы имеем впечатляющую линейку средств этой направленности, которая пополняется новыми комбинациями (рис. 8). Это уже не тренд, это уже бренд.
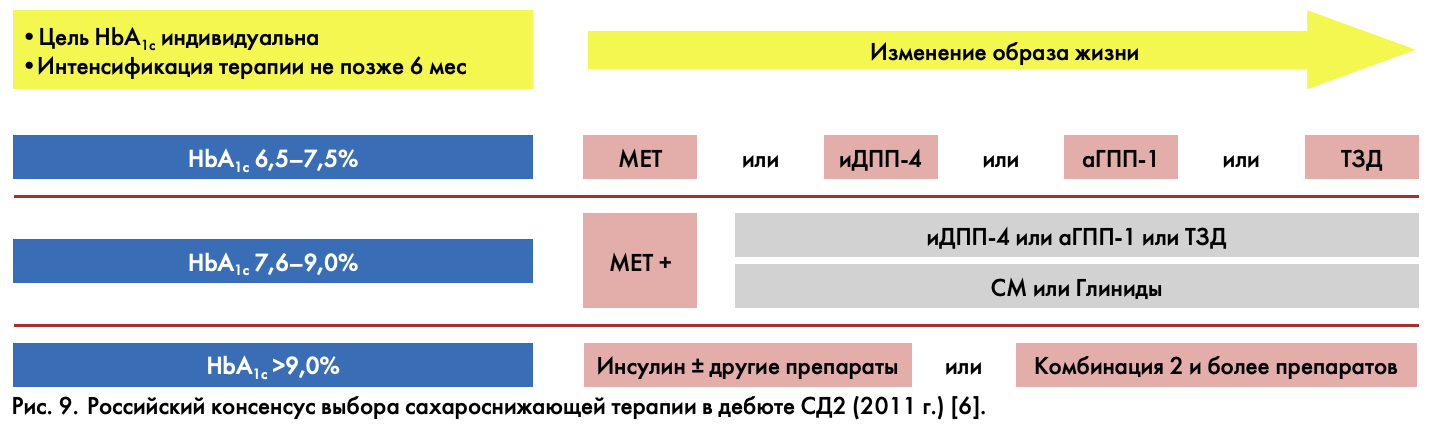
Каково же место инкретинов в лечении СД2? Международные рекомендации предлагают применять их на всех этапах развития болезни, начиная с дебюта болезни как монотерапию, либо в составе комбинированной терапии. Позиции ведущих эндокринологов России, оформленные в Российском консенсусе, также рассматривают инкретины в первом ряду медикаментозной терапии вместе с метформином, секретагогами, глитазонами. Но при этом – максимально индивидуальный подход к терапии на основе изменения образа жизни (рис. 9). Ведь мы лечим больного, а не болезнь по алгоритмам! Вспомним Майкла Бергера с его заявлением о «потере времени на таблетированные препараты» и призывом начинать лечить сразу инсулином. Конечно, это был вызов, чтобы привлечь внимание к запущенным больным с высоким уровнем гликированного гемоглобина, дебютирующим с осложнений. Наша отечественная школа нацеливает врачей на результат с творческим, персонифицированным подходом к каждому конкретному больному.
В ряду новых препаратов, активно разрабатываемых фармакотерапевтическими компаниями, – селективные ингибиторы канальцевой реабсорбции глюкозы (глифлозины). Применение этих препаратов связано со снижением массы тела при усилении глюкозурии, влиянием на натрийурез с последующим умеренным снижением артериального давления посредством влияния на ренин-ангиотензин-альдостероновую систему. Представляется сомнительным использование такого механизма с позиций физиологичности и высокого риска побочных эффектов. Это, прежде всего, высокая частота мочевой и генитальной инфекции, крайне опасных для больных диабетом.
Но мы ждем новых достижений в разработке препаратов для лечения СД.
И здесь, конечно, препараты, воздействующие на «бедную» β-клетку: агонисты ГПП‑1, активаторы глюкокиназы, агонисты рецепторов G-связанных белков (GPR 40(TAK875) – фазиглифам, GPR 119 – каннабиноидные рецепторы, GPR 120 – рецепторы СЖК.
Препараты, воздействующие на печень, как орган-мишень – антагонисты рецепторов глюкагона, ингибиторы гликоген-фосфорилазы, агонисты PPARα; желудочно-кишечный тракт – агонисты TGR 5 (рецепторов, активируемых желчными кислотами); жировую ткань – агонисты PPARα/γ; белки сиртуины – активаторы сиртуинов.
Этот перечень свидетельствует об очень сложной природе СД, предполагающей дальнейшее погружение в ее изучение и поиск средств своевременного воздействия.
Нам посчастливилось быть современниками фантастических инноваций в способах доставки инсулина в организм пациента. Современные помпы стали еще более компактными, многофункциональными и удобными; появились помпы без катетеров, помпы с функцией глюкометра, интегрированная система «помпа+монитор гликемии». В помпы последнего поколения заложены возможности самостоятельного реагирования на изменения концентрации глюкозы в крови и др. В обозримом будущем можно ожидать создания носимого индивидуального прибора, полностью выполняющего функцию поджелудочной железы и способного без участия пациента поддерживать идеальный уровень компенсации углеводного обмена.
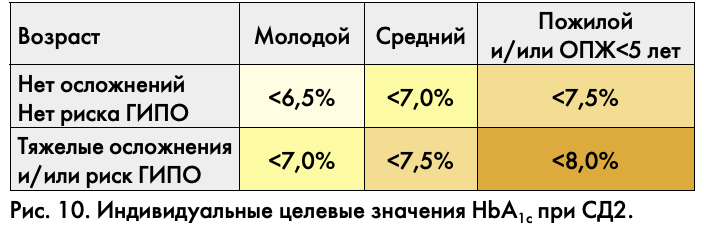
Несмотря на высокое качество используемых при лечении СД препаратов, разработку новых технологий его лечения, создания эффективной системы диабетологической службы, уровень инвалидизации и смертности больных существенно не снижается вследствие развития тяжелых сосудистых осложнений. Это фактор депопуляции наших пациентов. Гипергликемия запускает целый каскад биохимических преобразований, ведущих к повреждению сосудистой стенки. Поэтому основным принципом профилактики развития и прогрессирования любого сосудистого осложнения СД служит достижение и поддержание гликемии, близкой к нормальным значениям. Но насколько близкой? Согласно консенсусу совета экспертов Российской ассоциации эндокринологов, индивидуальный подход к больному и, соответственно, определение индивидуального целевого уровня гликированного гемоглобина должны учитывать возраст пациента, ожидаемую продолжительность жизни, наличие тяжелых осложнений, риск развития тяжелых гипогликемий (рис. 10). Это очень важный вопрос, поскольку убедительно доказано, что сердечно-сосудистые осложнения и смертельные исходы более часто встречаются у пациентов с гипогликемическими эпизодами (особенно тяжелыми). И тогда риски интенсивной сахароснижающей терапии, имеющей целью предупредить развитие сосудистых осложнений диабета, могут превысить ожидаемую пользу по мере увеличения длительности заболевания, возраста пациента, наличия уже имеющихся осложнений. Согласно данным наших коллег из США, основанным на большом количестве наблюдений (более 26 000), риск развития первого сердечно-сосудистого осложнения при длительном течении СД2 наименьший при уровне гликированного гемоглобина 7–8%. Представляется, что это наиболее комфортный диапазон, когда минимизированы риски гипосостояний и нет значительных гипергликемий.
Внедрение новых технологий в диагностике и лечении сосудистых осложнений идет очень бурно. И мы здесь не отстаем. Внутрисосудистое УЗИ, «виртуальная гистология», неинвазивная методика оценки немиелинизированных нервных волокон, оптическая когерентная томография, полная визуализация сосудов, гибридные сосудистые операции, додиализная трансплантация почек с последующей полной реабилитацией пациентов, современнейшие средства воздействия на медиаторы воспаления и фиброза – это только часть наших возможностей. Успех работы во многом будет определяться содружественностью усилий диабетологов, кардиологов, нефрологов, неврологов, офтальмологов и других специалистов.
Сейчас ведется очень много международных программ. Мы подписали и начали большой проект по эпидемиологии СД с нашими коллегами из Франции, скоро стартует проект по моногенным орфанным заболеваниям (Франция, ФРГ). Германская академия наук развивает направления обучения и международного обмена. Планируем создать совместный с Германией новый реабилитационный центр в Подмосковье и центр клеточных технологий.
Общими усилиями вполне возможно реализовать наш оптимистический девиз «Сахарный диабет – это не болезнь, а особый образ жизни!»
СПИСОК ЛИТЕРАТУРЫ
- IDF Diabetes Atlas 5th edition. 2012. Available from: http://www.diabetesatlas.org
- Маслова ОВ, Сунцов ЮИ. Эпидемиология сахарного диабета и микрососудистых осложнений. Сахарный диабет. 2011;(3):6-11. [Maslova OV, Suntsov YuI. Epidemiology of diabetes mellitus and microvascular complications. Diabetes mellitus. 2011;(3):6-11.]
- Кураева ТЛ, Емельянов АО. Клиническая и генетическая гетерогенность неонатального сахарного диабета. Сахарный диабет. 2009;(3):10-15. [Kuraeva TL, Emel’yanov AO. Clinical and genetic heterogeneity of neonatal diabetes mellitus (review of the literature). Diabetes mellitus. 2009;(3):10-15.]
- Смирнова ОМ, Кононенко ИВ, Дедов ИИ. Гетерогенность сахарного диабета. аутоиммунный латентный сахарный диабет у взрослых (LADA): определение, распространенность, клинические особенности, диагностика, принципы лечения. Сахарный диабет. 2008;(4):18-23. [Smirnova OM, Kononenko IV, Dedov II. Geterogennost' sakharnogo diabeta. autoimmunnyy latentnyy sakharnyy diabet u vzroslykh (LADA): opredelenie, rasprostranennost', klinicheskie osobennosti, diagnostika, printsipy lecheniya. Diabetes mellitus. 2008;(4):18-23.]
- Дедов ИИ, Титович ЕВ, Кураева ТЛ, Атаманова ТМ, Зверева ЯС, Прокофьев С.А. Взаимосвязь генетических и иммунологических маркеров у родственников больных сахарным диабетом 1 типа. Сахарный диабет. 2008;(4):46-49. [Dedov II, Titovich EV, Kuraeva TL, Atamanova TM, Zvereva YaS, Prokofiev SA. Vzaimosvyaz' geneticheskikh i immunologicheskikh markerov u rodstvennikov bol'nykh sakharnym diabetom 1 tipa. Diabetes mellitus. 2008;(4):46-49.]
- Дедов ИИ, Шестакова МВ, Аметов АС, Анциферов МБ, Галстян ГР, Майоров АЮ, Мкртумян АМ, Петунина НА, Сухарева ОЮ. Консенсус совета экспертов Российской Ассоциации Эндокринологов по инициации и интенсификации сахароснижающей терапии у больных сахарным диабетом 2 типа. Сахарный диабет. 2011;(4):6-17. [Dedov II, Shestakova MV, Ametov AS, Antsiferov MB, Galstyan GR, Mayorov AYu, Mkrtumyan AM, Petunina NA, Sukhareva OYu. Russian Association of Endocrinologists expert consensus document on initiation and intensification of antyhyperglycaemic therapy in type 2 diabetes mellitus. Diabetes mellitus. 2011;(4):6-17.]
- IDF Diabetes Atlas 5th edition. 2012. Available from: http://www.diabetesatlas.org
- Maslova OV, Suntsov YI. Epidemiology of diabetes mellitus and microvascular complications. Diabetes mellitus 2011;(3):6-11.
- Kuraeva TL, Emel’yanov AO. Clinical and genetic heterogeneity of neonatal diabetes mellitus (review of the literature). Diabetes mellitus 2009;(3):10-15.
- Smirnova OM, Kononenko IV, Dedov II. Geterogennost' sakharnogo diabeta. autoimmunnyy latentnyy sakharnyy diabet u vzroslykh (LADA): opredelenie, rasprostranennost', klinicheskie osobennosti, diagnostika, printsipy lecheniya. Diabetes mellitus 2008;(4):18-23.
- Dedov II, Titovich EV, Kuraeva TL, Atamanova TM, Zvereva YS, Prokofiev SA. Vzaimosvyaz' geneticheskikh i immunologicheskikh markerov u rodstvennikov bol'nykh sakharnym diabetom 1 tipa. Diabetes mellitus 2008;(4):46-49.
- Dedov II, Shestakova MV, Ametov AS, Antsiferov MB, Galstyan GR, Mayorov AY, Mkrtumyan AM, Petunina NA, Sukhareva OY. Russian Association of Endocrinologists expert consensus document on initiation and intensification of antyhyperglycaemic therapy in type 2 diabetes mellitus. Diabetes mellitus 2011;(4):6-17.





