Сахарный диабет и хроническая болезнь почек: достижения, нерешенные проблемы и перспективы лечения


Published: Jan. 1, 2011
Latest article update: Nov. 23, 2022
Abstract
Последние годы ознаменовались драматическим ростом в мире числа больных сахарным диабетом (СД) и хронической болезнью почек(ХБП). Эти две большие медицинские проблемы тесно взаимосвязаны, поскольку диабет занял лидирующие позиции среди причин раз-вития почечной патологии. Диабетология и нефрология являются весьма затратными отраслями здравоохранения. Бремя экономиче-ских расходов, направляемых на обеспечение заместительной почечной терапии больным СД, продолжает нарастать. В связи с этимвсе более очевидной становится целесообразность программы ренопротекции на ранних стадиях диабетической нефропатии (ДН),которая может предотвратить или замедлить развитие терминальной почечной недостаточности. Реализация программы ренопро-текции у больных СД основывается на концептуальной модели развития и прогрессирования ДН, которая является результатом сово-купного воздействия метаболических и гемодинамических факторов, модулируемых генетическими факторами.
Keywords
Диабетическая нефропатия, сахарный диабет, хроническая болезнь почек, заместительная почечная терапия
ЭПИДЕМИОЛОГИЯ
Последние годы ознаменовались драматическим ростом в мире числа больных сахарным диабетом (СД) и хронической болезнью почек (ХБП). Эти две большие медицинские проблемы тесно взаимосвязаны, поскольку диабет занял лидирующие позиции среди причин развития почечной патологии. В странах Европы четко определено удвоение числа пациентов, страдающих СД, с терминальной почечной недостаточностью (ТПН) за 9-летний период наблюдения – с 12,7 до 23,6 на 1 млн популяции [1]. Согласно Объединенной cистеме данных о донорских почках США (USRDS) в 2008 г. число больных СД (преимущественно 2 типа) с ТПН в этой стране достигло 153 на 1 млн популяции [2]. Даже в странах с относительно низкой заболеваемостью СД – Австралии и Новой Зеландии — отмечен почти двукратный рост числа больных ТПН за счет пациентов с СД 2 типа (СД2) [3]. В связи с вестернизацией диеты и урбанизацией образа жизни в Азии ожидается наибольшая популяция больных СД с высоким риском почечной патологии, связанная с врожденным дефицитом нефронов, дефективностью продукции важнейшего вазодилатирующего фактора – оксида азота (NO), низкой эффективностью ингибиторов ангиотензинпревращающего фермента (ИАПФ) из-за частого побочного явления – кашля. В наиболее развитой стране этой части света – Японии – больные СД превалируют по численности в структуре диализной службы [4]. Менее учтенной и исследованной остается когорта больных СД с начальной и умеренной почечной недостаточностью, что затрудняет прогнозирование динамики распространенности ТПН и потребности в заместительной почечной терапии (ЗПТ).
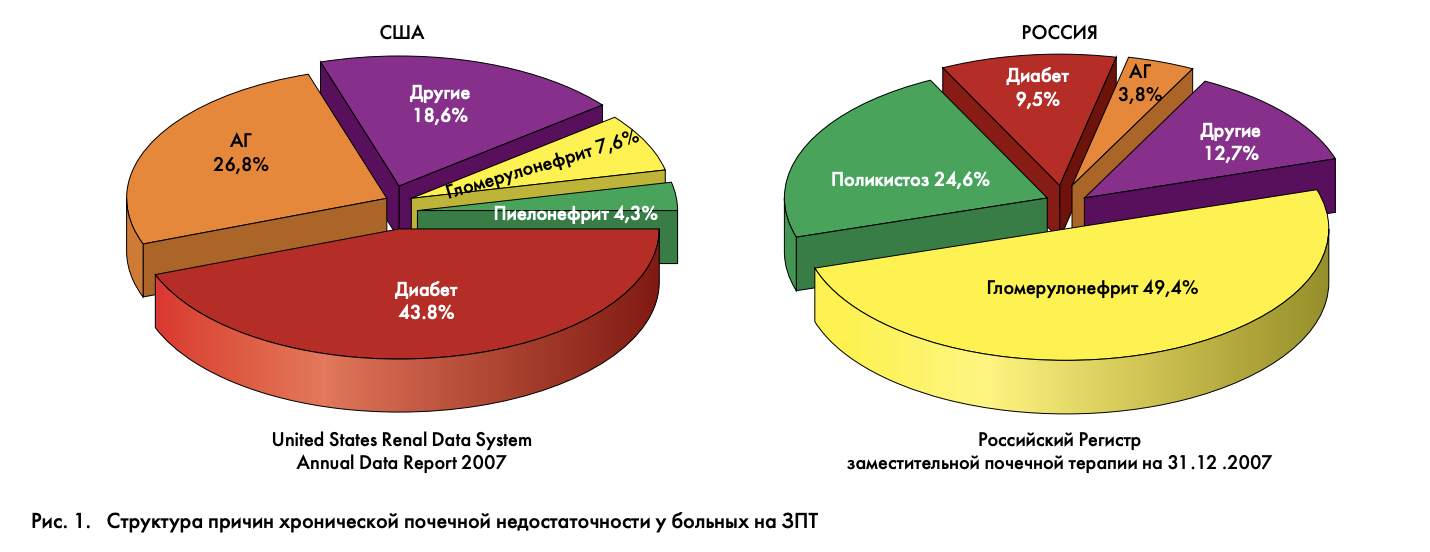
В России в рамках подпрограммы «Сахарный диабет» Федеральной целевой программы «Предупреждение и борьба с заболеваниями социального характера» за период 2000–2010 гг. проведен скрининг диабетических осложнений в регионах Российской Федерации. Распространенность диабетической нефропатии (ДН) значительно варьировала, в среднем составила 43% (20–50%) и в 2–4 раза превышала регистрируемую по данным локальных регистров больных СД [5]. В России, по данным регистра Российского диализного общества на 2007 г., на долю больных СД приходится лишь на 9,5% диализных мест (из них 65% — больные СД 1 типа (СД1) и только 35% — больные СД2), хотя реальная потребность такая же, как в развитых странах (рис. 1).
Следует отметить, что регистр Российского диализного общества не дает представления об истинной распространенности ТПН в популяции больных СД2 нашей страны, так как значительная часть этих больных не получает ЗПТ и поэтому не попадает в регистр. Четырехлетняя выживаемость больных СД, начавших лечение гемодиализом и перитонеальным диализом в 2003 г., была наиболее низкая по сравнению с другими нозологическими группами и составила 50,0% и 47,3% соответственно. Более высокие показатели выживаемости пациентам с СД обеспечивает трансплантация почки – 72% [6], что позволяет рассматривать этот метод ЗПТ как оптимальный для данной категории больных.
Для решения проблем больных СД с патологией почек и сохранения высокого качества их жизни в 1995 г. в ФГУ ЭНЦ открыто отделение диабетической нефропатии, усиленное в 1999 г. гемодиализной службой. В отделении аккумулирован опыт диагностики и лечения больных, начиная с ранних доклинических стадий почечной дисфункции и до терминальной стадии хронической почечной недостаточности. Пациенты имеют возможность пройти комплексное обследование для выявления не только ДН и других сосудистых осложнений, но и различной почечной патологии, осложнений, сопутствующих заболеваний, получить максимально индивидуализированные рекомендации по сахароснижающей, антигипертензивной, гиполипидемической, антиагрегантной, антианемической, антибактериальной, дезинтоксикационной терапии. При выраженной почечной патологии проводится подготовка больных к проведению ЗПТ с преимущественной ориентацией на трансплантацию почки. Успешной работе отделения способствуют своевременная диагностика почечной патологии, междисциплинарное взаимодействие, эффективное использование современных нефропротективных средств, нацеленных на коррекцию факторов риска развития и прогрессирования ДН.
ЭКОНОМИЧЕСКИЕ АСПЕКТЫ
Диабетология и нефрология являются весьма затратными отраслями здравоохранения. Бремя экономических расходов, направляемых на обеспечение ЗПТ больным СД, продолжает нарастать. Объем средств, затрачиваемых на оказание помощи этим пациентам, влияет на общий бюджет здравоохранения развитых стран. В США затраты на лечение больных с СД2 с ТПН оцениваются в 39 млрд долларов ежегодно [1]. В странах Европейского Союза , согласно экономическому анализу в рамках исследования REIN (Ramipril Efficacy In Nephropathy), было показано, что стоимость лечения 1 больного на гемодиализе варьирует от 20 000 до 80 000 евро в год (в среднем 48 170 евро как в Германии) [7]. В связи с этим все более очевидной становится целесообразность программы ренопротекции на ранних стадиях ДН, которая может предотвратить или замедлить развитие ТПН. Усилия по определению времени и стоимости лечения пациентов с относительно низким риском развития ТПН (прежде всего с ДН на стадии микроальбуминурии (МАУ)) представляются, на первый взгляд, дорогостоящими ввиду многочисленности когорты. Однако анализ ранних активных вмешательств демонстрирует повышение продолжительности жизни и снижение общих расходов по сравнению с поздним началом лечения – на стадии выраженной ДН [8]. В России стоимость диагностики и лечения 1 больного с ДН на стадии почечной недостаточности в течение 1 года составляет 462 000 руб. (Из расчетов ФГУ ЭНЦ по стандартам оказания амбулаторной медицинской помощи, 2008).
НОВАЯ КЛИНИЧЕСКАЯ И МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИИ ДН
В связи с ростом числа пациентов с почечной недостаточностью, развившейся в результате различных нозологических форм, в 2002 г. Национальным почечным фондом США было предложено объединить заболевания почек с известной причиной, а также с патологией, сопровождающейся снижением скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2 в течение 3 мес и более даже при отсутствии лабораторно-инструментальных признаков поражения почек, независимо от диагноза, в термин «хроническая болезнь почек» (KDOQI-2002) [9]. Уровень СКФ в настоящее время признан лучшим методом оценки функции почек в целом, как у здоровых лиц, так и при различных заболеваниях. Нормальный уровень СКФ соотносится с возрастом, полом, поверхностью тела. СКФ менее 60 мл/мин/1,73 м2 – пороговая величина, обозначающая потерю 50% фильтрационной способности нормальной почки.
Наднозологическое понятие ХБП особенно актуально для больных СД, учитывая важность и необходимость унификации подходов к диагностике, лечению и профилактике почечной патологии, особенно в случаях минимальной выраженности и трудно устанавливаемой природы заболевания. Кроме того, следует помнить и об универсальности молекулярно-клеточных и гемодинамических механизмов прогрессирования нефросклероза. Принятие новой классификации ХБП потребовало коррекции формулировки диагноза ДН с указанием стадии ХБП:
- ДН, стадия микроальбуминурии (МАУ), ХБП 1 (2, 3 или 4);
- ДН, стадия протеинурии, ХБП 2 (3 или 4);
- ДН, ХБП 5 (лечение заместительной почечной терапией);
- СД 1 или 2 , ХБП 3 или 4 (при СКФ менее 60 мл/мин и при отсутствии МАУ или протеинурии).
Активный скрининг больных СД1 и СД2 в регионах Российской Федерации выявил частоту ХБП только по уровню СКФ<60 мл/мин/1,73 м2 без учета уровня альбуминурии в 11,6% случаев [10]. Внедрение концепции ХБП в практику диабетологической службы – важный стратегический подход, направленный на снижение сердечно-сосудистой и общей смертности, так как взаимоотношения дисфункции почек и изменений сердечно-сосудистой системы у больных СД базируются на общности популяционных факторов риска, определяющих общность многих методов первичной и вторичной профилактики.
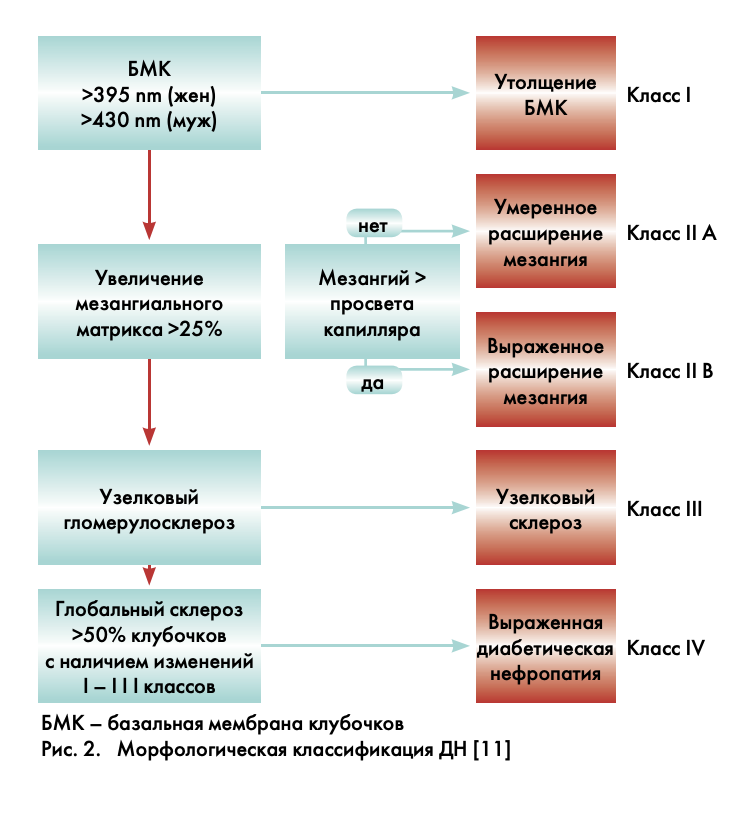
До настоящего времени отсутствовала единая морфологическая классификация структурных изменений почечной ткани при СД. В 2010 г. Научный комитет Общества почечной патологии (США) впервые разработал морфологическую классификацию патологии почек при СД [11]. Авторы подразделяют изменения при ДН на четыре класса гломерулярных повреждений с отдельной оценкой вовлеченности интерстиция и сосудов (рис. 2). I класс включает утолщение базальной мембраны и небольшие неспецифические изменения по данным световой микроскопии. При II классе определяют мезангиальную экспансию (умеренную – IIа или выраженную — IIб), но без узелкового склероза или гломерулярного склероза более 50% клубочков. III класс морфологических изменений соответствует картине узелкового склероза (изменения Киммелстила-Вильсона). IV класс – картина далеко зашедшего диабетического гломерулосклероза (склероз более чем 50% клубочков).
РАННЯЯ ДИАГНОСТИКА
Наиболее ранним методом диагностики ДН признано определение МАУ, т.е. высокоселективной экскреции белка с мочой в количестве от 30 до 300 мг/сут или от 20 до 200 мкг/мин в ночной порции мочи. МАУ диагностируют также и по соотношению альбумин/креатинин в утренней моче, что исключает погрешности суточного сбора мочи. Исследование мочи на МАУ проводится через 5 лет после дебюта СД1 и в момент установления диагноза СД2, далее ежегодно. Следует учитывать, что СД2 нередко диагностируется спустя 5–10 лет от его истинного начала, и наряду с диабетом большинство больных СД2 могут иметь ряд сопутствующих патологий (артериальная гипертония (АГ), ожирение, атеросклероз сосудов почек, нарушения пуринового обмена и др.), которые способствуют повреждению почек и прогрессированию почечной недостаточности.
В последнем, 4-м выпуске «Алгоритмов специализированной медицинской помощи больным СД» под ред. И.И. Дедова и М.В. Шестаковой от 2009 г. [12] предложена стратегия скрининга ДН при ХБП, основанная на определении МАУ или протеинурии (ПУ) и СКФ (рис. 3).
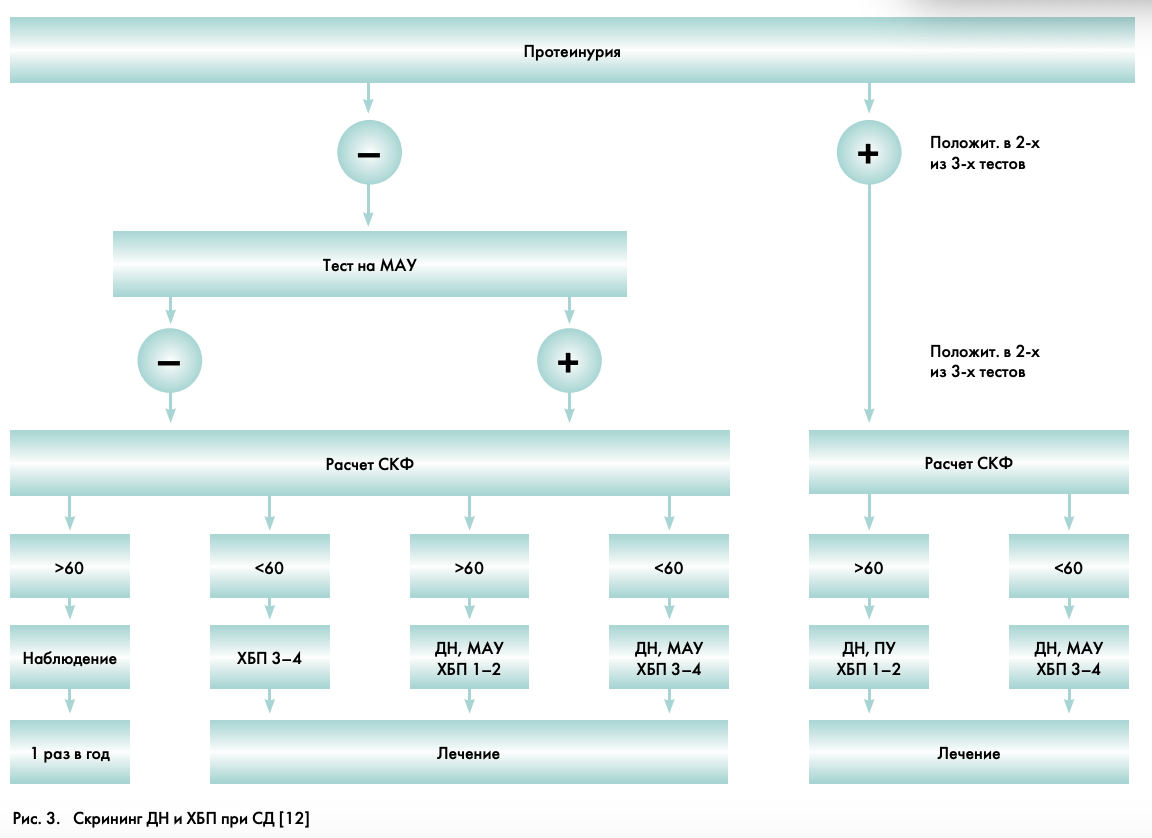
Важно рассматривать МАУ как предвестник развития не только ДН, но и сердечно-сосудистых заболеваний. С этой точки зрения МАУ – показание для скрининга возможной кардиоваскулярной патологии и агрессивной терапии, направленной на редукцию факторов риска (расширение физической активности, отказ от курения, применение антигипертензивных и гиполипидемических средств).
В определении молекулярных механизмов и ультраструктурных изменений, ведущих к МАУ, в последние годы достигнуты заметные успехи, дополняющие предыдущие концепции барьерной функции клубочков. Определена важная роль изменений (количественных и функциональных) подоцитов и экспрессии нефрина в формировании структуры щелевой диафрагмы — основного компонента почечного фильтра [13]. Результаты последних исследований позволяют рассматривать МАУ как результат повреждения всего нефрона, а нарушение тубулярной реабсорбции как основной компонент нарастания альбуминурии [14].
Предполагалось, что МАУ однозначно ассоциируется со снижением СКФ у больных СД2 так же, как и у больных СД1. Более поздние исследования показали, что это характерно преимущественно для пациентов с типичными диабетическими гломерулярными повреждениями и МАУ. Более того, были выявлены гетерогенные структурные изменения или даже отсутствие изменений у больных СД2 с МАУ [15]. Согласно современным представлениям, МАУ – это проявление генерализованной дисфункции эндотелия сосудов, что может объяснять не только почечную патологию, но и известную корреляцию между МАУ и кардиоваскулярными событиями.
В настоящее время идет дискуссия о признании наличия повреждения почек уже при выявлении МАУ более 15 мг/сут. Роль «высокого нормального» уровня альбуминурии ранее было показана в исследовании, проведенном в Steno Memorial Hospital (Дания) в 1982–1988 гг. В нем было продемонстрировано наличие высокого риска формирования микроальбуминурической стадии ДН уже при значении альбуминурии 15–23 мг/сут. Анализ рандомизированных исследований (HOPE (Heart Outcomes Prevention Evaluation), LIFE (Losartan Intervention For Endpoint reduction in hypertension), PREVEND (Prevention of Renal and Vascular END-stage Disease), Copenhagen Community Cohort, Copenhagen City Heart Study, Framingham Heart Study Offspring, Nord-Trondelag Health Study) свидетельствует, что уровень экскреции альбумина с мочой ниже диагностического порога («low-grade microalbuminuria») тесно связан с повышением риска развития сердечно-сосудистых катастроф и смертности от любых причин даже в популяции населения без СД и АГ [16–18].
Таким образом, одновременная оценка основных показателей – СКФ и альбуминурии – необходима для первичной диагностики ренальной дисфункции, а также для контроля терапии, скорости прогрессирования патологического процесса и определения прогноза.
Наряду с традиционными методами ранней диагностики почечных повреждений у больных СД представляется многообещающим в неинвазивной диагностике определение экскреции N-ацетил-D-глюкозамидазы (NAG), ретинол-связывающего белка (РСБ), β-2-микроглобулина, специфических видов клеток (макрофагов, естественных киллеров, подоцитов), специфических для подоцитов белковых маркеров (подокаликсина, нефрина). Повышенную мочевую экскрецию низкомолекулярного РСБ и маркера канальцевого повреждения NAG определяют у пациентов с СД1 даже в отсутствие альбуминурии [19]. В ряде исследований эти показатели коррелировали с гликемией [19], а в ряде исследований их повышенный уровень указывал на риск развития МАУ в течение 5 лет [20]. У больных СД2 исходно высокая мочевая экскреция NAG связана с поражением крупных сосудов в течение последующих лет наблюдения [21]. Последние исследования показали, что снижение уровня этого маркера в моче ассоциируется с регрессом МАУ у больных СД1 [22]. Подоцитурия рассматривается как наиболее ранний неинвазивный маркер активности гломерулярных повреждений [23]. Число подоцитов при СД снижается, предположительно, вследствие их неспособности к пролиферации при воздействии иммунных, метаболических, токсических, гемодинамических факторов, а также нарушения фиксации этих клеток к базальной мембране клубочков. У пациентов с СД и МАУ подоцитурия определяется в 50%, а при протеинурии – в 80% случаев. При лечении ИАПФ у этих больных снижалась не только альбуминурия, но и подоцитурия, что свидетельствует о задействованности ангиотензина II (AII) в повреждении подоцитов [24].
МЕХАНИЗМЫ РАЗВИТИЯ
Реализация программы ренопротекции у больных СД основывается на концептуальной модели развития и прогрессирования ДН, которая является результатом совокупного воздействия метаболических и гемодинамических факторов, модулируемых генетическими факторами. «Прорывным» моментом в понимании патогенеза ДН явилось открытие Brenner BM феномена гиперфильтрации и внутриклубочковой гипертензии [25]. Этот механизм активизируется хронической гипергликемией, вызывая вначале функциональные, а затем структурные изменения в почках, протекающие безмолвно и приводящие к появлению МАУ. Длительное воздействие мощного гидравлического пресса («shear stress») инициирует механическое раздражение прилежащих структур клубочка, что способствует гиперпродукции коллагена и накоплению его в области мезангиума, начальным склеротическим процессам, нарушению архитектоники и проницаемости базальной мембраны клубочка.
Другим важным открытием было определение сверхвысокой активности локальной ренин-ангиотензин-альдостероновой системы (РААС) при СД. Установлено, что локальная почечная концентрация ключевого компонента системы — АII — в 1000 раз превышает его содержание в плазме [26]. Механизмы патогенного действия АII при СД обусловлены не только его мощным вазоконстрикторным действием, но и пролиферативной, прооксидантной и протромбогенной активностью. В почках АII вызывает внутриклубочковую гипертензию, способствует склерозированию и фиброзированию почечной ткани опосредованно через выброс цитокинов и факторов роста.
Длительное время велись дебаты о специфичности проявления ДН при СД1 и СД2. В настоящее время достаточно убедительны свидетельства, что базовые патофизиологические механизмы, ведущие к развитию и прогрессированию ДН, одинаковы при обоих типах диабета. Однако при СД2 имеют место дополнительные предсуществующие факторы повреждения почек, такие как ожирение, гиперурикемия, дислипидемия и др. ответственные за комплексную почечную патологию. Патофизиологические изменения до развития СД2, классифицируемые как метаболический синдром, уже могут создать условия для развития почечных повреждений, независимо от гипергликемии.
Гипергликемии отводится ведущая роль в развитии микро- и макрососудистых осложнений. Она индуцирует неферментное гликирование белков, окислительный стресс, активирует протеинкиназу С, митоген-активирующую протеинкиназу, действие факторов роста, вазоактивных факторов, цитокинов, вызывающих повреждение почек на уровне клетки. Это ведет к развитию почечной гипертрофии и аккумуляции экстрацеллюлярного матрикса, предшествующих таким необратимым изменениям, как гломерулосклероз и тубулоинтерстициальный фиброз. Сегодня не вызывает сомнения необходимость достижения оптимального контроля гликемии для профилактики развития и нарастания тяжести ДН. Наиболее крупным исследованием, подтвердившим возможность предотвращения развития ДН у больных СД1 при идеальной компенсации углеводного обмена, явилось исследование DCCT (Diabetes Control and Complication Study), у больных СД2 – исследование UKPDS (United Kingdom Prospective Diabetes Study) и исследование ADVANCE (The Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation). Компенсация углеводного обмена, играющая ключевую роль на начальных стадиях заболевания, продолжает сохранять свое значение даже на далеко зашедших стадиях осложнения. Однако патология почек накладывает серьезные ограничения на выбор сахароснижающего препарата у больных СД [27]. Исследование ADVANCE убедительно продемонстрировало, что у пациентов СД2 старше 60 лет с высоким сердечно-сосудистым риском и длительным течением заболевания назначение в рутинной практике такого сахароснижающего препарата как Гликлазид МВ (Диабетон МВ) безопасно и высокоэффективно, поскольку позволяет снизить риск развития и прогрессирования почечной патологии и сердечно-сосудистой смертности [28]. В этом исследовании применение Гликлазида МВ снижало риск развития:
- микроальбуминурии на 9% (р=0,018);
- макроальбуминурии (протеинурии) на 30% (р<0,001);
- новых случаев нефропатии и ее прогрессирования на 21% (р=0,006).
Гиперлипидемия – другой метаболический фактор прогрессирования ДН. Пациенты с СД имеют комплексные липидные нарушения: сниженный уровень липидов высокой плотности (ЛПВП), повышенный уровень триглицеридов (ТГ), липидов низкой плотности (ЛПНП), особенно выраженные при ДН. Установлено существование полной аналогии между процессом формирования гломерулосклероза и атеросклеротической бляшки сосудистой стенки [29]. Этому способствует структурное сходство мезангиальных клеток клубочков с гладкомышечными клетками артерий. Окисленные ЛПНП, ростовые факторы и цитокины увеличивают синтез компонентов мезангиального матрикса, ускоряя склерозирование клубочков. Кроме того, липиды, профильтровавшиеся в первичную мочу, могут повреждать и клетки почечных канальцев.
Протеинурия чаще всего рассматривается в качестве важнейшего негемодинамического предиктора прогрессирования ДН. При нарушении структуры почечного фильтра крупномолекулярные белки приходят в соприкосновение с мезангием и с клетками почечных канальцев, что приводит к токсическому повреждению мезангиальных клеток, ускоренному склерозированию клубочков, развитию воспалительного процесса в интерстициальной ткани. Результаты последних исследований позволяют рассматривать нарушение тубулярной реабсорбции как основной компонент прогрессирования альбуминурии. Механизмы протеинурического ремоделирования тубулоинтерстиция при ДН обосновывают необходимость мероприятий, направленных на снижение высокого уровня потери белка с мочой в комплексной терапии.
Исследование RENAAL (Reductions of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan study), включавшее пациентов с СД2 и ДН на стадии начальной почечной недостаточности, показало протеинурию в качестве наиболее значимого фактора риска кардиоваскулярных событий и прогрессирования ДН независимо от уровня АД [30].
Артериальная гипертония играет ключевую роль в развитии и прогрессировании ДН, так же как и в развитии макроваскулярной патологии. По мере прогрессирования ДН роль метаболических факторов снижается, и возрастает роль гемодинамических (АГ, внутриклубочковая гипертензия). Предупредить развитие и прогрессирование сосудистых осложнений (в том числе и ДН) возможно только при поддержании АД на уровне не более 130/80 мм. рт. ст. Более жесткий контроль АД у лиц с почечной патологией может привести к гипоперфузии других органов-мишеней.
Анемия является одним из основных проявлений снижения функции почек при ДН и в то же время фактором прогрессирования патологии почек. Организованное ФГУ ЭНЦ эпидемиологическое исследование по выявлению анемии у больных СД, включившее 2015 больных СД1 (807 чел.) и СД2 (1208 чел.), показало высокую распространенность анемии у больных ДН. Так, анемия у больных СД1 с ДН выявлялась в 2,5 раза чаще, чем без поражения почек (41,9% и 16,6%, соответственно), а при СД2 — в 2,1 раза чаще (25,7% и 12,0%, соответственно) [31]. Оценка распространенности анемии у больных ДН в зависимости от стадии ХБП и выраженности почечного повреждения выявила, что частота анемии пропорционально увеличивается по мере увеличения альбуминурии и снижения СКФ, достигая 89,5% на додиализной стадии ХБП.
Ведущим звеном в патогенезе анемии у больных ДН является неадекватная выработка гормона эритропоэтина (ЭПО) почками в ответ на анемию (гипоксию) — уровень ЭПО в крови остается в пределах нормальных значений, т.е. не соответствует пониженному значению Hb. Данный феномен называют функциональным, или относительным дефицитом ЭПО. Установлено, что при прогрессирующих заболеваниях почек продукция ЭПО почками в ответ на анемию может быть сохранена при уровне СКФ более 40 мл/мин/1,73 м2.
Развитие раннего дефицита продукции ЭПО почками при ДН предполагает и раннее начало коррекции анемии эритропоэзстимулирующими средствами (ЭСС).
В 2007 г. было выпущено дополнение к последним рекомендациям NKF K/DOQI по лечению анемии при ХБП – NKF K/DOQI Update of Hb Target [32], где были определены целевые значения Hb у больных ХБП, получающих ЭСС в пределах 11,0–12,0 г/дл и не выше 13,0 г/дл (максимальный уровень). Претерпела изменение и тактика Европейской рабочей группы по анемии (Anemia Working Group of European Renal Best Practice (ERBP)), указавшая на особую осторожность при лечении анемии ЭСС у больных СД2 с ХБП и перенесших инсульт.
Оптимизация коррекции анемии ЭСС, в том числе с применением нового перспективного ЭСС с продленным действием CERA (continuous erythropoesis receptor activator) – активатора эритропоэтиновых рецепторов длительного действия (МИРЦЕРА), является одной из основных задач комплексного лечения больных СД с ХБП. Наиболее приемлемый уровень Hb у больных ДН, получающих ЭСС, должен определяться индивидуально, с учетом сопутствующей сердечно-сосудистой патологии, возможных преимуществ и рисков терапии и основываться на рекомендациях, базирующихся на результатах крупных клинических исследований в рамках доказательной медицины.
МНОГООБРАЗИЕ ПАТОЛОГИИ ПОЧЕК ПРИ СД
Стереотипное представление о ДН может маскировать различные другие заболевания почек при СД: одно- или двусторонний атеросклеротический стеноз почечных артерий (СПА), тубулоинтерстициальный фиброз, инфекцию мочевых путей, интерстициальный нефрит, лекарственный нефрит и др.
Стеноз почечных артерий привносит целый ряд особенностей в клиническое течение нефропатии и коренным образом может изменить подходы к терапии патологии почек. В исследовании, проведенном в ФГУ ЭНЦ совместно с Научным центром сердечно-сосудистой хирургии им. А.Н. Бакулева, по данным дуплексного УЗИ сосудов почек, был обнаружен и в последующем подтвержден контрастными методами диагностики монолатеральный СПА у 30% больных СД2 в возрасте старше 50 лет, а билатеральный – у 7% [33]. Высокая распространенность СПА при СД2 может рассматриваться как результат ранней вовлеченности почечных артерий в ускоренный генерализованный атеросклероз. В свою очередь, хроническая ишемизация почек, наслаиваясь на ДН, безусловно, ускоряет развитие почечной недостаточности у больных СД2. Пациенты с СПА имели выраженный атеросклероз коронарных и брахиоцефальных артерий, чаще переносили инфаркт миокарда, имели изолированную систолическую АГ, для контроля которой требовалось 3 и более антигипертензивных препарата, злоупотребляли никотином.
Анализ выживаемости этих пациентов, осуществленный методом Каплана-Мейера, подтвердил роль СПА в достижении комбинированной конечной точки, определенной как смерть пациентов, срочная госпитализация по поводу сердечной недостаточности, инфаркт миокарда, удвоение креатинина, достижение ТПН в течение 24 месяцев наблюдения. Полученные данные свидетельствуют, что СПА у больных СД2 является одним из значимых факторов риска прогрессирования почечной и кардиальной патологии, а также повышенной смертности.
По данным ретроспективного анализа, больные СД2, подвергшиеся коронарной ангиографии (КАГ) и ангиографии почечных артерий, демонстрировали более распространенную сосудистую патологию по сравнению с контрольной группой без СД. При этом поражение коронарных артерий у лиц с СПА носило преимущественно 2- и 3-х сосудистый характер и составило 92,3% [33]. Полученные результаты показали, кроме того, что каждый третий пациент с СД имел поражения всех основных сосудистых бассейнов: почечных, брахиоцефальных, периферических и коронарных.
Среди токсических поражений почек особое место занимает контраст-индуцированная нефропатия (КИН), ставшая важной клинической проблемой, развивающейся параллельно с широким распространением диагностических и лечебных процедур с использованием контрастных средств ввиду основного пути их элиминации через почки.
При проведении ретроспективного анализа исследования на базе ФГУ ЭНЦ и Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева, частота развития КИН у больных СД2, подвергшихся КАГ, была в 2,5 раза выше, чем в контрольной группе лиц без СД при сопоставимом исходном уровне почечной функции, дозе контрастного препарата и сходном режиме гидратации [34]. Риск развития КИН у больных СД2 был ассоциирован с сердечной недостаточностью III–IV класса по NYHA, анемией, дозой контрастного препарата, приемом диуретиков в перипроцедурный период, многососудистым поражением коронарных артерий, необходимостью проведения интервенционного вмешательства. У больных СД2 с КИН в анамнезе быстрее снижалась почечная функция, чаще развивались серьезные сердечно-сосудистые события и были хуже показатели выживаемости в течение 24 мес наблюдения. Высокая вероятность развития и прогностическая значимость КИН у больных СД2 определяют необходимость оценки индивидуального риска для принятия превентивных мер при проведении контрастных процедур.
Тубулоинтерстициальный фиброз (ТИФ) – столь же важный механизм утраты функциональной способности при СД, как и гломерулосклероз. В развитии тубулоинтерстициального повреждения определена роль сложных процессов межклеточных взаимодействий, которые активизируются под влиянием иммунных и не иммунных факторов. Потенциальные механизмы тубулоинтерстициальных повреждений при первичной гломерулярной патологии (диабетическом гломерулосклерозе, гломерулонефрите) включают токсический эффект фильтрующихся белков плазмы, активацию эпителиальных клеток канальцев цитокинами, секретируемых в клубочках, снижение перитубулярного кровотока, приводящее к нарастающей ишемии тубулоинтерстиция, перегрузку функционирующих канальцев. В свою очередь, прогрессирующий интерстициальный фиброз может повышать резистентность пре- и постгломерулярных артериол, что усугубляет внутриклубочковую гиперфильтрацию. Прогрессирующий канальцевый стеноз в рамках ТИФ определяет повышение внутриканальцевого давления, что, в конечном итоге, приводит к снижению СКФ, а их обструкция — к снижению числа функционирующих нефронов. Спектр возможных факторов тубулоинтерстициального повреждения довольно широк: протеинурия, трансформирующий фактор роста-β (TGF-β), ангиотензин II (АТ II), моноцитарный хемоаттрактантный протеин (МСР-1), регулятор активности нормальной экспрессии и секреции Т-клеток (RANTES), факторы адгезии (внутриклеточная молекула адгезии (ICAM‑1), молекула адгезии сосудистых клеток (VCAM-1)), эндотелиальный сосудистый фактор роста (VEGF), белки острой фазы (С-реактивный белок (СРБ), фибриноген), интерлейкин-6 (IL‑6), асимметричный диметиларгенин (АDМА), гомоцистеин (HCYST), металлопротеиназы (ММР), фактор Виллебранда (FW), ингибитор активатора плазминогена (PAI-I) и др.
В исследовании, проведенном в ФГУ ЭНЦ, был выявлен повышенный уровень профиброгенных цитокинов (MCP-1, TGF-β1 и IL-6), а также фактора деградации внеклеточного матрикса (ММР-9) в крови у больных СД с ХБП при сравнении с лицами с СД2 без почечной патологии и контрольной группой независимо от типа диабета и причины нефропатии, что показывает участие этих молекулярных медиаторов в поражении почек, в основном, за счет универсального механизма формирования ТИФ. Активация профиброгенных цитокинов у больных СД с патологией почек тесно ассоциировала с эндотелиальной дисфункцией, определяемой повышенной продукцией в крови адгезивных, ангиогенных, тромбогенных факторов (FW, PAI, VICAM, sICAM, VEGF), а также факторов повреждения эндотелия (ADMA, гомоцистеин), что придает процессам взаимно индуцирующий характер, усугубляя ренальные повреждения. Была определена вовлеченность медиаторов воспаления и фиброгенеза в процессы тубулоинтерстициального повреждения у больных СД и ХБП, подтвержденная их отрицательной корреляционной связью с СКФ и положительной с альбуминурией – основными маркерами почечной дисфункции. Исследование свидетельствовало о высоком риске снижения СКФ у пациентов с СД и ХБП при повышении TGF-β1, ADMA, МСР-1 в крови наряду с традиционными факторами риска [35].
ЛЕЧЕНИЕ ХБП ПРИ СД И ЕГО ПЕРСПЕКТИВЫ
Механизмы развития ДН и определяющая роль РААС в развитии почечной патологии определяют выбор антигипертензивных средств – ИАПФ, блокаторы рецепторов ангиотензина II (БРА). ИАПФ и БРА применяются в качестве базовой антигипертензивной терапии. Целесообразность их применения определяется рено- и кардиопротекторными эффектами независимо от влияния на системную гемодинамику. ИАПФ являются препаратами первого ряда для больных СД1, начиная с самых ранних стадий. Три крупнейших исследования (IRMA2, IDNT, RENAAL) по применению БРА у больных СД2 с патологией почек позволяют говорить об их преимуществе в качестве препаратов выбора, что получило отражение в общих рекомендациях ADA по контролю АГ [36].
Однако длительное (более 25 лет) применение ИАПФ показало, что в реальной клинической практике нефропротективный эффект от их применения развивается у 50% больных с ДН [37]. При изучении этого вопроса оказалось, что существуют другие альтернативные пути образования AII, контролируемые хиамазой, катепсином G, тонином и др. При активации этих ферментов наступает так называемый эффект ускользания от действия ИАПФ, т.е. снижение его антигипертензивного и антипротеинурического действия, поскольку синтез AII сохраняется. Другими причинами неэффективности ИАПФ как нефропротекторов может быть злоупотребление поваренной солью и генетическая детерминированность. Неполная блокада РААС может быть ответственна за прогрессирование почечной и кардиальной патологии, поскольку не обеспечивает оптимальной органопротекции. Причины, механизмы, время развития феномена, а также его клиническое значение остаются пока предположительными и мало освещенными в литературе.
В отделении диабетической нефропатии ФГУ ЭНЦ длительное время велась работа по изучению природы феномена ускользания от действия ИАПФ. При ретроспективном анализе прогрессирования ДН у больных СД1 и СД2 на фоне стабильного приема эффективной дозы ИАПФ в течение 6 лет были определены 2 группы пациентов: группа лиц со стабильной фильтрационной функцией почек в течение всех лет наблюдения (50% больных СД1 и 47% больных СД2) и группа больных, у которых, невзирая на стабильный прием ИАПФ, СКФ продолжала неуклонно снижаться (50% больных СД1 и 53% больных СД2). Исходные клинико-лабораторные характеристики этих пациентов не различались, в том числе и по состоянию СКФ, уровню гликемического контроля, потреблению соли, диуретиков и другим показателям [38]. При изучении концентрации гормонов РААС у больных, длительно получавших ИАПФ, удалось установить, что феномен ускользания клинически начинает проявляться при сохранении концентрации AII в крови более 50 пг/мл. При подавлении секреции AII до 50 пг/мл и менее сохраняется высокая нефро- и кардиопротективная эффективность ИАПФ. В противном случае требовалась коррекция терапии и перевод на альтернативные препараты (БРА) [39].
Новый класс препаратов – прямые ингибиторы ренина (алискирен) – демонстрируют эффективность в блокаде РААС и вселяют надежду на возможность длительной нефропротекции при СД без феномена ускользания. Роль этой группы препаратов в длительной ренопротекции у больных СД будет определена по завершению крупных многоцентровых исследований, проводимых в настоящее время (ALTITUDE — The Aliskiren Trial in Type 2 Diabetic Nephropathy).
Поиск маркеров ранней диагностики ХБП у больных СД и методов активного воздействия на них позволил бы предотвратить или отсрочить прогрессирование утраты почечной функции. Современные подходы нефропротекции включают средства, целенаправленно воздействующие на медиаторы воспаления и фиброза (противовоспалительные агенты, антагонисты TGF‑β, активаторы кининовых рецепторов, ингибиторы рецепторов коллагена DDR1, ингибиторы внутриклеточных сигнальных путей и др.). Подавление воспаления, играющего важную роль в инициации почечной патологии, возможно на ранних стадиях. Рапамицин, используемый в основном как иммуносупрессор, в эксперименте способствует уменьшению тубулярной дилатации, интерстициального объема и отложению коллагена. Близкие эффекты наблюдаются при введении ингибиторов нуклеарного фактора (NF)– kappaB. TGF-β является важнейшим активатором синтеза экстрацеллюлярного матрикса (ЭЦМ). Для подавления его фиброгенной активности в эксперименте используют костный морфогенный протеин 7 (ВМР 7), фактор роста гепатоцитов (HGF), ингибитор ALK5 — опосредованного Smad3, моноклональные антитела. ВМР 7 у крыс со стрептозотоциновым диабетом снижает протеинурию, воспаление, выраженность склероза клубочков и интерстиция, предупреждает уменьшение числа подоцитов [40]. Описан антифибротический потенциал HGF, приводящий к замедлению развития гломерулярного и тубулоинтерстициального фиброза у мышей с диабетом [41]. Кроме того, HGF стимулирует клеточную регенерацию, снижает воспаление, активацию NF-kappaB. Ведутся исследования ингибитора ALK5 — опосредованного Smad3, предупреждающего каскад действий TGF-β [42]. Использование антагонистов рецепторов к факторам роста – перспективное направление антифибротической терапии. Однако выраженность побочных эффектов при длительном применении требует проведения дальнейших исследований для повышения ее безопасности. Ингибиторы протеинкиназы С – важнейшего внутриклеточного сигнализатора реакций пролиферации, гипертрофии и апоптоза – способствуют сохранению функции почек путем снижения гломерулосклероза, интерстициального фиброза, тубулярной атрофии [43]. Эти данные нуждаются в дальнейшем изучении, учитывая очень сложный регуляторный путь реакций с участием протеинкиназы С, прежде чем средства обсуждаемого действия (рубоксистаурин) будут причислены к традиционной нефропротективной терапии. Предполагаемый эффект активаторов кининовых рецепторов связан с уменьшением отложения коллагена, интерстициального моноцитарномакрофагального накопления, экспрессии хемоаттрактантных пептид-1 моноцитов, клеточного апоптоза [44]. Ингибиция рецепторов коллагена DDR1 блокирует систему взаимодействия с ЭЦМ, а также промежуточное звено в воспалительном ответе, подавляя созревание и дифференцировку моноцитов и макрофагов [45]. Обнадеживающие результаты экспериментальных исследований вселяют уверенность в перспективность описанных средств и реальную возможность обратимости почечных изменений у больных СД.
Таким образом, стремительный рост числа больных СД с почечной патологией предъявляет серьезные требования к медицинскому сообществу. Установление «болевых точек» — факторов развития и прогрессирования ДН, наряду с изучением клеточных и молекулярных механизмов нефросклероза, разработкой основных терапевтических направлений и целевых показателей в соответствии принципами доказательной медицины – составляют основу современной нефропротективной стратегии. Только такая стратегия, наиболее перспективная и экономичная для национального здравоохранения, позволит остановить эпидемию «диабетической» почечной недостаточности
СПИСОК ЛИТЕРАТУРЫ
- Postma M.J., de Zeeuw D. The economic benefits of preventing end-stage renal disease in patients with type 2 diabetes mellitus // Nephrol. Dial. Transplant. - 2009. - № 24. - P. 2975-298.
- USRDS 2010 Annual Data Report . Atlas of End-Stage Renal Disease. http://www.ysrds.org/atlas.htm.
- Villar E., Chang S.H., McDonald S.P. Incidences, Treatments, Outcomes, and Sex Effect on Survival in Patients With End-Stage Renal Disease by Diabetes Status in Australia and New Zealand (1991- 2005) // Diabetes Care. - 2007. - № 30(12) - P. 3070-3076.
- Kikkawa R., Kida Y., Haneda M. Nephropathy in type II diabetes - epidemiological issues as viewed from Japan // Nephrol. Dial. Transplant. - 1998. - № 13. - P. 2743-2745.
- Шестакова М.В., Дедов И.И. Сахарный диабет и хроническая бо- лезнь почек. М.: МИА, 2009. -.с.
- Бикбов Б. Т., Томилина Н. А. Состояние заместительной терапии больных с хронической почечной недостаточностью в Российской федерации в 1998- 2007 г. // Нефрология и диализ. - 2009. - № 11(3). - С. 144-234.
- Costa-Scharplatz M., van Asselt A.D., Bachmann L.M. et al. Costeffectiveness of pharmacogenetic testing to predict treatment response to angiotensin-converting enzyme inhibitor // Pharmacogenet Genomics. - 2007. - № 17. - P. 359-368.
- Palmer A.J., Annemans L., Roze S. et al. Cost-effectiveness of early irbesartan treatment versus control (standard antihypertensive medictions excluding ACE inhibitors, other angiotensin-2-receptor antagonist, and dihydropyridine calcium channel blockers) or late irbesartan treatment in patients with type 2 diabetes, hypertension, and renal disease // Diabetes Care. - 2004. - № 27. - P. 1897-1903.
- NKF-K/DOKI clinical practice guidelines for chronic kidney diseases: evaluation, classification and stratification // Am. J. Kidney Dis. - 2002. - 39 (suppl. 1). - S17-S31.
- Маслова О.В., Сунцов Ю.И., Шестакова М.В., Казаков И.В. Распро- страненность поражения почек при сахарном диабете 1 и 2 типов в Российской Федерации // Сахарный диабет. - 2009. - № 4. - С. 48-51.
- Tervaert T.W., Mooyaart A.L., Aman K., Cohen A.H., Cook H.T. et al. Pathologic classification of diabetic nephropathy // J. Am. Soc. Nephrol. -2010. - № 21. - P. 556-563.
- Алгоритмы специализированной медицинской помощи больным са- харным диабетом. / Под ред. И.И. Дедова и М.В. Шестаковой. - Изд. 4-е, доп. 4-ый выпуск. - М., 2009. - 101 с.
- Adler S. Diabetic nephropathy: linking histology, cell biology, and genetics // Kidney Int. - 2004. - № 66. - P. 2095-2106. 88 1/2011 Сахарный диабет Диабетическая нефропатия
- Greive K.A., Nikolic-Patzerson D.J., Guimaraes M.A.M. et al. Glomerular permselectivity factors are not responsible for the increase in fractional clearance of albumin in rat glomerulonephritis // Am. J. Pathol. - 2001 - № 159. - P. 1159-1170.
- Brocco E., Fioretto P., Mauer M. et al. Renal structure and function in noninsulin dependent diabetic patients with microalbuminuria // Kidney Int. - 1997. - № 52. - P. S40-S44.
- Schmieder R.E., Scharder J., Zidek W. et al. Low-grade albuminuria and cardiovascular risk: what is the evidence? // Clin. Res. Cardiol. - 2007. - № 96(5). - P. 247-257.
- Brantsma A.H., Bakker S.J., Hillege H.L. et al. Urinary albumin excretion and its relation with C-reactive protein and metabolic syndrome in the prediction of type 2 diabetes // Diabetes Care. - 2005. - № 28(10). - P. 2525-2530.
- Formann J.P., Brenner B.M. «Hypertension» and «microalbuminuria»: The bell tolls for thee // Kidney Int. - 2006. - № 69. - P. 22-28. 19. Ginevri F, Piccotti E, Alinovi R, DeToni T, Biagini C, Chiggeri GM, Gusmano
- R. Reversible tubular proteinuria precedes microalbuminuria and correlates with the metabolic status of diabetic children // Pediatr. Nephrol . - 1993. - № 7. - P. 23-26.
- Kordonouri O, Hartmann R, Mueller C, Danne T, Weber B. Predictive value of tubular markers for the development of microalbuminuria in adolescents with diabetes // Hormone Res. - 1998. - № 50. - S23-S27.
- Weitgasser R, Schnoell F, Gappmayer B, Kartnig I. Prospective evaluation of urinary N-acetyl-beta-D-glucosaminidase with respect to macrovascular disease in elderly type 2 diabetic patients // Diabetes Care. - 1999. - № 22. - P. 1882-1886.
- Vaidya V.S., Niewczas M.A., Ficociello L.H., Johnson A.C. et al. Regression of microalbuminuria in type 1 diabetes is associated with lower levels of urinary injury biomarkers, kidney injury molecule-1, and N-acetyl--Dglucosaminidase // Kidney Int. -2010. - Published online.
- Petermann A., Floege J. Podocyte damage resulting in podocyturia: a potential diagnostic marker to assess Glomerular disease activity // Nephron Clin. Pract. - 2007. - № 106(2). - P. 61-66.
- Nakamura T, Ushiyama C, Suzuki S, Hara M. Urinary excretion of podocytes in patients with diabetic nephropathy // Nephrol. Dial. Transplant. - 2000. - № 15. - P. 1379-1383.
- Brenner B.M., Hostetter T., Humes H.D. Molecular basis of proteinuria of glomerular origin // N. Engl. J. Med. - 1978. - № 298. - P. 826-833.
- Navar L.G., Harrison-Bernard L.M., Imig J.D. et al. Intrarenal angiotensin II generation and renal effects of ATI receptor blockade // J. Am. Soc. Nephrol. - 1999. - № 10. - P. 266-272.
- Schernthaner G., Ritz E., Schernthaner G-H. Strict glycaemic control in diabetic patients with CKD or ESRD: beneficial or deadly? // Nephrol. Dial. Transplant. - 2010. - № 25. - P. 2044-2047.
- Patel A., MacMahon S., Chalmers J. et al. ADVANCE Collaborative Group. Intensive blood glucose and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. - 2008. - № 358. - P. 2560-2572.
- Diamond J. Focal and segmental glomerulosclerosis: analogies to atherosclerosis // Kidney Int. 1988. - № 33. - P. 917-924.
- De Zeeuw D., Remuzzi G., Parving H-H. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL // Kidney Int. - 2004. - № 65(6). - P. 2309-2320.
- Шестакова М.В., Маpтынов С.А., Ильин А. В., Князева А.П., Шамха- лова М.Ш., Тpубицына Н.П. Анемия пpи диабетической нефpопатии: pаспpостpаненность, клинические и патофизиологические аспекты // Тер. архив. - 2008. - № 6. - С. 41-47.
- NKF-KDOQI Guidelines on Diabetes and CKD // Am. J. Kid. Dis. - 2007. - № 2 (suppl 2). - S 12-S 143.
- Шамхалова М.Ш., Клефортова И.И., Шестакова М.В., Ремизов О.В., Бухман А.И., Алпенидзе В,А., Тугеева Э.Ф., Шария М.А., Устюжанин Д.В., Бузиашвили Ю.И., Дедов И.И. Стеноз почечных артерий у больных сахарным диабетом 2 типа: клинические признаки, диа- гностика, прогностическая значимость // Тер. архив. - 2010. - № 6. - С. 15-19.
- Шамхалова М.Ш., Зайцева Н.В., Курумова К.О., Шестакова М.В., Деев А.Д., Мацкеплишвили С.Т., Тугеева Э.Ф., Бузиашвили Ю.И. Контрастиндуцированная нефропатия при коронарографии у больных сахарным диабетом 2-го типа: факторы риска развития, прогностическая значимость, пути профилактики // Тер. архив. - 2009. - № 8. - С. 36-41.
- Шамхалова М.Ш., Курумова К.О., Клефортова, И.И., Ситкин И.И., Ильин А.В., Арбузова М. И., Гончаров Н.П., Кация Г.В., Алексан- дров А.А., Кухаренко С.С., Шестакова М.В., Дедов И.И. Факторы развития тубулоинтерстициального повреждения почек у больных сахарным диабетом // Сахарный диабет. - 2010. - № 3. - С. 134-141.
- Standards of medical care for patients with diabetes mellitus. American Diabetes Association // Diabetes Care. - 2009. - № 32 (1). - S13-S61.
- Athyros VG, Mikhalidis DP, Kakafika AI et al. Angiotensin II reactivation and aldosterone escape phenomenon in rennin-angiotensin-aldosterone system blockade: is oral renin inhibition the solution? // Expert Opinion on Pharmacotherapy. - 2007. - № 8. - P.529-535.
- Шестакова М.В., Кошель Л.В., Вагодин В.А., Дедов И.И. Факторы риска прогрессирования диабетической нефропатии у больных с длительным течением сахарного диабета по данным ретроспектив- ного анализа // Тер. архив. - 2006. - № 5. - С. 26-28.
- Шамхалова М.Ш., Трубицына Н.П., Кацая Г.В., Гончаров Н.П., Малышева Н.М., Ильин А.В., Никанкина Л.В., Кошель Л.В., Шестакова М.В. Феномен частичного ускользания блокады ангиотензина II у больных сахарным диабетом 2 типа с диабетической нефропатией // Тер. архив. - 2008. - № 1. - С. 49-51.
- Sugimoto H., Grahovac G., Zeisberg M., Kalluri R. Renal fibrosis and glomerulosclerosis in a new mouse model of diabetic nephropathy and its regression by bone morphogenic protein-7 and advanced glycation end product inhibitors // Diabetes. - 2007. - № 56(7). - P. 1825-1833.
- Liu Y., Yang J. Hepatocyte growth factor: new arsenal in the fights against renal fibrosis? // Kidney Int. - 2006. - № 70. - P. 238-240.
- Moon J.A., Kim H.T. IN-1130, a novel transforming growth factorbeta type 1 receptor kinase (ALK5) inhibitor, suppresses renal fibrosis in obstructive nephropathy // Kidney Int. - 2006. - № 70. - P. 1234-1243.
- Meier M., Park J.K., Ovenhau D. et al. Deletion of protein kinase C-beta isoform in vivo reduces renal hypertrophy but not albuminuria in the streptozotocininduced diabetic mouse model // Diabetes. - 2007. - № 56. - P. 356-354.
- Chao J., Li H.J. Kinin infusion prevents renal inflammation, apoptosis, and fibrosis via inhibition of oxidative stress and mitogen-activated protein kinase activity // Hypertension. - 2007. - № 49. - P. 490-497.
- Chatziantoniou C., Dussaule J-C. Is kidney injury a reversible process? // Current Opinion in Nephrology and Hypertension. - 2008. - № 17. - P. 76-81.





