Вариабельность гликемии при сахарном диабете: инструмент для оценки качества гликемического контроля и риска осложнений


Published: Jan. 1, 2014
Latest article update: Nov. 23, 2022
Abstract
Стандартный подход к оценке эффективности лечения сахарного диабета (СД) по уровню гликированного гемоглобина (HbA.
1c) предполагает контроль среднего уровня гликемии, но не учитывает размаха и частоты ее колебаний. Разработка методов математического анализа осцилляций гликемии привела к созданию концепции вариабельности гликемии (ВГ) при СД. Интерес к изучению ВГ резко возрос с появлением технологий непрерывного мониторирования уровня глюкозы, давших возможность подробного изучения временной структуры гликемических кривых. В последние 5 десятилетий предложено множество различных методов оценки ВГ, характеризующих колебания гликемии в разных диапазонах значений, в разные временные отрезки, а также определяющих риск гипо- и гипергликемии. Накапливаются данные о значении ВГ как значимого предиктора диабетических осложнений СД. В ряде проспективных исследований установлено, что параметры ВГ имеют самостоятельное значение в прогнозировании диабетической ретинопатии, нефропатии и сердечно-сосудистых осложнений. Имеются данные о связи ВГ с выраженностью атеросклеротического поражения сосудов и исходом кардиоваскулярных заболеваний у пациентов с СД. Механизмы, лежащие в основе взаимосвязи между ВГ и сосудистыми осложнениями, интенсивно изучаются. Недавние исследования показали, что эффект ВГ на сосудистую стенку может реализоваться через окислительный стресс, хроническое воспаление, дисфункцию эндотелия. Средний уровень гликемии и ВГ являются самостоятельными предикторами гипогликемий у больных СД. Кроме того, повышенная ВГ ассоциирована с нарушением гормонального ответа на гипогликемию и может являться предиктором нарушенного распознавания гипогликемий в долгосрочной перспективе. Представленные данные дают основание считать, что применение математических методов анализа ВГ у пациентов с СД является перспективным инструментом для индивидуализированной оценки гликемического контроля, риска сосудистых осложнений и гипогликемий. Вероятно, уменьшение ВГ можно рассматривать как одну из терапевтических целей при лечении СД.
Keywords
Факторы риска, сахарный диабет, гипогликемия, вариабельность гликемии, непрерывный мониторинг гликемии, сосудистые осложнения
Совершенствование методов оценки качества контроля гликемии и прогнозирования риска сосудистых осложнений у больных сахарным диабетом (СД) остается одной из приоритетных задач диабетологии. Стандартный подход к оценке эффективности лечения СД по уровню гликированного гемоглобина (НbA1c) предполагает контроль среднего уровня гликемии, но не учитывает ее колебаний. Между тем, накапливаются данные о значении вариабельности гликемии (ВГ) как самостоятельного предиктора осложнений СД. Интерес к изучению ВГ резко возрос с появлением технологий непрерывного мониторирования глюкозы (НМГ), давших возможность подробного изучения временной структуры гликемических кривых. В настоящем обзоре мы обобщили данные литературы о методах оценки ВГ и клиническом значении данного параметра у больных СД.
МЕТОДЫ ОЦЕНКИ ВАРИАБЕЛЬНОСТИ ГЛИКЕМИИ
Начиная с 60-х гг. прошлого века, предложено около 30 различных критериев, характеризующих ВГ. Для вычисления этих критериев используются данные самоконтроля гликемии, а также результаты НМГ. Рассмотрим основные параметры, используемые для оценки ВГ.
Традиционной мерой ВГ является стандартное отклонение (standard deviation: SD), характеризующее степень разброса (дисперсии) значений гликемии. Данный параметр используется в большинстве работ. Производным критерием является коэффициент вариации (coefficient of variation: CV), показывающий, какой процент от среднего значения гликемии составляет SD. Еще одним часто используемым показателем является средняя амплитуда колебаний гликемии (mean amplitude of glycemic excursions: MAGE). При расчете MAGE игнорируются все колебания с амплитудой меньше 1 SD. Показатель MAGE обычно используется для анализа данных НМГ, в то время как SD и CV – для анализа результатов самоконтроля [1].Преимущество перечисленных методов оценки ВГ заключается в простоте вычислений и отсутствии специальных требований к частоте и длительности контроля гликемии. Недостаток – ограниченная информативность: данные параметры не учитывают частоту колебаний гликемии и не отражают того, в диапазоне каких значений (гипо-, гипер- или нормогликемии) эти колебания происходят.
Еще один часто применяемый показатель ВГ – площадь под кривой (area under the curve: AUC). Данный параметр наиболее информативен в оценке краткосрочных изменений гликемии, например, ее подъемов после еды [2, 3] или стандартной нагрузки глюкозой [4, 5]. В устройствах для НМГ площадь под кривой обычно рассчитывается автоматически.
Существует мера внутрисуточной ВГ, специально разработанная для анализа данных НМГ: непрерывное частично перекрывающееся изменение гликемии (continuous overlapping net glycemic action: CONGA). При расчете показателя определяются абсолютные разницы значений гликемии в данный момент времени и n часов назад. Различия гликемии рассчитываются для каждого определения после n часов мониторинга. Индекс CONGAn представляет собой величину дисперсии (стандартное отклонение) найденных различий [6].
Общим «слабым местом» традиционных показателей ВГ является недостаточная чувствительность к гипогликемиям. Для преодоления этого ограничения были разработаны новые критерии оценки ВГ. Индекс лабильности гликемии (lability index: LI) – показатель, специально созданный для оценки риска тяжелых гипогликемий. При расчете данного показателя разница между значениями гликемии определяется по каждым трем последовательным точкам (т.е. двум последовательным отрезкам). Вычисления за нужный период времени складываются и делятся на количество часов. При использовании вместе со специально разработанной шкалой HYPO (учитывающей частоту, тяжесть и нарушение распознавания гипогликемий), метод позволял классифицировать пациентов-кандидатов на трансплантацию островковых клеток по риску тяжелой гипогликемии в долгосрочной перспективе [7].
Тем не менее, для прогнозирования гипогликемии у конкретного пациента в ближайшем будущем приведенных выше методов оказывается недостаточно. В значительной степени это объясняется тем фактом, что шкала измерения гликемии является асимметричной: размах колебаний глюкозы в диапазоне гипергликемии заведомо больше, чем в диапазоне гипогликемии. Поэтому значения MAGE и ряда других вышеприведенных показателей больше коррелируют с частотой гипер-, чем гипогликемии [8]. Для решения проблемы, вызванной асимметрией шкалы, B.P. Kovatchev и соавт. предложили математическое преобразование (логарифмирование), которое делает шкалу гликемии симметричной относительно середины диапазона 3,9–10,0 ммоль/л. Кроме того, было предложено присваивать значение риска каждому уровню гликемии: уровню 6,0 ммоль/л присваивается риск 0, далее риск увеличивается по мере приближения к гипогликемическим значениям. Так появился индекс риска гипогликемии (low blood glucose index: LBGI), показавший высокую чувствительность к гипогликемиям и позволивший прогнозировать до 57% тяжелых гипогликемий [9]. Позже был введен аналогичный индекс риска гипергликемии (high blood glucose index: HBGI) [10], предложен показатель среднесуточный диапазон риска (average daily risk range: ADRR). Показатель ADRR является суммой рисков гипо- и гипергликемии, и потому высокочувствителен к обоим событиям. Важно, что при вычислении ADRR нормальным значениям гликемии присваивается меньший «весовой коэффициент» риска, поэтому колебания в пределах нормального диапазона менее существенны, чем за его пределами; напротив, отклонения в сторону экстремальной гипо- или гипергликемии получают возрастающие значения риска [8]. ADRR с успехом стал применяться для анализа данных НМГ. Этот показатель до сих пор остается одним их лучших в оценке качества контроля гликемии благодаря высокой чувствительности и прогностической ценности [11–13]. Кроме того, ADRR представляет собой основу для выделения категорий пациентов с разным риском лабильности гликемии [14].
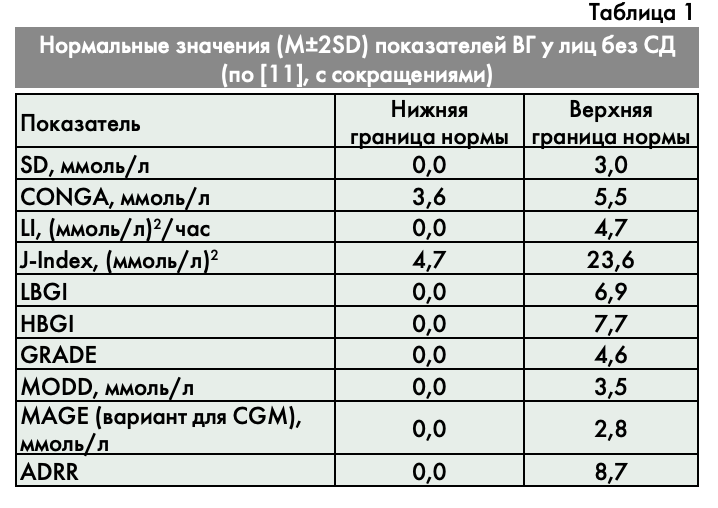
Присвоение каждому диапазону шкалы гликемии своего уровня риска используется и в других методах оценки ВГ. Например, уравнение оценки гликемического риска (glycaemic risk assessment diabetes equation: GRADE), также использует шкалу, созданную путем присвоения уровня риска каждой из 40 различных концентраций глюкозы. Шкала GRADE позволяет определить риск гипо- и гипергликемии для конкретного пациента, исходя из его гликемического профиля [15]. Заметим, что GRADE, ADRR, HBGI и LBGI скорее следует считать показателями качества гликемического контроля, нежели собственно параметрами ВГ.
Для оценки межсуточных колебаний гликемии предложен показатель различие суточных средних (mean of daily differences: MODD) [16].При его расчете вычисляются разницы между уровнями гликемии, измеренными в одно и то же время в течение двух последовательных дней; полученные разницы усредняются. Показатель MODD используется при анализе данных самоконтроля гликемии или НМГ [1]. Предлагается оценивать и более долгосрочную («крупноволновую») ВГ – например, по изменениям уровня НbA1c [17, 18].
Для самых распространенных показателей ВГ определены границы нормы (табл. 1). Нормативные показатели получены при анализе результатов 72-часового НМГ у 78 здоровых лиц [11]. В недавнем исследовании было показано, что ВГ увеличивается по мере усугубления инсулинорезистентности и нарушения функции β-клеток у пациентов с нарушенной толерантностью к глюкозе, нарушенной гликемией натощак и у больных СД 2 типа (СД2). Средняя гликемия, SD, HGBI, CONGA, MODD и MAGE значимо повышаются с увеличением градаций нарушений углеводного обмена от нормы до СД [19].
Таким образом, в настоящее время разработаны методы оценки ВГ, позволяющие количественно судить о колебаниях гликемии в разных диапазонах значений и в разные временные отрезки. Параметры ВГ могут использоваться для индивидуализации оценки гликемического профиля у пациентов с СД.
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ВАРИАБЕЛЬНОСТИ ГЛИКЕМИИ
Риск сосудистых осложнений
С конца 90-х годов XX в. стали накапливаться данные о связи ВГ с развитием диабетических ангиопатий. Анализ данных исследования DCCT (Diabetes Control and Complication Trial) показал связь долгосрочной ВГ, определенной по изменениям уровня НbA1c, с риском развития микрососудистых осложнений. Вариабельность НbA1c определялась у 1441 пациента с СД 1 типа (СД1), прогрессирование осложнений оценивалось в течение 9 лет. Увеличение SD уровня НbA1c на 1% оказалось ассоциированным с повышением риска ретинопатии (HR=2,26, р<0,0001) и нефропатии (HR=1,8, р<0,0001).Средний уровень НbA1c также являлся предиктором развития данных осложнений [17]. На риск развития диабетических микроангиопатий не оказывали влияния показатели ВГ (AUCи SD), рассчитанные по результатам ежеквартального уровня пре- и постпрандиальной гликемии в 7 точках. Таким образом, вклад краткосрочной ВГ в развитие микроангиопатий у пациентов, участвовавших в DCCT, не был доказан [20]. Анализ результатов наблюдательной фазы, последовавшей за DCCT (проект EDIC), показал, что риск развития ретинопатии и нефропатии к 4-му году после завершения DCCT все еще зависел от среднего уровня гликемии и НbA1c в течение активного периода исследования. Отсроченного влияния показателей ВГ на риск развития микрососудистых осложнений выявить не удалось [21].
В проспективном наблюдательном исследовании FinnDiane (Finnish Diabetic Nephropathy Study), включавшем 2107 больных СД1, вариабельность (SD) НbA1c была ассоциирована с риском прогрессирования диабетической нефропатии (HR=1,92, p<0,001) и сердечно-сосудистыми осложнениями (HR=1,98, p<0,001). Данная ассоциация сохраняла значимость после учета среднего уровня НbA1c и «традиционных» факторов риска. Средний уровень НbA1c не являлся предиктором прогрессирования осложнений в течение 5,7 лет наблюдения [18]. В рамках данного проекта изучено влияние вариабельности НbA1c на риск прогрессирования ретинопатии. Установлено, что пациенты с наибольшей вариабельностью НbA1c (в пределах верхнего квартиля) имеют более высокий риск развития пролиферативной ретинопатии (HR=1,7, p<0,01) и большую вероятность лазерной фотокоагуляции сетчатки (HR=1,6, p=0,02) по сравнению с пациентами с вариабельностью НbA1c в пределах нижнего квартиля [22].
В проспективном наблюдательном исследовании Verona Diabetes Study, включавшем 1409 пациентов с СД2, ВГ (CV) оказалась независимым предиктором смерти от СД, сердечно-сосудистых осложнений и рака в течение 10 лет наблюдения [23]. У пожилых больных смертность от сердечно-сосудистой патологии была ассоциирована с вариабельностью (но не с уровнем) гликемии натощак. Высокие значения ВГ (в пределах верхней трети диапазона) повышали риск смерти от сердечно-сосудистых причин в 2,4 раза [24].
В ряде небольших исследований получены данные о взаимосвязи ВГ с наличием атеросклероза, ИБС и ее осложнений. У больных СД2 установлена прямая связь между показателями ВГ, рассчитанными по результатам НМГ, и толщиной комплекса интима-медиа сонных артерий [25, 26]. У пациентов с СД2 с ангиографически верифицированной ИБС величина колебаний гликемии (MAGE) оказалась независимым предиктором степени коронарного атеросклероза, наряду с возрастом, уровнем С-реактивного белка и НbA1c [27]. Показано, что высокая амплитуда суточных колебаний гликемии (MAGE >5 ммоль/л) в 2,3 раза повышает вероятность развития желудочковых аритмий высоких градаций у пациентов с СД2 [28]. У пожилых пациентов величина MAGE, вычисленная по показателям НМГ, является более мощным по сравнению с НbA1c предиктором риска неблагоприятных сердечно-сосудистых событий (инфаркт миокарда, острая сердечная недостаточность, смерть) в течение первого года после инфаркта миокарда [29, 30]. У больных СД, перенесших аортокоронарное шунтирование, высокая ВГ ассоциирована с риском осложнений в послеоперационном периоде [31].
Механизмы влияния колебаний гликемии на сосудистую стенку не вполне ясны. В условиях in vitro установлено, что транзиторная гипергликемия повышает продукцию свободных радикалов в эндотелиальных клетках человека и усиливает апоптоз [32]. Однако у больных СД1 не выявлено связи между показателями ВГ (MODD, MAGE, CONGA), рассчитанными по данным НМГ, и экскрецией с мочой маркера оксидативного стресса 15(S)-8-изопростагландина [33]. Вместе с тем, моделирование колебаний гликемии у здоровых лиц и у больных СД2 в условиях эуинсулинемического гипергликемического клэмпа показало, что периодические подъемы концентрации глюкозы от 5 до 15 ммоль/л в большей степени, чем стабильная гипергликемия на уровне 10 или 15 ммоль/л, активируют свободнорадикальные процессы и ухудшают поток-зависимую вазодилатацию [34]. Повторные пики гипергликемии у животных с СД в большей степени повышали адгезию моноцитов к сосудистому эндотелию, чем стабильная гипергликемия [35]. «Пики» гипергликемии могут оказывать пролонгированный эффект на эндотелиоциты за счет эпигенетических модификаций регуляторных областей генов. Показано, что в эндотелиоцитах аорты транзиторная гипергликемия индуцирует эпигенетические модификации промотора гена субъединицы р65 ядерного фактора NF-kB, приводящие к активации фактора и к усилению экспрессии зависимых от него медиаторов воспаления (MCP-1, VCAM-1). Эффекты подъема уровня глюкозы опосредованы через усиление продукции свободных радикалов и сохраняются на протяжении 6 дней последующей нормогликемии [36]. Представляется вероятным, что «пики» гипергликемии могут индуцировать длительные, самоподдерживающиеся процессы в сосудах: окислительный стресс и хроническое воспаление, играющие важную роль в феномене «метаболической памяти» и развитии диабетических ангиопатий [37, 38].
В настоящее время доказана роль НbA1c как предиктора сосудистых осложнений СД. В ряде исследований изучена взаимосвязь между уровнем НbA1c и параметрами ВГ. Сопоставление уровня НbA1c, среднего уровня и SD значений гликемии, полученных при самоконтроле в течение трех месяцев у больных СД1 и СД2, показало, что на уровень НbA1c оказывает влияние средний уровень гликемии, но не ее вариабельность [39]. У пациентов с СД2, имеющих хороший гликемический контроль (НbA1c<7%), уровень НbA1c не коррелировал с параметрами ВГ (градации SD, MAGE), рассчитанными по данным НМГ [40].
Таким образом, уровень НbA1c и ВГ являются взаимодополняющими характеристиками гликемического контроля. Анализ значимости ВГ в прогностических моделях сосудистых осложнений следует осуществлять с учетом предиктивного эффекта НbA1c. На сегодняшний день вопрос о влиянии ВГ на риск развития микро- и макрососудистых осложнений СД нельзя считать решенным. Это обусловлено относительно небольшим количеством исследований и противоречивостью полученных в них результатов. Последнее связано с различиями клинических и экспериментальных моделей и использованием разных подходов к анализу ВГ. Установление роли ВГ в развитии диабетических ангиопатий – перспективное направление для дальнейших исследований.
Риск гипогликемий
Как показал анализ данных DCCT, НbA1c, средний уровень гликемии и ВГ (SD) являются самостоятельными, взаимодополняющими предикторами гипогликемий у больных СД1. Повышение ВГ при этом ассоциировано с риском повторных гипогликемий. C учетом эффекта НbA1c, увеличение SD гликемии на 1 ммоль/л повышает риск первого эпизода гипогликемии в 1,09 раза, пятого эпизода – в 1,12 раза [41]. Более высокие значения и вариабельность НbA1c ассоциированы с риском гипогликемий у больных СД, получающих лечение гемодиализом [42]. По нашим данным, SD значений гликемии, зафиксированных при двухдневном НМГ, является предиктором гипогликемических эпизодов у пожилых больных СД2, получающих инсулин [43].
Имеются данные, что увеличенная ВГ у больных СД связана с нарушением физиологического ответа на гипогликемию и нарушением распознавания гипогликемий. Как показало моделирование гипогликемии в условиях гиперинсулинемического клэмпа, у больных СД1 параметры ВГ (показатели ADRR, LBGI), определенные по результатам самоконтроля глюкозы крови в течение месяца, отрицательно коррелируют с выраженностью адреналового ответа на гипогликемию [13]. Известно, что ответ надпочечников и вегетативной нервной системы на гипогликемию может снижаться при любом типе СД. Это приводит к повторным гипогликемиям и формированию порочного круга, резко повышая ВГ. Даже единичный эпизод гипогликемии в вечернее время у больных СД1 нарушает адреналовый ответ и выраженность симптомов гипогликемии на следующее утро [44]. Аналогично, перенесенная накануне гипогликемия у больных СД2 приводит к запаздыванию выброса глюкагона, катехоламинов и к уменьшению выраженности адренергических и нейрогликопенических симптомов во время гипогликемии на следующий день: недавняя предшествующая гипогликемия приводит не только к нарушению в системе контррегуляции, но и к нераспознаванию гипогликемий. Установлено, что повышенная чувствительность к инсулину, повышенный риск гипогликемии и сниженный адреналовый ответ на гипогликемию, измеряемый биохимически, связаны с увеличенной ВГ (ADRR, LI, LBGI) независимо от уровня НbA1c [45]. Описанными особенностями можно объяснить тот факт, что приступы тяжелой гипогликемии у больных СД1 чаще происходят в периоды повышенной ВГ, которые можно ретроспективно наблюдать по данным самоконтроля. B.P. Kovatchev и соавт. показали наличие таких периодов продолжительностью 48 ч перед тяжелой гипогликемией и после нее [9]. Вычисление SD значений глюкозы крови, полученных пациентами с СД1 при самоконтроле в течение месяца (100 определений), позволяет предсказать формирование феномена нарушенного распознавания гипогликемий через 11 лет течения заболевания [46].
Представленные данные дают основание считать, что применение методов анализа ВГ у пациентов с СД является ценным инструментом для индивидуализации риска развития гипогликемий.
ЗАКЛЮЧЕНИЕ
Оценка ВГ является перспективным подходом к оценке эффективности управления СД. Накопленные к настоящему времени данные дают основания предполагать, что использование параметров ВГ, в совокупности с уровнем НbA1c и другими традиционными факторами риска, способно повышать точность прогноза развития сосудистых осложнений и гипогликемий. Вероятно, уменьшение ВГ можно рассматривать как одну из терапевтических целей при лечении СД. По предварительным данным, задаче уменьшения ВГ соответствует применение аналогов инсулина [47], инсулиновых помп [48], инкретинов и инкретиномиметиков [49, 50], НМГ в режиме реального времени [51]. В будущих исследованиях необходимо определить наиболее информативные показатели ВГ, пригодные для оценки качества контроля гликемии и риска осложнений в различных клинических ситуациях. Требуют дальнейшего изучения механизмы реализации эффекта колебаний гликемии на формирование осложнений и исходов СД. Влияние различных режимов сахароснижающей терапии на ВГ предстоит оценить в рандомизированных клинических исследованиях.
ИНФОРМАЦИЯ О ФИНАНСИРОВАНИИ И КОНФЛИКТЕ ИНТЕРЕСОВ
Работа выполнена в рамках проекта, поддержанного грантом Российского научного фонда (14-15-00082).
Авторы декларируют отсутствие конфликта интересов, связанных с рукописью.
СПИСОК ЛИТЕРАТУРЫ
- Siegelaar SE, Holleman F, Hoekstra JBL, DeVries JH. Glucose Variability; Does It Matter. Endocrine Reviews 2010;31(2):171-182. Available from: http://press.endocrine.org/doi/abs/10.1210/er.2009-0021https://doi.org/10.1210/er.2009-0021.
- Di Flaviani A, Picconi F, Di Stefano P, Giordani I, Malandrucco I, Maggio P, et al. Impact of Glycemic and Blood Pressure Variability on Surrogate Measures of Cardiovascular Outcomes in Type 2 Diabetic Patients. Diabetes Care 2011;34(7):1605-1609. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/dc11-0034PubMed PMID:21610126.https://doi.org/10.2337/dc11-0034.
- Herrero P, Bondia J, Palerm CC, Vehi J, Georgiou P, Oliver N, et al. A Simple Robust Method for Estimating the Glucose Rate of Appearance from Mixed Meals. Journal of Diabetes Science and Technology 2012;6(1):153-162. Available from: http://dst.sagepub.com/lookup/doi/10.1177/193229681200600119PubMed PMID:22401334.https://doi.org/10.1177/193229681200600119.
- Monnier L, Mas E, Ginet C, Michel F, Villon L, Cristol J, et al. Activation of Oxidative Stress by Acute Glucose Fluctuations Compared With Sustained Chronic Hyperglycemia in Patients With Type 2 Diabetes. JAMA 2006;295(14):1681-1687. Available from: http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.295.14.1681PubMed PMID:16609090.https://doi.org/10.1001/jama.295.14.1681.
- Древаль АВ, Редькин ЮА, Богомолов ВВ. Корреляция уровня HbA1c и постпрандиальной гликемии в пероральном тесте толерантности к глюкозе у больных сахарным диабетом 2-го типа. Проблемы эндокринологии. 2007;53(1):10-8. [Dreval' AV, Red'kin AR, Bogomolov VV. Correlation Level of HbA1c and postprandial glycemia in type 2 diabetes in the oral glucose tolerance test. Problemy endokrinologii 2007;53(1):10-18.]
- McDonnell CM, Donath SM, Vidmar SI, Werther GA, Cameron FJ. A Novel Approach to Continuous Glucose Analysis Utilizing Glycemic Variation. Diabetes Technology & Therapeutics 2005;7(2):253-263. Available from: http://online.liebertpub.com/doi/abs/10.1089/dia.2005.7.253PubMed PMID:15857227.https://doi.org/10.1089/dia.2005.7.253.
- Ryan EA, Shandro T, Green K, Paty BW, Senior PA, Bigam D, et al. Assessment of the Severity of Hypoglycemia and Glycemic Lability in Type 1 Diabetic Subjects Undergoing Islet Transplantation. Diabetes 2004;53(4):955-962. Available from: http://diabetes.diabetesjournals.org/cgi/doi/10.2337/diabetes.53.4.955PubMed PMID:15047610.https://doi.org/10.2337/diabetes.53.4.955.
- Kovatchev BP, Otto E, Cox D, Gonder-Frederick L, Clarke W. Evaluation of a new measure of blood glucose variability in diabetes.. Diabetes Care 2006;29(11):2433-2438. Available from: http://www.scholaruniverse.com/ncbi-linkout?id=17065680PubMed PMID:17065680.https://doi.org/10.2337/dc06-1085.
- Kovatchev BP, Cox DJ, Farhy LS, Straume M, Gonder-Frederick L, Clarke WL. Episodes of severe hypoglycemia in type 1 diabetes are preceded and followed within 48 hours by measurable disturbances in blood glucose. J Clin Endocrinol Metab 2000;85(11):4287-4292. Available from: http://www.nlm.nih.gov/medlineplus/bloodsugar.htmlPubMed PMID:11095469.https://doi.org/10.1210/jcem.85.11.6999.
- Kovatchev BP, Cox DJ, Kumar A, Gonder-Frederick L, Clarke WL. Algorithmic Evaluation of Metabolic Control and Risk of Severe Hypoglycemia in Type 1 and Type 2 Diabetes Using Self-Monitoring Blood Glucose Data. Diabetes Technology & Therapeutics 2003;5(5):817-828. Available from: http://online.liebertpub.com/doi/abs/10.1089/152091503322527021PubMed PMID:14633347.https://doi.org/10.1089/152091503322527021.
- HillNR, NickSO, ChoudharyP, LevyJC, HindmarshP, MatthewsDR . Normal Reference Range for Mean Tissue Glucose and Glycemic Variability Derived from Continuous Glucose Monitoring for Subjects Without Diabetes in Different Ethnic Groups. Diabetes Technol Ther 2011;13(9):921-928. Available from: http://online.liebertpub.com/doi/abs/10.1089/dia.2010.0247PubMed PMID:21714681.https://doi.org/10.1089/dia.2010.0247.
- Kohnert KD, Vogt L, Augstein P, Heinke P, Zander E, Peterson K, et al. Relationships between Glucose Variability and Conventional Measures of Glycemic Control in Continuously Monitored Patients with Type 2 Diabetes. Horm Metab Res 2009;41(02):137-141. Available from: http://www.thieme-connect.de/DOI/DOI?10.1055/s-0028-1128143PubMed PMID:19214924.https://doi.org/10.1055/s-0028-1128143.
- Pitsillides AN, Anderson SM, Kovatchev B. Hypoglycemia Risk and Glucose Variability Indices Derived from Routine Self-Monitoring of Blood Glucose Are Related to Laboratory Measures of Insulin Sensitivity and Epinephrine Counterregulation. Diabetes Technology & Therapeutics 2011;13(1):11-17. Available from: http://online.liebertpub.com/doi/abs/10.1089/dia.2010.0103PubMed PMID:21175266.https://doi.org/10.1089/dia.2010.0103.
- Patton SR, Clements MA. Average daily risk range as a measure for clinical research and routine care. J Diabetes Sci Technol 2013;7(5):1370-1375. PubMed PMID:24124966.
- Hill NR, Hindmarsh PC, Stevens RJ, Stratton IM, Levy JC, Matthews DR. A method for assessing quality of control from glucose profiles. Diabetic Med 2007;24(7):753-758. Available from: http://doi.wiley.com/10.1111/j.1464-5491.2007.02119.xhttps://doi.org/10.1111/j.1464-5491.2007.02119.x.
- Molnar GD, Taylor WF, Ho MM. Day-to-day variation of continuously monitored glycaemia: A further measure of diabetic instability. Diabetologia 1972;8(5):342-348. Available from: http://link.springer.com/10.1007/BF01218495PubMed PMID:4641791.https://doi.org/10.1007/BF01218495.
- Kilpatrick ES, Rigby AS, Atkin SL. A1C Variability and the Risk of Microvascular Complications in Type 1 Diabetes: Data from the Diabetes Control and Complications Trial. Diabetes Care 2008;31(11):2198-2202. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/dc08-0864PubMed PMID:18650371.https://doi.org/10.2337/dc08-0864.
- Waden J, Forsblom C, Thorn LM, Gordin D, Saraheimo M, Groop PH. A1C Variability Predicts Incident Cardiovascular Events, Microalbuminuria, and Overt Diabetic Nephropathy in Patients With Type 1 Diabetes. Diabetes 2009;58(11):2649-2655. Available from: http://diabetes.diabetesjournals.org/cgi/doi/10.2337/db09-0693PubMed PMID:19651819.https://doi.org/10.2337/db09-0693.
- Chen T, Xu F, Su J, Wang X, Chen J, Wu G, et al. Glycemic variability in relation to oral disposition index in the subjects with different stages of glucose tolerance. Diabetol Metab Syndr 2013;5(1):38. Available from: http://www.dmsjournal.com/content/5/1/38PubMed PMID:23876034.https://doi.org/10.1186/1758-5996-5-38.
- Kilpatrick ES, Rigby AS, Atkin SL. The Effect of Glucose Variability on the Risk of Microvascular Complications in Type 1 Diabetes. Diabetes Care 2006;29(7):1486-1490. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/dc06-0293PubMed PMID:16801566.https://doi.org/10.2337/dc06-0293.
- Kilpatrick ES, Rigby AS, Atkin SL. Effect of Glucose Variability on the Long-Term Risk of Microvascular Complications in Type 1 Diabetes. Diabetes Care 2009;32(10):1901-1903. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/dc09-0109PubMed PMID:19549736.https://doi.org/10.2337/dc09-0109.
- Hietala K, Wadén J, Forsblom C, Harjutsalo V, Kytö J, Summanen P, et al. HbA1c variability is associated with an increased risk of retinopathy requiring laser treatment in type 1 diabetes. Diabetologia 2013;56(4):737-745. Available from: http://link.springer.com/10.1007/s00125-012-2816-6PubMed PMID:23314044.https://doi.org/10.1007/s00125-012-2816-6.
- Muggeo M, Zoppini G, Bonora E, Brun E, Bonadonna RC, Moghetti P, et al. Fasting plasma glucose variability predicts 10-year survival of type 2 diabetic patients: the Verona Diabetes Study. Diabetes Care 2000;23(1):45-50. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/diacare.23.1.45PubMed PMID:10857967.https://doi.org/10.2337/diacare.23.1.45.
- Muggeo M, Verlato G, Bonora E, Zoppini G, Corbellini M, deMarco R. Long-term Instability of Fasting Plasma Glucose, a Novel Predictor of Cardiovascular Mortality in Elderly Patients With Non Insulin-Dependent Diabetes Mellitus : The Verona Diabetes Study. Circulation 1997;96(6):1750-1754. Available from: http://circ.ahajournals.org/cgi/doi/10.1161/01.CIR.96.6.1750https://doi.org/10.1161/01.CIR.96.6.1750.
- Mo Y, Zhou J, Li M, Wang Y, Bao Y, Ma X, et al. Glycemic variability is associated with subclinical atherosclerosis in Chinese type 2 diabetic patients. Cardiovasc Diabetol 2013;12(1):15-1186. Available from: http://www.cardiab.com/content/12/1/15PubMed PMID:23316958.https://doi.org/10.1186/1475-2840-12-15.
- Zhang X, Xu X, Jiao X, Wu J, Zhou S, Lv X. The effects of glucose fluctuation on the severity of coronary artery disease in type 2 diabetes mellitus. J Diabetes Res 2013;2013:576916-1155. Available from: https://doi.org/10.1155/2013/576916PubMed PMID:23936867.https://doi.org/10.1155/2013/576916.
- Su G, Mi S, Tao H, Li Z, Yang H, Zheng H, et al. Association of glycemic variability and the presence and severity of coronary artery disease in patients with type 2 diabetes. Cardiovasc Diabetol 2011;10(1):19-1186. Available from: http://www.cardiab.com/content/10/1/19PubMed PMID:21349201.https://doi.org/10.1186/1475-2840-10-19.
- Починка ИГ, Стронгин ЛГ, Стручкова ЮВ. Вариабельность гликемии и желудочковые нарушения ритма у больных с хронической сердечной недостаточностью, страдающих сахарным диабетом 2 типа. Кардиология. 2013;53(9):47-51. [Pochinka IG, Strongin LG, Struchkova Yu V . Variability of Glycemia and Ventricular Rhythm Disturbances in Patients With Chronic Heart Failure and Type 2 Diabetes Mellitus. Kardiologiia 2013;53(9):47-51.].
- Su G, Mi S, Li Z, Tao H, Yang H, Zheng H. Prognostic value of early in-hospital glycemic excursion in elderly patients with acute myocardial infarction. Cardiovasc Diabetol 2013;12(1):33. Available from: http://www.cardiab.com/content/12/1/33https://doi.org/10.1186/1475-2840-12-33.
- Su G, Mi SH TH, Li Z, Yang HX, Zheng H, Zhou Y, et al. Impact of Admission Glycemic Variability, Glucose, and Glycosylated Hemoglobin on Major Adverse Cardiac Events After Acute Myocardial Infarction. Diabetes Care 2013;36(4):1026-1032. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/dc12-0925PubMed PMID:23349547.https://doi.org/10.2337/dc12-0925.
- Subramaniam B, Lerner A, Novack V, Khabbaz K, Paryente-Wiesmann M, Hess P, et al. Increased Glycemic Variability in Patients with Elevated Preoperative HbA1C Predicts Adverse Outcomes Following Coronary Artery Bypass Grafting Surgery. Anesthesia & Analgesia 2014;118(2):277-287. Available from: http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage&an=00000539-201402000-00008PubMed PMID:24445629.https://doi.org/10.1213/ANE.0000000000000100.
- Piconi L, Quagliaro L, Assaloni R, Da Ros R, Maier A, Zuodar G, et al. Constant and intermittent high glucose enhances endothelial cell apoptosis through mitochondrial superoxide overproduction. Diabetes Metab. Res. Rev 2006;22(3):198-203. Available from: http://doi.wiley.com/10.1002/dmrr.613PubMed PMID:16453381.https://doi.org/10.1002/dmrr.613.
- WentholtI ME, Kulik W, Michels RPJ, HoekstraJ BL, DeVries JH. Glucose fluctuations and activation of oxidative stress in patients with type 1 diabetes. Diabetologia 2008;51(1):183-190.
- Ceriello A, Esposito K, Piconi L, Ihnat MA, Thorpe JE, Testa R, et al. Oscillating Glucose Is More Deleterious to Endothelial Function and Oxidative Stress Than Mean Glucose in Normal and Type 2 Diabetic Patients. Diabetes 2008;57(5):1349-1354. Available from: http://diabetes.diabetesjournals.org/cgi/doi/10.2337/db08-0063PubMed PMID:18299315.https://doi.org/10.2337/db08-0063.
- Azuma K. Repetitive Fluctuations in Blood Glucose Enhance Monocyte Adhesion to the Endothelium of Rat Thoracic Aorta. Arteriosclerosis, Thrombosis, and Vascular Biology 2006;26(10):2275-2280. Available from: http://atvb.ahajournals.org/cgi/doi/10.1161/01.ATV.0000239488.05069.03PubMed PMID:16888238.https://doi.org/10.1161/01.ATV.0000239488.05069.03.
- El-Osta A, Brasacchio D, Yao D, Pocai A, Jones PL, Roeder RG, et al. Transient high glucose causes persistent epigenetic changes and altered gene expression during subsequent normoglycemia. Journal of Experimental Medicine 2008;205(10):2409-2417. Available from: http://www.jem.org/cgi/doi/10.1084/jem.20081188https://doi.org/10.1084/jem.20081188.
- Ceriello PA. OXIDATIVE STRESS AND DIABETES-ASSOCIATED COMPLICATIONS. Endocrine Practice 2006;12(s1):60-62. Available from: https://doi.org/://aace.metapress.com/openurl.asp?genre=article&id=doi:10.4158/EP.12.S1.60PubMed PMID:16627383.https://doi.org/10.4158/EP.12.S1.60.
- Бондарь ИА, Климонтов ВВ. Иммуновоспалительные механизмы в формировании диабетической нефропатии. Проблемы эндокринологии. 2007;53(2):34-40. [Bondar' IA, Klimontov VV. Immune inflammatory mechanisms in the development of diabetic nephropathy. Problemy endokrinologii. 2007;53(2):34-40.]
- Derr R, Garrett E, Stacy GA, Saudek CD. Is HbA1c Affected by Glycemic Instability. Diabetes Care 2003;26(10):2728-2733. Available from: http://care.diabetesjournals.org/cgi/doi/10.2337/diacare.26.10.2728PubMed PMID:14514571.https://doi.org/10.2337/diacare.26.10.2728.
- Kohnert K, Augstein P, Heinke P, Zander E, Peterson K, Freyse E, et al. Chronic hyperglycemia but not glucose variability determines HbA1c levels in well-controlled patients with type 2 diabetes. Diabetes Research and Clinical Practice 2007;77(3):420-426. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0168822707000599https://doi.org/10.1016/j.diabres.2007.01.021.
- Kilpatrick ES, Rigby AS, Goode K, Atkin SL. Relating mean blood glucose and glucose variability to the risk of multiple episodes of hypoglycaemia in type 1 diabetes. Diabetologia 2007;50(12):2553-2561. Available from: http://link.springer.com/10.1007/s00125-007-0820-zPubMed PMID:17882397.https://doi.org/10.1007/s00125-007-0820-z.
- Williams ME, Garg R, Wang W, Lacson R, Maddux F, Lacson E. High Hemoglobin A1c levels and glycemic variability increase risk of severe hypoglycemia in diabetic hemodialysis patients. Hemodial Int 2013;18(2):423-432. Available from: http://doi.wiley.com/10.1111/hdi.12110PubMed PMID:24274900.https://doi.org/10.1111/hdi.12110.
- Klimontov VV, Tsiberkin AI, Fazullina ON, Prudnikova MA, Tyan NV, Konenkov VI. Glucose variability and hypoglycaemic excursions in elderly type 2 diabetic patients treated with insulin. Diabetologia 2013;56(Suppl.1):239.
- Dagogo-Jack SE, Craft S, Cryer PE. Hypoglycemia-associated autonomic failure in insulin-dependent diabetes mellitus. Recent antecedent hypoglycemia reduces autonomic responses to, symptoms of, and defense against subsequent hypoglycemia. J. Clin. Invest 1993;91(3):819-828. Available from: http://www.jci.org/articles/view/116302PubMed PMID:8450063.https://doi.org/10.1172/JCI116302.
- Pitsillides AN, Anderson SM, Kovatchev B. Hypoglycemia Risk and Glucose Variability Indices Derived from Routine Self-Monitoring of Blood Glucose Are Related to Laboratory Measures of Insulin Sensitivity and Epinephrine Counterregulation. Diabetes Technology & Therapeutics 2011;13(1):11-17. Available from: http://online.liebertpub.com/doi/abs/10.1089/dia.2010.0103PubMed PMID:21175266.https://doi.org/10.1089/dia.2010.0103.
- Bragd J, Adamson U, Bäcklund LB, Lins PE, Moberg E, Oskarsson P. Can glycaemic variability, as calculated from blood glucose self-monitoring, predict the development of complications in type 1 diabetes over a decade. Diabetes & Metabolism 2008;34(6):612-616. Available from: http://linkinghub.elsevier.com/retrieve/pii/S1262363608001651https://doi.org/10.1016/j.diabet.2008.04.005.
- Pérez-Maraver M, Caballero-Corchuelo J, Boltana A, Insa R, Soler J, Montanya E. Comparison of human insulin and insulin analogues on hypoglycaemia and metabolic variability in type 1 diabetes using standardized measurements (HYPO score and Lability Index. Acta Diabetol 2013;50(4):529-535. Available from: http://link.springer.com/10.1007/s00592-011-0320-yhttps://doi.org/10.1007/s00592-011-0320-y.
- Bruttomesso D, Crazzolara D, Maran A, Costa S, Dal Pos M , Girelli A, et al. In Type 1 diabetic patients with good glycaemic control, blood glucose variability is lower during continuous subcutaneous insulin infusion than during multiple daily injections with insulin glargine. Diabet Med 2008;25(3):326-332. Available from: http://www.nlm.nih.gov/medlineplus/bloodsugar.htmlPubMed PMID:18307459.https://doi.org/10.1111/j.1464-5491.2007.02365.x.
- McCall AL, Cox DJ, Brodows R, Crean J, Johns D, Kovatchev B. Reduced Daily Risk of Glycemic Variability: Comparison of Exenatide with Insulin Glargine. Diabetes Technology & Therapeutics 2009;11(6):339-344. Available from: http://online.liebertpub.com/doi/abs/10.1089/dia.2008.0107PubMed PMID:19459761.https://doi.org/10.1089/dia.2008.0107.
- Shimoda S, Iwashita S, Ichimori S, Matsuo Y, Goto R, Maeda T, et al. Efficacy and safety of sitagliptin as add-on therapy on glycemic control and blood glucose fluctuation in Japanese type 2 diabetes subjects ongoing with multiple daily insulin injections therapy. Endocr J 2013;60(10):1207-1214. Available from: http://jlc.jst.go.jp/DN/JST.JSTAGE/endocrj/EJ13-0198?lang=en&from=CrossRef&type=abstractPubMed PMID:23912974.https://doi.org/10.1507/endocrj.EJ13-0198.
- Rodbard D, Bailey T, Jovanovic L, Zisser H, Kaplan R, Garg SK. Improved Quality of Glycemic Control and Reduced Glycemic Variability with Use of Continuous Glucose Monitoring. Diabetes Technology & Therapeutics 2009;11(11):717-723. Available from: http://online.liebertpub.com/doi/abs/10.1089/dia.2009.0077PubMed PMID:19905888.https://doi.org/10.1089/dia.2009.0077.





