Взаимосвязь показателей интерлейкинового профиля и оксидантной системы крови у пожилых больных возрастной макулярной дегенерацией с поздней стадией


Published: Jan. 1, 2020
Latest article update: Sept. 19, 2022
Abstract
В пожилом возрасте возрастная макулярная дегенерация имеет высокую распространённость и часто вызывает снижение и полную потерю зрения. Однако иммунологические механизмы развития данной патологии и их связь с изменениями оксидантной системы у пожилых больных остаются недостаточно изученными. Цель исследования: Анализ взаимосвязей показателей интерлейкинового профиля и оксидантной системы сыворотки крови у пожилых больных возрастной макулярной дегенерацией с поздней стадией (AREDS-4). Материалы и методы: Уровень сывороточных интерлейкинов и показатели оксидантной системы изучены у 57 больных в возрасте 60-74 года с возрастной макулярной дегенерацией 4-й стадии. Контролем служили 52 человека аналогичного возраста без указанной выше патологии. Содержание интерлейкинов определяли на проточном цитометре BD FACS Canto 2, а перекисное окисление липидов – на спектрофотометре СФ-16. Результаты: Установлено достоверное повышение анализированных сывороточных интерлейкинов и в большей степени IL-1β,IL-8 группы больных с возрастной макулярной дегенерациией в сравнении с возрастным контролем. Содержание противовоспалительных интерлейкинов и интерферонов-α, ɣ достоверно снизилось у пациентов с рассматриваемым заболеванием, уровень продуктов перекисного окисления липидов статистические значило повысился. Между противовоспалительными интерлейкинами и показателями оксидантной системы выявлены обратные корреляционные связи, с изменением противовоспалительных интерлейкинов и показателей свободнорадикального окисления имеются обратные связи. Заключение: В результате проведенного исследования установлены особенности интерлейкинового профиля и оксидантной системы сыворотки крови у пожилых больных возрастной макулярной дегенерацией с поздней стадией, учет которых позволит рационализировать диагностику и патогенетическую терапию при возрастной макулярной дегенерации у пожилых.
Keywords
Оксидантная система, возрастная макулярная дегенерация, пожилые, интерлейкины крови
Введение.
В пожилом возрасте возрастная макулярная дегенерация( ВМД) считается распространённой патологией и ведущей причиной в структуре патологии органа зрения и слепоты [1-5]. По данным Всемирной организации здравоохранения количество больных ВМД в мире стремительно возрастает и по прогнозным оценкам к 2020 г. уровень заболеваемости ВМД увеличится на треть [6, 7]. ВМД является наиболее распространённым заболеванием в США, где число пациентов составляет около 3 миллионов [8]. В Китае высокая заболеваемость ВМД служит основной причиной инвалидности [5]. В Швеции среди жителей в возрасте 40 лет и ставшие в течение исследуемого периода выявлено 707 341 случаев заболеваний глаза и 20,9% приходилось на ВМД, что соответствует второму месту после катаракты [9]. Среди финского населения ВМД обнаружена в 13,8% случаев у населения старше 30 лет [10]. У пожилых людей в Непале ВМД достигает 38,4% [11, 12]. В России заболеваемость ВМД составляет более 150 случаев на 10 000 населения. Проведенное нами ранее исследование выявило повышение частоты ВМД в Тамбовской области с 1,38 случаев в 2010 г. до 2,28 случаев на 10 000 населения в 2015 г. [13]. В связи с увеличением доли пожилых в структуре общества негативная тенденция в уровне ВМД сохранится, что, безусловно указывает на приоритетность исследования гериатрических аспектов ВМД [2].
Актуальным направлением в изучении ВМД, наряду с генетическими факторами, атеросклерозом и др., называется анализ патогенетических механизмов на уровне иммунных процессов. Только в последние годы показана важная роль нарушений иммунологических реакций в возникновении и генезе ВМД, выполненных преимущественно в экспериментальных условиях [14, 15]. Местные и системные нарушения интерлейкинового профиля изучены в основном на ранних стадиях ВМД. Вместе с тем исследования интерлейкинов, как важнейшего звена иммунорегуляции, при ВМД немногочисленны [3] и практически не проводились у пациентов пожилого возраста (60-75лет) с поздней стадией заболевания – AREDS 4 (Age-Related Eye Diasease Study). В научных публикациях также отсутствуют сведения о взаимосвязи сывороточных интерлейкинов и показателей оксидантной системы, являющихся важнейшим фактором в патогенезе ВМД [16].
Материал и методы исследования.
Исследование проведено в Тамбовском филиале МНТК «Микрохирургия глаза имени академика С.Н. Фёдорова» в 2016-2018 гг. В клинических условиях сформированы основная группа в количестве 57 больных в возрасте 60-74 года с ВМД 4-й стадии (средний возраст 69,4±2,4 года) и контрольная группа в количестве 52 человек без ВМД аналогичного возраста (средний возраст 68,8±2,1 лет) (P˃0,05).
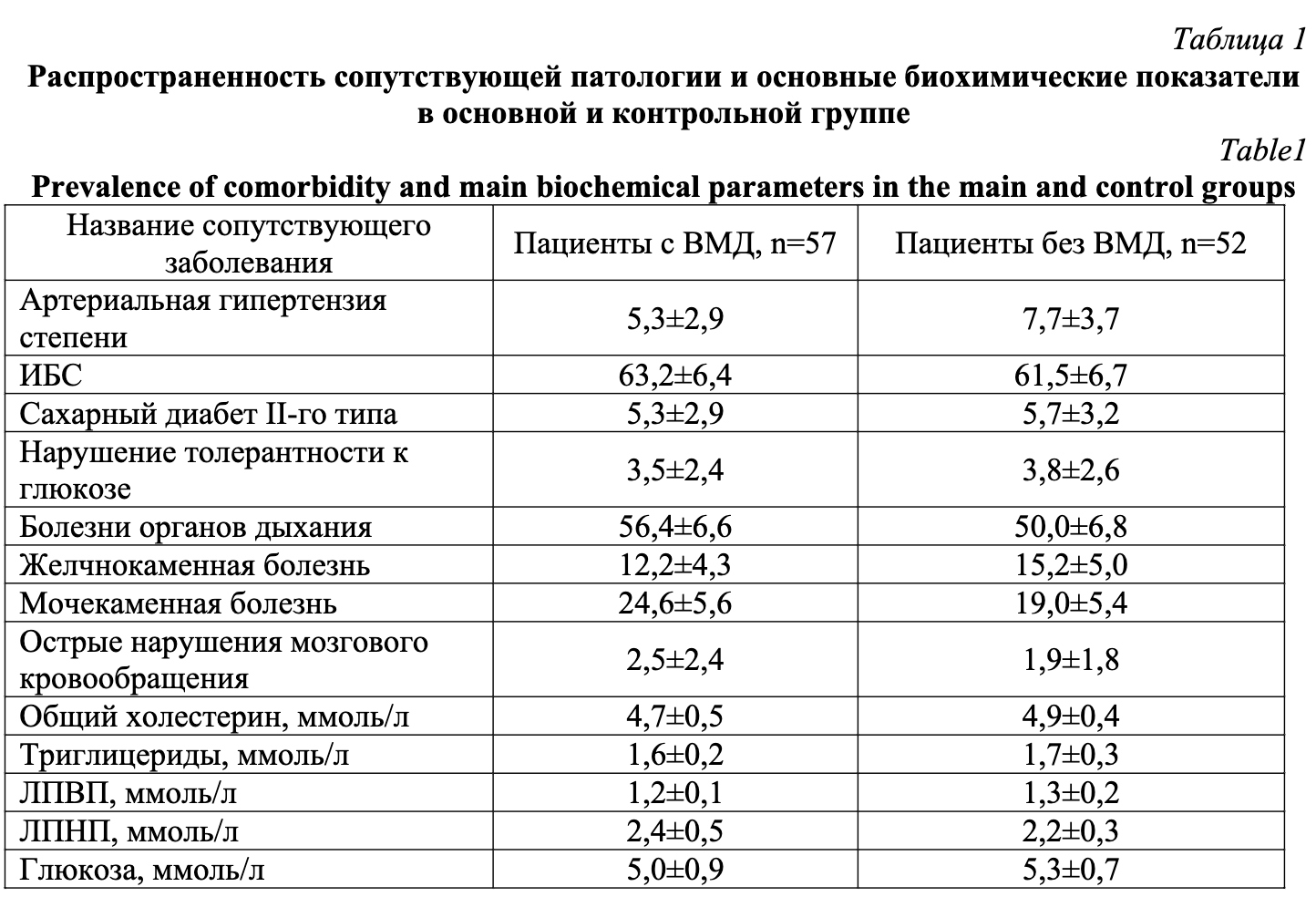
Исследуемые группы не имели статистически значимых различий по частоте сопутствующих заболеваний и основным биохимическим показателям (табл. 1). Среди сопутствующей патологии в обеих группах преобладала ИБС, болезни органов дыхания. Высокую распространенность как в основой группе, так и в контроле имела мочекаменная болезнь. Средние значения основных биохимических показателей соответствовали референсным в обеих группах.
Критериями невключения в основную и контрольную группы являлись наличие: возраст более 74 лет, артериальной гипертензии II-III степени, абдоминального ожирения, метаболического синдрома, дислипидемии, индекса атерогенности более 3 ммоль/л, аутоиммунных заболеваний, острого воспалительного процесса любой локализации, злокачественных новообразований.
Среди больных основной и контрольной групп гериатрические синдромы встречались соответственно со следующей частотой: деменция – 1,8% и 3,5% синдромом мальнутриции – 1,8% и 3,8% от всех больных в группе, когнитивный дефицит по Монреальской шкале (Montreal – Cognitive Assessment, MoCA) составил 17,8±0,3 балла и 16,4±0,5 балла при норме 26-30 баллов (P>0,05 во всех случаях).
Содержание интерлейкинов в сыворотке крови определяли на проточном цитометре BD FACS Canto 2 посредством набора CBA (BD Biosciences, USA). При определении продуктов перекисного окисления липидов использовали спектрофотометр СФ-16. Выполнение исследования проводилось в соответствии с соблюдением этических принципов и стандартов надлежащей клинической практике (Good Clinical Praktike). У всех пациентов получено письменное информированное согласие на использование и обработку данных в научных целях.
При статистической обработке полученных результатов применялась программа «Statistica 6.0» для выявления корреляционных связей, считавшихся достоверными при P≤0,05. Оценка достоверности различий выполнилась по непараметрическому критерию Т-Уайта.
Результаты и их обсуждение.
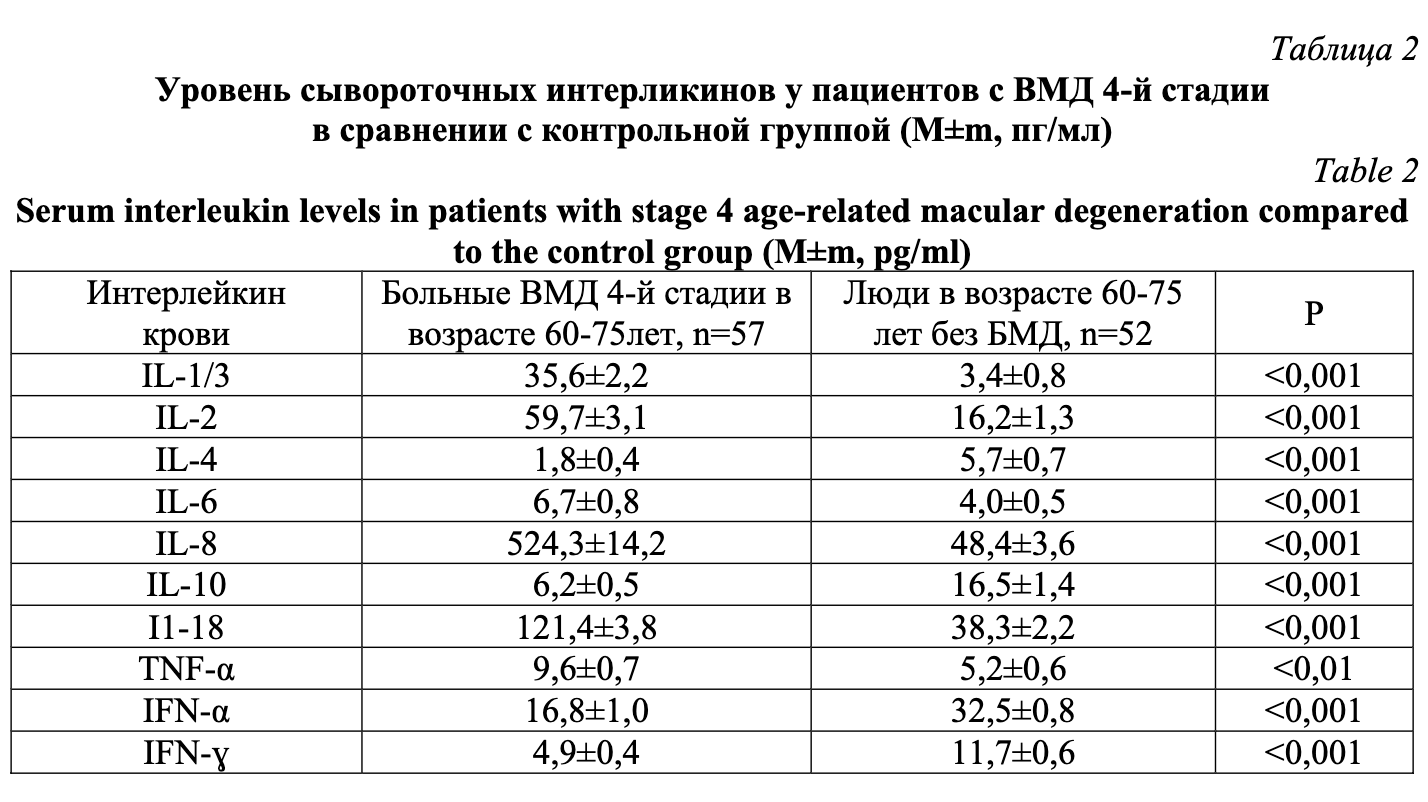
У больных ВМД AREDS-4 пожилого возраста в сравнении с возрастным контролем установлены статические значимые отклонения по всем изученным сывороточным интерлейкинам (табл. 1). Однако содержание системных провоспалительных интерлейкинов при развитии ВМД 4-й стадии характеризуется значительным повышением, а противовоспалительных интерлейкинов – существенным снижением по отношению к группе возрастного контроля. Среди провоспалительных интерлейкинов крови максимальный подъем у пациентов основной группы выявлен для IL-1β и IL-8, имеющих многократное и практически эквивалентное увеличение. Уровень других провоспалительных интерлейкинов IL-2 и IL-6, IL-18 в сыворотке крови больных ВМД 4-й стадии повысился в меньшей степени. Содержание TNF-α среди пациентов с рассматриваемой патологией также увеличилось (p˂0,01).
Среди противовоспалительных интерлейкинов у больных ВМД 4-й стадии отмечается в сравнении с контрольной группой статистически значимое снижение в сыворотке крови (табл. 2). При этом наибольшее уменьшение свойственно IL-4, уровень которого понизился более чем в 3 раза (P˂0,001). Вторым по величине снижения в группе провоспалительных интерлейкинов является IL-10. Содержание IFN-α с ВМД 4-й стадии достоверно уменьшилось против лиц контроля (P˂0,001).
Анализ нарушений в оксидантной системе крови больных ВМД 4-й стадии выявил статистически значимое в сравнении с возрастным контролем повышение всех показателей свободно-радикального окисления липидов (табл. 3). Увеличение малонового диальдегида на системном уровне у больных с ВМД 4-й стадии является наивысшим, что указывает на его первостепенное значение в генезе обсуждаемой патологии глаза. В наименьшей степени в основной группе повысилось содержание гидроперекисей липидов (P˂0,001).

Корреляционный метод у больных с ВМД 4-й стадии показал наличие прямых достоверных связей IL-1β c уровнем малонового диальдегида (r=+0,786, P˂0,01), диеновых коньюгат (r=+0,542, P˂0,01) и гидроперекисей липидов (r=+0,186, P˃0,05).Изменение сывороточного IL-8 находится в прямой корреляционной связи с содержанием в крови малонового диальдегида (r=+0,824, P˂0,001), диеновых коньюгат (r=+0,613, P˂0,01) и гидроперекисей липидов (r=0,208, P˂0,05). Средние прямые корриляционные связи установлены также между IL-2, IL-18 и показателями системного свободнорадикального окисления (P˂0,05), за исключением гидропереписей липидов. Между уровнем противовоспалительных интерлейкинов (IL-4, IL-10) и показателями оксидатного статуса больных ВМД 4-й стадии обнаружена обратная зависимость. Так, сывороточный IL-4, имеет обратную среднюю корреляционную связь с уровнем малонового диальдегида в крови (r=-0,467, P˂0,05) и диеновых коньюгат (r=-0,502, P˂0,05). Изменение IL-10 в сыворотке крови у пациентов с изученной патологией коррелирует с малоновым диальдегидом (r=-0,513, P˂0,01) и гидроперекисью липидов (r=-0,325, P˂0,05). Корреляционные связи других интерлейкинов, интерферонов и показателей перекисного окисления липидов при ВМД недостоверны.
Следовательно, далекозашедшая стадия (AREDS-4) ВМД ассоциируется с нарастанием системной провоспалительной реакции – повышением выработки всех провоспалительных интерлейкинов – и выраженной селективной гиперсекрецией IL-1β и IL-8, способствующих, по мнению [17, 18], нарастанию локальных ангиогенных эффектов, характерных для поздней 4-й стадии ВМД. Именно эти изменения, на наш взгляд, обусловливают активацию иммунопатологических реакций, что соответствует концепции воспаления в развитии ВМД [17, 18]. Иммунологические нарушения и пожилой возраст играют существенную роль в возникновении и развитии ВМД [14].
Важнейшим фактором в патогенезе ВМД является и усиление процессов свободнорадикального окисления липидов, выявленное нами в виде достоверного повышения гидроперекисей липидов, диеновых конъюгат и малонового диальдегида. Это согласуется с данными Мякотных В.С. и др. [19], установивших, что в пожилом возрасте увеличивается уровень диеновых конъюгат в крови и значительно снижаются показатели антиоксидантной системы в 61-70 лет.
Заключение.
Формирование далеко зашедшей стадии ВМД в пожилом возрасте сопровождается существенным повышением всех провоспалительных интерлейкинов и показателей оксидатного статуса на системном уровне. Напротив, продукция противовоспалительных интерлейкинов у больных ВМД пожилого возраста достоверно снижается. Изменения IL-1β, IL-8,Il-2,IL-18 имеют прямые корреляционные связи с показателями системного свободорадикального окисления. Уровень противовоспалительных интерлейкинов (IL-4 и IL-10) находится в обратной зависимости с содержанием продуктов перекисного окисления липидов. Следовательно, развитие 4-й стадии ВМД ассоциируется прежде всего с сывороточными IL-1β, IL-8, IL-4, IL-10, малоновым диальдегидом и диеновыми конъюгатами. Полученные результаты следует использовать в гериатрической практике при рацианализации диагностики и терапии больных с далекозашедшей ВМД.






Список литературы
1. Абдулаева Э.А. Роль системы комплемента и других воспалительных факторов в развитии возрастной макулярной дегенерации // Казанский медицинский журнал. 2018. Т. 99, N 4. С. 657-664. DOI: https://doi.org/10.17816/KMJ2018-657
2. Телегина Д.В., Кожевникова О.С., Колосова Н.Г. Молекулярные механизмы гибели клеток в сетчатке при развитии возрастной молекулярной дегенерации // Успехи геронтологии. 2016. Т. 29, N 3. С. 424-432.
3. Тур Е.В., Кузнецов А.А., Быстров А.М. Оценка уровня цитокинов слезы у пациентов с неоваскулярной возрастной макулярной дегенерацией // Российский иммунологический журнал. 2016. T. 10(19), N 3. С. 361-362.
4. Comparison of Clinical Trial and Systematic Review Outcomes for the 4 Most Prevalent Eye Diseases / I.J. Saldanha [et al.] // JAMA Ophthalmol. 2017. Vol. 135, N 9. P. 933-940. DOI: 10.1001/jamaophthalmol.2017.2583
5. Characteristics of symptoms experienced by persons with dry eye disease while driving in China / Y. Wang [et al.] // Eye (Lond). 2017. Vol. 31, N 11. P. 1550-1555. DOI: https://doi.org/10.1038/eye.2017.88
6. WHO. Prevention of Blindness and Visual Impairment. Priority Eye Diseases [Electronic]. 2017. URL: https://www.who.int/blindness/causes/priority/en/index7.html (дата обращения: 03.05.2018).
7. Present and possible therapies for age-related macular degeneration / M. Khan [et al.] // ISRN ophthalmol. 2014. Vol. 2014. Article ID 608390. DOI: http://dx.doi.org/10.1155/2014/608390
8. Akpek E.K., Smith R.A. Overview of age-related ocular conditions // Amer. J. Managed Care. 2013. Vol. 19, N 5. P. s67-s75.
9. Neighborhood Deprivationand Riskof Age-Related Eye Diseases: A Follow-up Studyin Sweden / T. Hamano [et al.] // Ophthalmic Epidemiol. 2015. Vol. 22, N 5. P. 308-320. DOI: https://doi.org/10.3109/09286586.2015.1056537
10. Nowak M.S., Smigielski J. The Prevalence of Age-Related Eye Diseases and Cataract Surgery among Older Adults in the City of Lodz // Poland J Ophthalmol. 2015. Vol. 2015. Article ID 605814. DOI: https://doi.org/10.1155/2015/605814
11. Prevalence of age-related macular degeneration in elderly Caucasians: the Tromso eye study / M.G. Erke [et al.] // Ophthalmology. 2012. Vol. 119, N 9. P. 1737-1743. DOI: https://doi.org/10.1016/j.ophtha.2012.03.016
12. Prevalence and pattern of vitreo-retinal diseases in Nepal: the Bhaktapur glaucoma study / S.S. Thapa [et al.] // BMC Ophthalmology. 2013. Vol. 13, P. 9. DOI: https://doi.org/10.1186/1471-2415-13-9
13. Коняев Д.А. Медико-эпидемиологический анализ заболеваемости и анти-VEGF лечения экссудативной формы возрастной макулярной дегенерации в Тамбовской области за 6 лет // Вестн. Тамбовского Университета. 2016. T. 21. С. 1583-1586.
14. Ambati J., Atkinson J.P., Gelfand B.D. Immunology of age-related macular degeneration // Nature Reviews Immunology. 2013. Vol. 13. P. 438-451. DOI: https://doi.org/10.1038/nri3459
15. Penfold P.L. Inflammation and age-related macular degeneration // JAMA. 2004. Vol. 291, N 6. P. 704-710.
16. Zarbin M.A. Current concepts in the pathogenesis of age – related macular degenerationes // Archives of Ophthalmology. 2004. Vol. 122, N 4. Р. 598-614. DOI: 10.1001/archopht.122.4.598
17. Immunological and aetiological aspects of macular degeneration / P.L. Penfold [et al.] // Prog. Retin. Eye. Res. 2001. Vol. 20, N 3. P. 385-414. DOI: https://doi.org/10.1016/S1350-9462(00)00025-2
18. Penfold P.L. Inflammation and age-related macular degeneration // JAMA. 2004. Vol. 291, N 6. P. 704-710. DOI: 10.1001/jama.292.1.43-a
19. Сравнительная биохимия процесса старения мужчин и женщин / В.С. Мякотных [и др.] // Успехи геронтологии. 2014. Т. 27, N 4. С.612-620.